NF-κB的作用是什么?
NF-κB(核因子κ轻链增强子激活B细胞因子)是一组作为转录因子发挥作用的蛋白质,在调控与多种细胞功能相关的基因表达中起着关键作用,包括:
- 先天与适应性免疫反应及炎症反应,包括炎症小体的调控(Oeckinghaus, 2009;Liu, 2017)。
- 细胞增殖、细胞存活(抗凋亡)、代谢、细胞应激反应及突触可塑性(Oeckinghaus, 2009;Albensi, 2019;Capece, 2022)。
NF-κB转录因子家族包含NF-κB1(p105/p50)、NF-κB2(p100/p52)、RELA(p65)、RELB及c-REL(Barnabei, 2021;Capece, 2022;Guo, 2024)。NF-κB在不同免疫细胞中的作用各异(Zinatizadeh, 2021;Anilkumar, 2024;Guo, 2024):
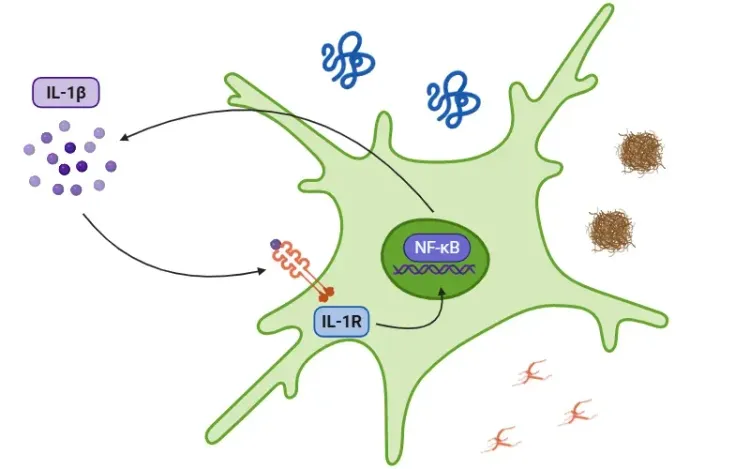
- 巨噬细胞与树突状细胞:NF-κB通过促进TNFα、IL-1β、IL-6、IL-12及COX-2等细胞因子的释放来驱动炎症反应。
- 有关神经炎症中细胞因子的更多信息,请参阅我们的资源:《什么是IL-1β?》《IL-1β与神经退行性疾病》《TNF-α&神经退行性疾病中的小胶质细胞"以及"TNF-α &神经退行性疾病中的星形胶质细胞"。
- T细胞:NF-κB刺激细胞因子(主要是IL-2)的产生,该因子对T细胞增殖及向Th1、Th2、Th17和Treg等亚型分化至关重要。
- B细胞:NF-κB促进B细胞的增殖、存活和分化。
NF-κB信号通路
- 通常,NF-κB 与一种称为 IκB(包括 p100、p105、IκBα 和 IκBβ)的抑制性蛋白质结合,使其在细胞质中保持不活性状态。
- I-kappaB激酶(IKK)家族激活NF-κB,使其转位至细胞核,从而促进基因表达。
主要存在两条信号通路:
- 经典通路(Oeckinghaus, 2009;Liu, 2017;Capece, 2022):
- 激活源于促炎信号,包括细胞因子(如TNFα、IL-1β)、细菌病毒产物、活性氧(ROS)及辐射等。关键受体包括白细胞介素-1受体(IL-1R)、Toll样受体(TLR)、TNF受体(TNFR)、T细胞受体(TCR)和B细胞受体(BCR)。
- 每种信号通过不同的肿瘤坏死因子受体相关因子(TRAF)激活IKK复合体的机制各不相同。
- 总体而言,该级联反应激活了转化生长因子-β激活激酶1(TAK1),进而激活了IKK复合物(IKKα和IKKβ)及其相关激酶NEMO(也称为IKKγ)。
- 激活的IKK复合物通过磷酸化IκB(主要为IκBα)促进NF-κB转运至细胞核。
- 在细胞核内,NF-κB二聚体结合至κB DNA序列,促进以下基因转录:
- 促炎性细胞因子(如IL-1β、IL-6和TNFα),以进一步放大炎症反应。
- 趋化因子以招募其他免疫细胞。
- 黏附分子以吸引白细胞至炎症组织。
- 其他炎症介质(如COX-2和iNOS)。
- 非经典通路(Lawrence, 2009;Oeckinghaus, 2009;Liu, 2017):
- 该通路激活速度慢于经典通路。
- TNF超家族的特异性受体可触发该通路,包括B淋巴细胞激活因子受体(BAFF-R)、CD40、β淋巴毒素受体(LTβR)及NF-κB受体活化因子(RANK)。
- 这些受体的激活招募不同类型的TRAF成员来激活NF-κB诱导激酶(NIK)。
- 随后 NIK 的激活导致 IKKα 同源二聚体的磷酸化。
- NIK 和 IKKα 磷酸化 p100(NF-κB2 前体蛋白),将其转化为称为 p52 的活性形式。
- p52 形成 p52/RelB 二聚体,并转位到细胞核中促进基因转录,调节免疫细胞的生存、通信、发育以及 T 和 B 细胞的成熟。
由于许多信号分子在经典和非经典通路中均被激活,因此与其他重要信号通路(如PI3K/AKT、MAPK、JAK-STAT和TGF-β)存在直接与间接的交叉调控(Guo, 2024)。
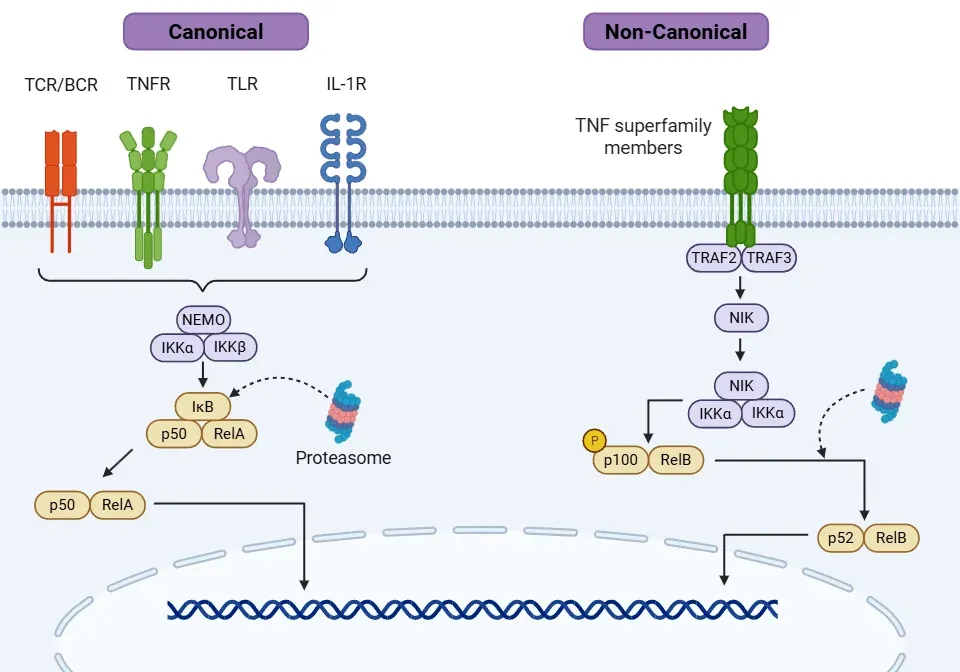
NF-κB信号通过经典和非经典途径传递。
NF-κB失调在疾病中的影响是什么?
NF-κB的作用机制复杂且具有情境依赖性,其效应可呈现双面性(Albensi, 2019)。尽管NF-κB对维持机体稳态至关重要,但其调控异常与多种疾病密切相关,包括神经系统疾病、癌症、炎症性疾病及自身免疫性疾病。
神经系统疾病
在生理条件下,神经元中的NF-κB活性对维持正常神经功能至关重要,包括神经发生、神经突发生及突触可塑性(Shih, 2015)。
- 在神经元中,NF-κB通常通过诱导抗凋亡基因(如Bcl-2、Bcl-XL及锰超氧化物歧化酶)促进细胞存活(Anilkumar, 2024)。
- 在小胶质细胞中,NF-κB的激活驱动促炎反应,导致细胞因子(TNF-α、IL-1β、IL-6、IFN-γ)和活性氧(ROS)的释放(Shih, 2015;Anilkumar, 2024)。
- 请参阅我们的资源《神经退行性疾病中的TNF-α与小胶质细胞》。
- 在星形胶质细胞中,NF-κB活化对星形胶质细胞分化至关重要,并可增强炎症反应(Anilkumar, 2024)。
- 请参阅我们的资源《神经退行性疾病中的TNF-α与星形胶质细胞》。
然而,NF-κB的失调激活会导致病理状态:
- 多发性硬化症(MS):
- NF-κB通过浸润性巨噬细胞、小胶质细胞、星形胶质细胞及外周免疫细胞介导神经炎症。
- NF-κB对T细胞向调节性T细胞(Treg)的转化至关重要,促进炎症性T细胞的致病作用(Guo, 2024)。
- 在实验性自身免疫性脑脊髓炎(EAE)中,NF-κB激活会引发神经炎症。值得注意的是,在髓系细胞中特异性敲除IKKβ可预防EAE的诱导,这与炎症性Th1和Th17细胞产量的降低相关(Liu, 2017)。
- 阿尔茨海默病(AD)与帕金森病(PD):
- 在这些疾病中,小胶质细胞激活的NF-κB通过反应性小胶质细胞和星形胶质细胞促进促炎细胞因子的进一步释放,导致神经毒性并促进神经退行性变(Guo, 2024)。
- 然而在AD小鼠模型中,抑制NF-κB反而加速β淀粉样蛋白(Aβ)和tau蛋白的积累,表明NF-κB在疾病早期可能具有保护作用(Jong Huat, 2024)。
- 创伤性脑损伤与脊髓损伤:
- NF-κB在急性事件后的炎症反应中发挥作用,从而导致继发性损伤(Guo, 2024)。
癌症
- NF-κB主要通过非经典通路的异常激活促进肿瘤发生。不同癌症类型的机制存在差异,但总体机制包括以下方面(Aggarwal, 2011;Xia, 2014):
- 促进细胞存活与增殖:NF-κB通过增强周期蛋白D1、E及c-Myc的表达,同时借助Bcl-2、Bcl-XL和IAPs等因子抑制凋亡,促使癌细胞失控分裂(Brown, 2008;Rinkenbaugh, 2016)。
- 有关焦死、凋亡和坏死性凋亡的更多信息,请参阅资源《什么是焦死?》。
- 促进血管生成:NF-κB通过VEGF、FGF、PDGF和IL-8等促血管生成因子促进新生血管形成,同时诱导上皮-间质转化,从而支持肿瘤生长与转移(Brown, 2008;Park, 2016)。
- 免疫逃逸:NF-κB通过TGF-β参与构建免疫抑制性肿瘤微环境(Rinkenbaugh, 2016;Guo, 2024)。
- 代谢重编程:NF-κB改变代谢通路,导致氮需求增加及线粒体氧化磷酸化异常 (Guo, 2024)。
- 促进细胞存活与增殖:NF-κB通过增强周期蛋白D1、E及c-Myc的表达,同时借助Bcl-2、Bcl-XL和IAPs等因子抑制凋亡,促使癌细胞失控分裂(Brown, 2008;Rinkenbaugh, 2016)。
- 直接激活NF-κB的突变在血液癌症中常见。例如,B细胞起源的非霍奇金淋巴瘤中存在c-Rel基因扩增,而NF-κB2/p100常通过染色体易位被激活(Xia, 2014)。
- 异常的NF-κB调控已在多种癌症类型中被识别,包括鳞状细胞癌、乳腺癌、肺癌和结直肠癌(Brown, 2008)。
自身免疫与炎症性疾病
- 类风湿性关节炎(RA):NF-κB 使慢性炎症持续存在,并在 RA 患者的滑液中被发现。它促进关节内T细胞产生炎症细胞因子(IFNγ、IL-15、IL-17、IL-18)并诱导骨吸收性破骨细胞分化(Liu, 2017;Guo, 2024)。
- 炎症性肠病(IBD):该病症与NF-κB基因突变相关,克罗恩病和溃疡性结肠炎等疾病中均已发现此类突变。在IBD患者的结肠组织中观察到NF-κB的激活(Liu, 2017)。
- 其他与NF-κB失调相关的自身免疫性疾病包括系统性红斑狼疮和1型糖尿病(Guo, 2024)。
- 存在NF-κB失调的炎症性疾病包括痛风、哮喘、急性肾损伤、动脉粥样硬化、心肌梗死及COVID-19感染(Lawrence, 2009;Liu, 2017)。
NEMO缺陷综合征
- NEMO缺乏综合征是一种X连锁遗传性疾病,主要特征为外胚层发育不良和免疫缺陷,导致感染易感性增加。
- 该病由IKBKG基因突变引起,该基因编码NEMO蛋白。突变导致NF-κB过度激活(Pescatore, 2022)。
哪些潜在治疗策略以NF-κB为靶点?
针对NF-κB信号通路的不同环节,已开发出多种治疗策略。NF-κB兼具抗肿瘤与促肿瘤的双重作用,这使得其治疗应用变得复杂(Xia, 2018)。
- IKK抑制剂(Yu, 2020;Guo, 2024;Li, 2024):
- 阿司匹林:COX与IKKβ抑制剂,已应用于多种癌症动物模型。
- 磺胺吡啶:通过抑制TLR4、MyD88及NF-κB p65蛋白表达发挥作用的抗生素,在体内模型中用于预防骨转移。
- 地塞米松:一种糖皮质激素,可抑制NF-κB的RelA亚基。
- 抗肿瘤药物:沙利度胺和来那度胺可抑制NF-κB活化,在肺癌、白血病及多发性骨髓瘤治疗中展现潜力。
- 单克隆抗体(Yu, 2020;Guo, 2024):
- 蛋白酶体抑制剂(Rasmi, 2020;Guo, 2024;Li, 2024):
- 硼替佐米、卡非佐米、伊沙佐米:抑制IκBα降解并抑制NF-κB活性。获FDA批准用于多发性骨髓瘤、弥漫性大B细胞淋巴瘤及非小细胞肺癌治疗。
- 核转位抑制剂(Sivamaruthi, 2023;Guo, 2024):
- 他克莫司:免疫抑制剂。通过阻断活化T细胞核因子激活,进而抑制NF-κB活化。
- IκBα超抑制剂:持续性抑制NF-κB。
- SN50肽通过与核转位相关蛋白复合物竞争结合来抑制NF-κB。
- 一种靶向NF-κB与NLRP3炎症小体的纳米寡聚体,通过抑制其转录与翻译过程,在阿尔茨海默病小鼠模型中显著减轻神经炎症并改善认知功能(Wahl, 2024)。
- 请参阅我们的资源《NLRP3炎症小体与神经退行性疾病》。
部分非专门开发的NF-κB抑制剂被发现可干扰NF-κB激活(Roberti, 2022):
在多发性硬化症中:
- 甲磺酸伊马替尼:抑制多种酪氨酸激酶,同时抑制IκB磷酸化,目前正针对MS开展II期临床试验(Barnthaler, 2019)。
- 托泊替康:抑制IKKβ,可减轻EAE小鼠模型的炎症反应(Roberti, 2022)。
在阿尔茨海默病中:
- 阿格列汀:一种降糖药物,可在体外 调节TLR4/MyD88/NF-κB通路( El-Sahar, 2021)。
- 替米沙坦:降压药物,可能通过降低IL-1β间接抑制NF-κB活性(Sivamaruthi, 2023)。
在脑卒中领域:
因此,靶向NF-κB信号通路为开发多种疾病(包括神经系统疾病、癌症和自身免疫性疾病)的治疗策略提供了前景广阔的途径。全面理解NF-κB的作用机制对于优化这些策略、改善各类疾病的治疗效果至关重要。
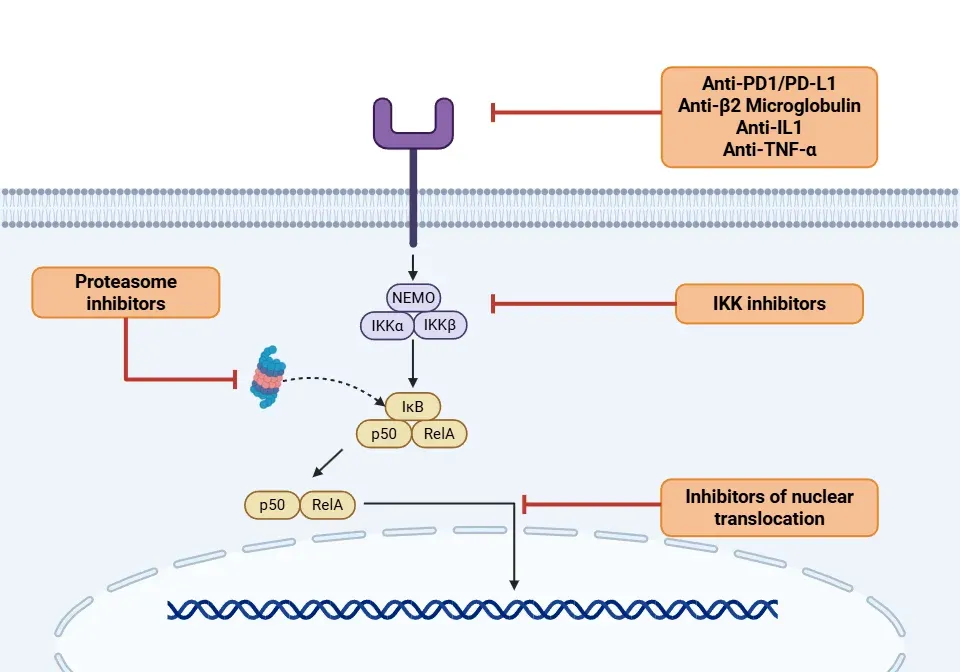
NF-κB疗法的作用机制通过其信号传导通路得以阐释。
我们的团队很乐意解答关于核因子κB的任何疑问,或提供有关我们用于治疗有效性研究的神经退行性疾病模型的具体信息。
相关内容
关于神经炎症的最新信息,以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
什么是IL-1β?
白细胞介素-1β(IL-1β)的概述、其在全身性及神经系统疾病中的促炎作用,以及基于IL-1β拮抗作用的治疗策略。
白细胞介素-1β(IL-1β)与神经退行性疾病
白细胞介素-1β(IL-1β)在神经退行性疾病中的作用,包括阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
神经退行性疾病中的TNF-α和微胶质细胞
概述肿瘤坏死因子-α(TNF-α)在小胶质细胞中的作用及其对神经退行性病变进展的影响。
TNF-α与神经退行性疾病中的星形胶质细胞
星形胶质细胞中TNF-α信号传导的概述、其在神经退行性变中的作用以及针对该通路的治疗策略。
什么是炎症小体?
概述炎性體,包括其作用機制、在疾病中的角色,以及藥物開發的目標。
什么是焦死?
凋亡性坏死的概述、其在多种疾病中的作用以及与凋亡性坏死通路相关的治疗策略。