突触核蛋白模型概述
α-突触核蛋白(α-synuclein;α-syn)是一种主要的致病蛋白,存在于路易体和黑质致密部神经突中,在帕金森病(PD)中也会出现在其他脑区。对于这种帕金森病动物模型,我们将重组人α-前体纤维(PFF)植入M83转基因小鼠(B6;C3-Tg( Prnp SNCA A53T )83Vle/J)的大脑中,这些小鼠体内过表达α-突触核蛋白;或者将重组小鼠α-突触核蛋白注射到非转基因野生型(B6-C3H)小鼠的大脑中。
我们经过验证的注射部位包括:前嗅核(AON)、纹状体+/-覆盖大脑皮层以及前脑束(MFB)。
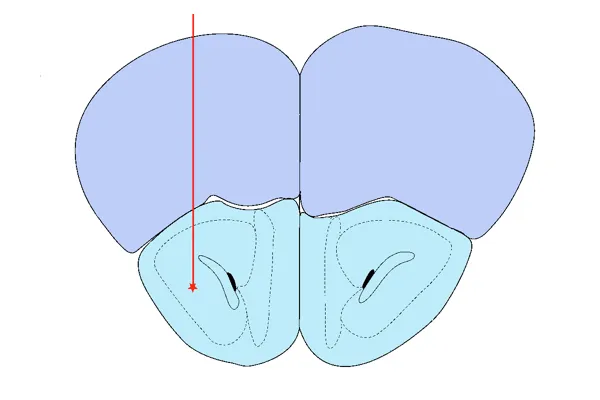
AON 注射
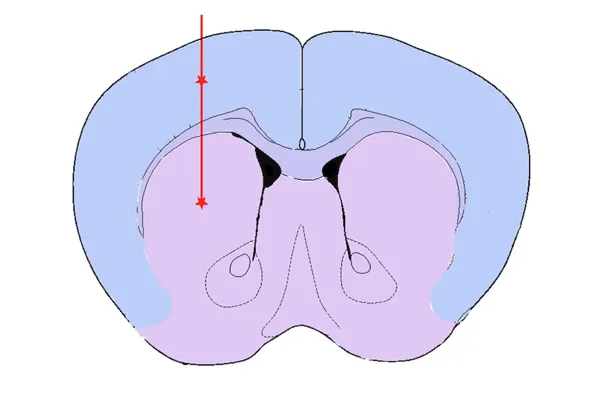
纹状体和覆盖皮层注射
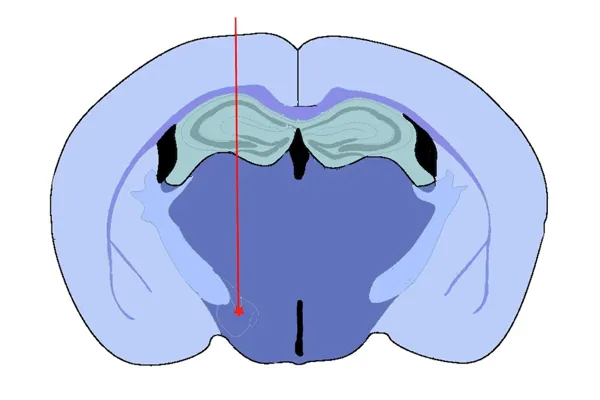
前脑束(MFB)注射
将重组前纤维注射到前嗅核(AON)后,α-突触核蛋白病理扩散的空间模式。
选择前嗅核(AON) 作为靶点的理由包括 :
- 它是人类帕金森病(Braak第一阶段)中最早出现α-突触核蛋白病理的部位之一
- 与边缘系统相关的非运动症状(如嗅觉减退/丧失、睡眠改变)是帕金森病的早期症状,且普遍存在
- 前额叶皮层与大脑同侧和对侧多个区域相连,包括与嗅球、杏仁核、梨状皮层的直接(一级)连接,以及与嗅皮层和海马等高级连接;这些区域中的许多区域极易发生神经退行性病变
选择纹状体+/-覆盖皮层作为注射部位的理由包括:
- 这是最初报道的注射部位(Luk等人 ,《实验医学杂志》,209:975-986,2011;doi:10.1084/jem.20112457;Luk等人,《科学》杂志)。Med., 209: 975-986, 2011; doi: 10.1084/jem.20112457;Luk et al.,Science,338: 949-953, 2012; doi: 10.1126/science.1227157)
- 纹状体中的多巴胺能神经末梢源自黑质中的神经元
- 注射到大脑皮层上会增加大脑中α-突触核蛋白病理的范围
我们选择前脑束(MFB) 作为靶点的理由包括 :
- 它是一条直接连接黑质和腹侧被盖区的神经束,在人类帕金森病的毒素模型(如6-羟基多巴胺 [6-OHDA])中经常被作为靶点
- 它是许多其他脑区投射的“中枢”,因此是促进α-突触核蛋白病理向远处脑区扩散的绝佳起始点
- 这种模型会导致黑质中酪氨酸羟化酶阳性的多巴胺能神经元丢失,并伴有运动障碍
这种帕金森病动物模型的一大优势在于它能够再现人类疾病的许多方面,包括
- α-突触核蛋白在明确的空间和时间模式中高度可重复地扩散,导致神经元细胞体和神经突触中出现广泛的α-突触核蛋白病理
- 强烈的神经炎症(活化的小胶质细胞和反应性星形胶质细胞
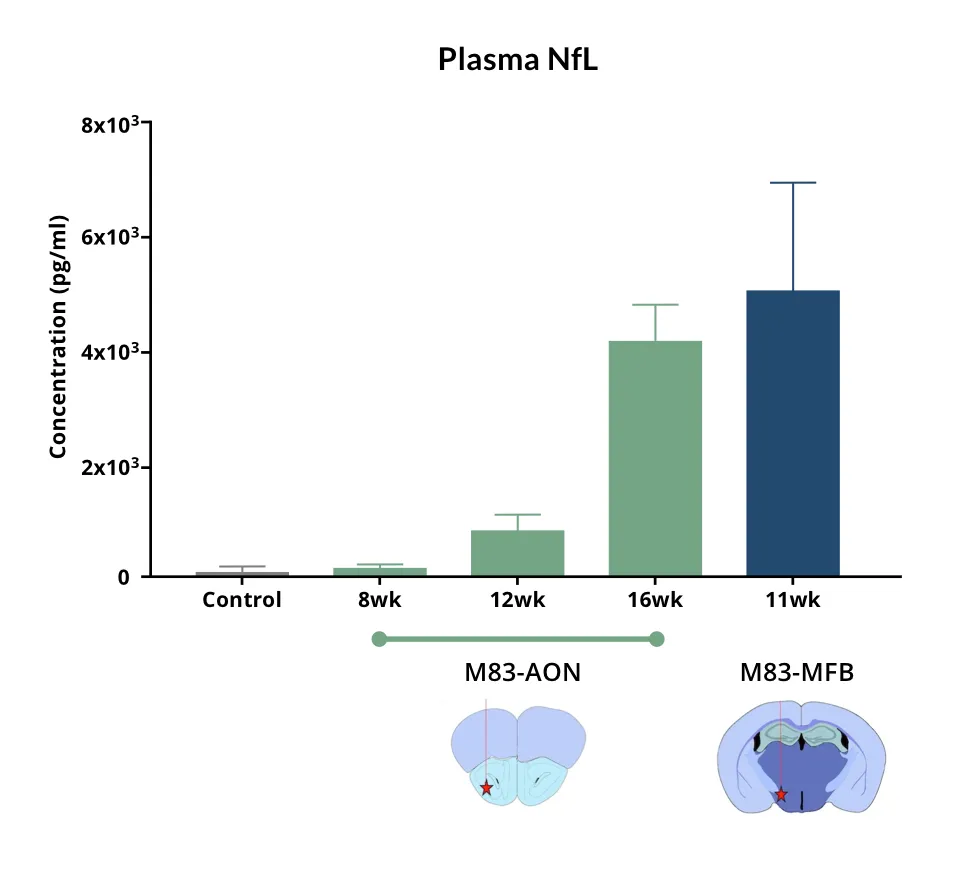
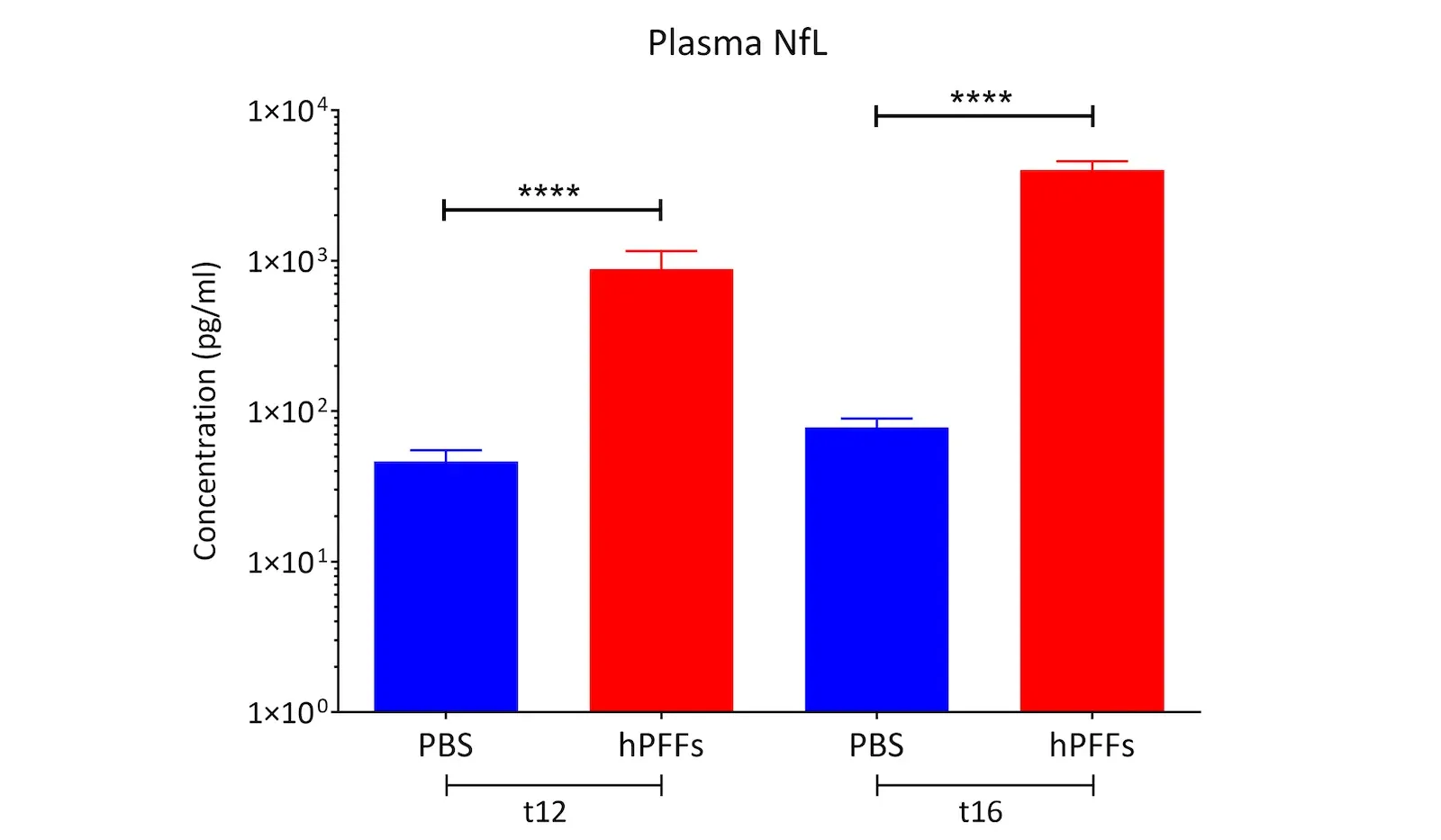
- 神经变性,血液和脑脊液中神经丝轻链(NfL;NF-L)水平升高
- 可测量的行为变化(例如运动功能、睡眠
- 可通过治疗干预来改变病情
突触核蛋白模型的生成
产生PFF动物模型的泛型方案是:
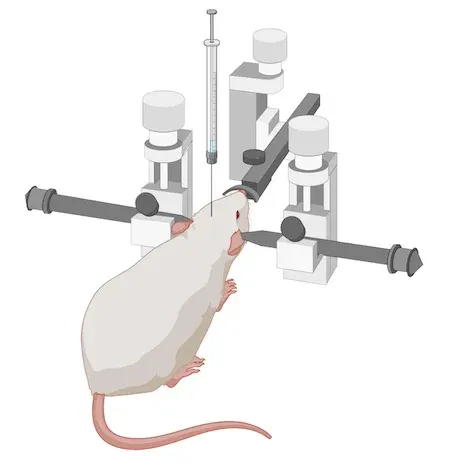
我们获得了M83转基因(tg)小鼠的许可。作为临床前神经科学合同研究组织,我们在Biospective公司内部拥有完善的α-突触核蛋白转基因小鼠繁殖群,这使我们能够进行大规模(>100只小鼠)研究。
对于这种啮齿动物模型,我们将M83+/-小鼠培育至8-12周龄。或者,我们使用8-12周龄的野生型(B6-C3H)小鼠。然后,我们将超声处理过的重组人α-突触核蛋白PFF进行立体定向注射到目标区域。我们使用带有自动微量注射器的数字立体定位设备,以实现高精度和精确度。
这种动物模型具有高度可重复性,在α-突触核蛋白PFF的接种方面几乎可以达到100%的成功率。
我们的“Synuclein小鼠模型”验证了以下指标
- 体重
- 临床评分
- 行为评估
- 运动功能测试
- 睡眠分析
- 核磁共振成像(MRI)脑萎缩(请阅读我们的演示文稿《神经变性小鼠模型中的脑萎缩分析》了解更多信息)
- 血浆和脑脊液中的神经丝轻链测量(更多信息请参阅我们的资源——帕金森病模型中的神经丝轻链
- 免疫组织化学和多重免疫荧光(请阅读我们的演示文稿《帕金森氏病α-突触核蛋白小鼠模型中的微胶质细胞激活》了解更多信息)
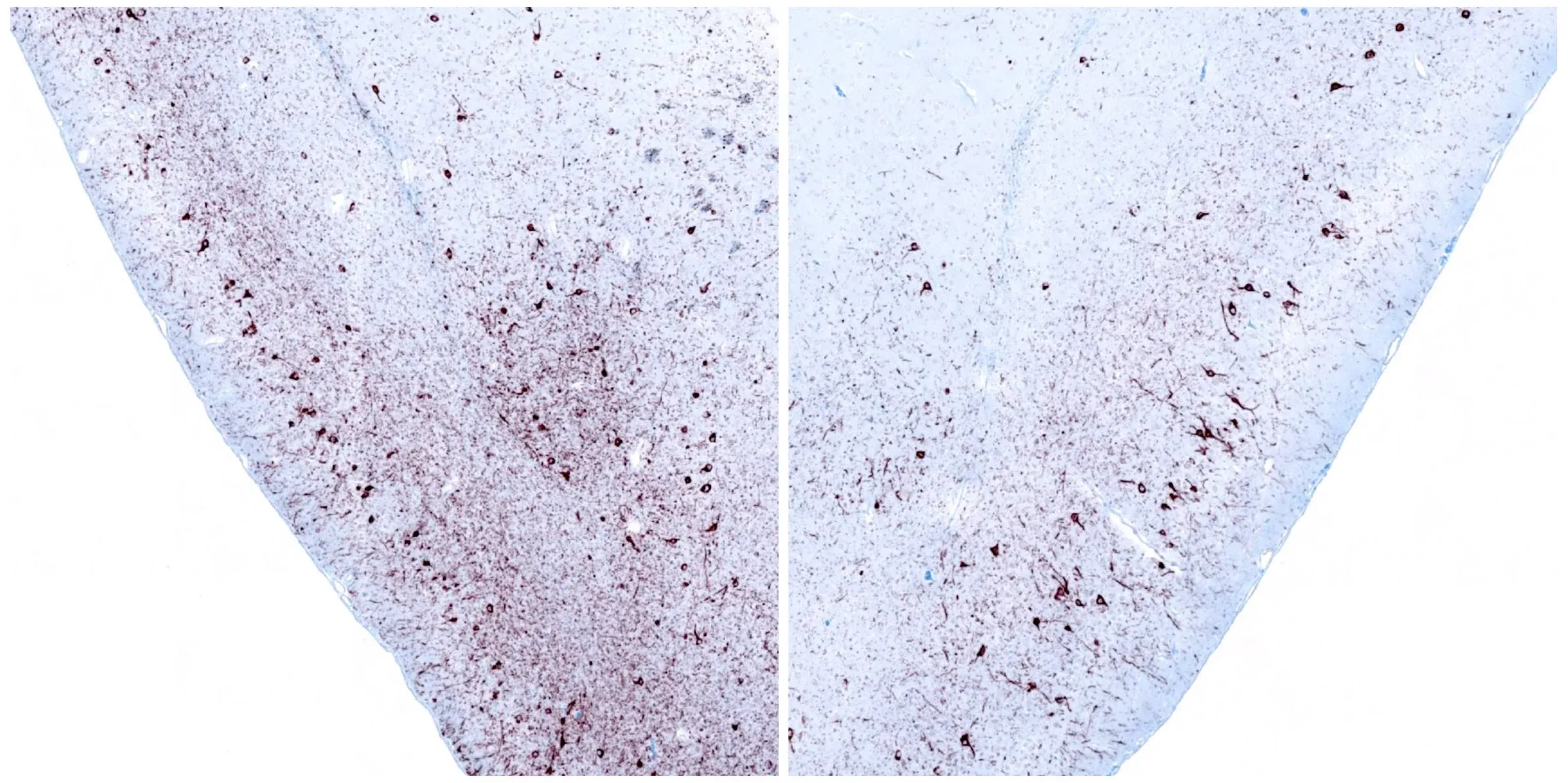
在M83+/-小鼠嗅前核单侧立体定向注射α-突触核蛋白前体纤维后12周,对同侧(左)和对侧(右)的梨状皮层进行磷酸化α-突触核蛋白免疫组织化学染色。
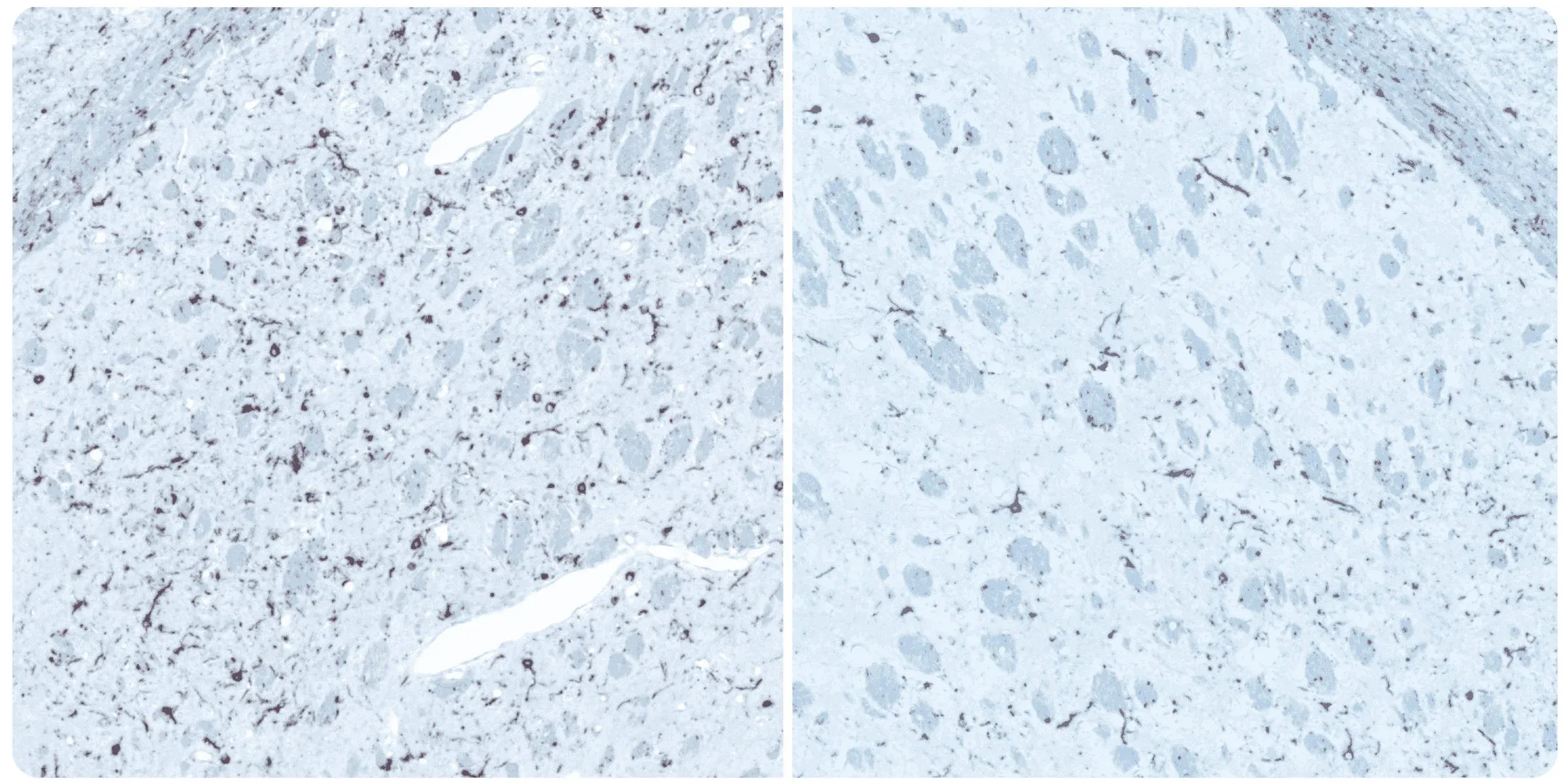
在M83+/-小鼠的纹状体和大脑皮层上注射预先形成的α-突触核蛋白纤维(PFF),12周后对同侧(左)和对侧(右)纹状体进行磷酸化α-突触核蛋白免疫组织化学染色。
了解更多关于我们对该模型的定性、经过验证的测量以及临床前神经科学合同研究组织服务的信息。
了解更多帕金森病车型
相关内容
帕金森病最新信息以及帕金森病动物模型治疗药物评估的最佳实践。
帕金森病模型中的神经丝轻链
神经丝轻链(NfL;NF-L)水平如何作为帕金森病小鼠和大鼠模型的血液(血浆;血清)和脑脊液生物标志物。
帕金森氏病药物研发的α-Synuclein模型
腺相关病毒(AAV)在小鼠和大鼠模型中诱导α-突触核蛋白表达的概述,用于疾病治疗药物的临床前研究。