本资源描述:
什么是焦死?
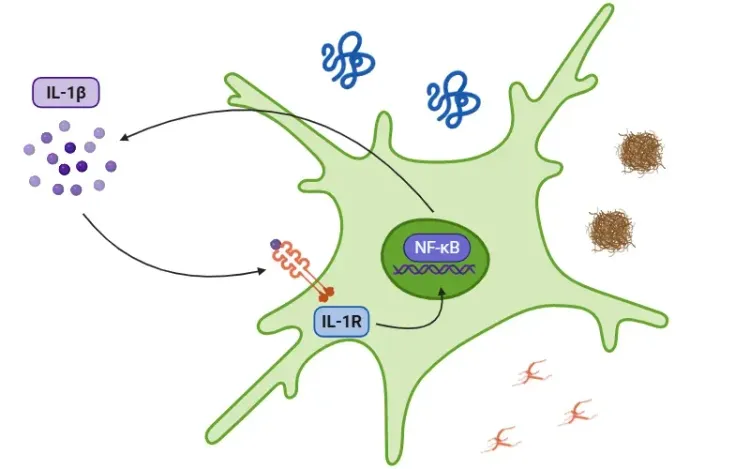
焦死是一种促炎性程序性细胞死亡形式,其特征表现为细胞肿胀、质膜孔隙形成、膜破裂,以及随后释放促炎性细胞内物质(如IL-1β和IL-18)(Vande Walle, 2016;Fang, 2020;Tan, 2021;Rao, 2022)。
参见:什么是IL-1β(白细胞介素-1β)?&白细胞介素-1β(IL-1β)与神经退行性疾病
该过程属于先天免疫系统范畴,通过将病原体排出至细胞外空间作为主要防御机制,使其成为免疫反应的靶标(Vande Walle, 2016)。然而当过度激活时,焦死会引发广泛的细胞死亡、组织损伤及炎症反应,进而诱发多种炎症性与自身免疫性疾病(Shi, 2017;Rao, 2022;Song, 2022)。
"焦死"一词于2001年首次提出,源自希腊语"pyro"(意为火焰或发热)与"ptosis"(意为坠落)。该术语恰如其分地反映了这种细胞死亡途径的促炎特性。值得注意的是,焦死与其他细胞死亡形式(如凋亡和坏死性凋亡)存在显著差异(Fang, 2020;Y. Liu, 2024):
- 凋亡主要参与组织发育和维持稳态,同时协助清除衰老或轻微受损细胞。其通过清除凋亡小体确保过程洁净,从而避免触发炎症反应(Bertheloot, 2021)。
- 坏死性凋亡虽与焦死同样会引发炎症反应,但其执行机制依赖不同分子(具体为RIPK1、RIPK3和MLKL),作为针对成功抑制凋亡的病原体的备用防御机制(Bertheloot, 2021)。
焦死通常由多种半胱天冬酶的激活触发,这些酶通过裂解气丝蛋白(GSDM:A、B、C、D、E及DFNB59或PVJK)发挥作用。其中,Gasdermin D因广泛存在于各类免疫细胞、器官及组织中而成为研究焦点。当GSDM被裂解时,会分裂为N端片段和C端片段。N端片段随后迁移至质膜,通过寡聚化形成巨孔。这些孔道导致水分大量涌入及离子失衡,最终引发细胞肿胀并导致渗透性溶解(Bergsbaken, 2009;Fang, 2020;Yu, 2021)。
凋亡过程中主要涉及四条信号通路(Yu, 2021):
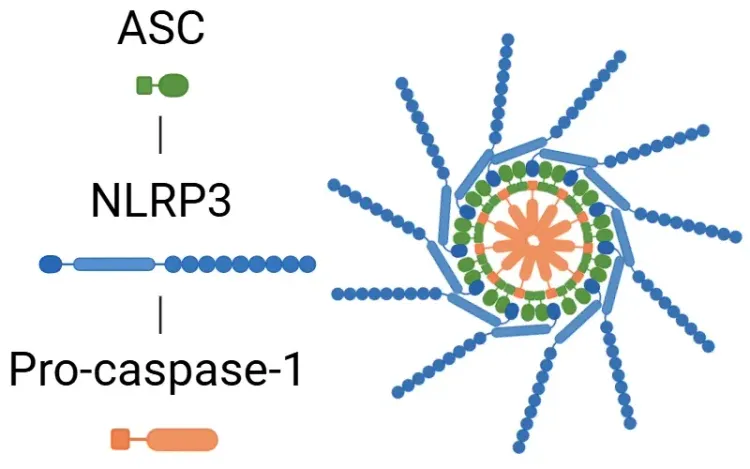
- 经典型炎性体通路
- 激活:该通路由病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)触发,导致炎症小体组分(包括NLRP1、NLRP3、NLRC4和AIM2)激活。
- 激活后,炎性体激活caspase-1。
- Caspase-1 随后裂解 GSDMD,启动焦死过程,并将前体 IL-1β 和前体 IL-18 裂解为活性形式(Bertheloot, 2021;Tan, 2021;Song, 2022)。
- 非经典通路
- 激活机制:该通路主要由细菌胞质脂多糖(LPS)启动,其激活特定大分子信号复合体(人类为caspase 4/5,小鼠为caspase 11)。
- 半胱氨酸蛋白酶4/5/11裂解GSDMD,由此引发独立于半胱氨酸蛋白酶-1的焦死过程。
- 细胞膜孔由GSDMD和P2X7形成。
- 钾离子的外流进一步促进了NLRP3炎症体(Fang, 2020;Yu, 2021;Song, 2022)的组装。
- 半胱天冬酶3/8通路
- 该通路涉及传统上与凋亡相关的半胱氨酸蛋白酶,特别是半胱氨酸蛋白酶-3和半胱氨酸蛋白酶-8。
- 半胱氨酸蛋白酶3:其活化可由化疗和免疫疗法(如CAR-T细胞)引发,最终裂解GSDME。
- 半胱氨酸蛋白酶8:其激活响应特定感染(如耶尔森菌或曲霉菌感染),导致GSDMD裂解。另存在一条替代通路:癌细胞缺氧条件下TNF-α激活该通路,可能激活GSDMC(Yu, 2021;Chai, 2023)。
- 该通路涉及传统上与凋亡相关的半胱氨酸蛋白酶,特别是半胱氨酸蛋白酶-3和半胱氨酸蛋白酶-8。
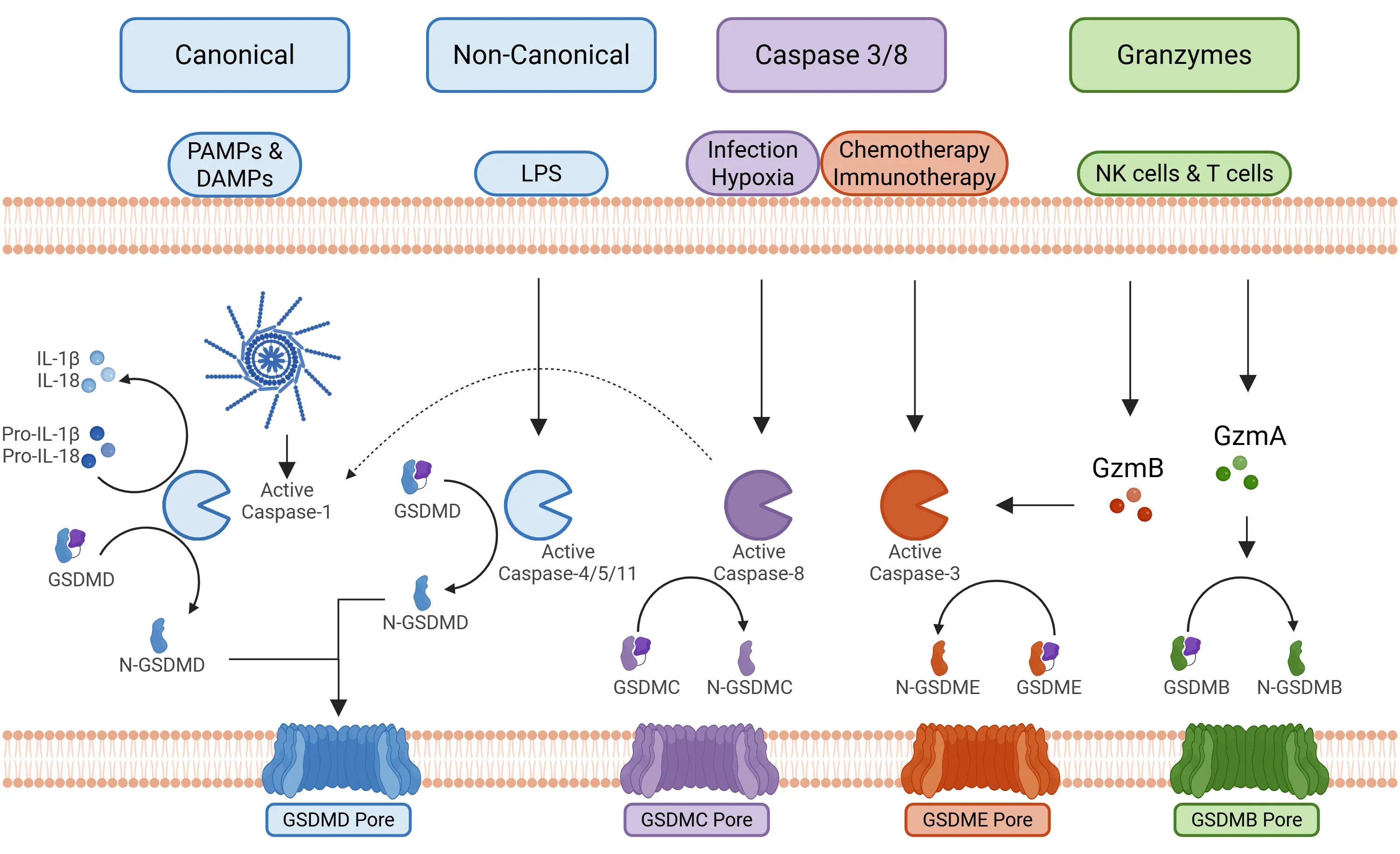
促进焦死的主要信号通路。
焦死是否与疾病相关?
焦死通过引发细胞破裂并释放促炎分子,促进神经炎症和神经元损伤,从而在中枢神经系统(CNS)内形成有害环境。该过程影响脑内多种细胞类型,每种细胞以独特方式参与疾病病理形成:
- 小胶质细胞作为中枢神经系统的核心免疫细胞,在神经炎症中扮演关键角色。当其发生焦死时,会进入促炎状态并释放炎症介质,既会损伤神经元,又会削弱其清除有害物质(如促进疾病进展的错误折叠蛋白)的能力(Wu, 2022;Oladapo, 2024)。
- 星形胶质细胞凋亡会导致细胞肿胀、形成膜孔并释放神经毒素。该过程破坏星形胶质细胞的支撑功能,引发线粒体功能障碍和内质网应激,进而加剧神经炎症环境(Oladapo, 2024)。
- 神经元同样可能发生焦亡,直接导致神经退行性疾病、中风及感染中观察到的神经元丧失(Wu, 2022)。
神经系统疾病
凋亡在神经系统疾病中的具体作用:
- 阿尔茨海默病(AD):
- 在AD中,β淀粉样蛋白聚集物和神经原纤维缠结会触发小胶质细胞激活NLRP3炎症小体,通过GSDMD启动焦死过程。该过程释放的炎症细胞因子会促进神经炎症,同时削弱小胶质细胞清除β淀粉样蛋白斑块的能力,从而形成恶性循环(Wu, 2022;Y. Liu, 2024;Oladapo, 2024)。
- 有关阿尔茨海默病中神经炎症的更多信息,请参阅我们的资源:《神经退行性疾病中的小胶质细胞、星形胶质细胞与tau蛋白》。
- 帕金森病(PD):
- 错误折叠的α-突触核蛋白可在小胶质细胞和神经元中激活NLRP3炎症小体。该激活导致GSDMD裂解,在细胞膜形成孔道,引发焦死。由此释放的促炎细胞因子持续加剧神经炎症,并导致多巴胺能神经元进行性丧失(Wu, 2022;Liang, 2024;Oladapo, 2024)。
- 有关帕金森病中神经炎症的更多信息,请参阅我们的资源:《帕金森病中的小胶质细胞、星形胶质细胞与α-突触核蛋白》。
- 多发性硬化症(MS):
- 证据表明,在多发性硬化病变中,小胶质细胞和少突胶质细胞均会发生焦亡,该过程由半胱天冬酶-1和GSDMD介导,从而促进炎症反应和脱髓鞘(Y. Liu, 2024)。
- 缺血性脑卒中:
- 中枢神经系统中的焦死是卒中后继发性损伤的主要驱动因素。甲基转移酶样蛋白14(METTL14)通过激活NLRP3炎症小体促进焦死发生。由此引发的神经炎症会加剧初始损伤,并与恢复延迟相关(Wu, 2022;Y. Liu, 2024)。
癌症
焦死在癌症中扮演复杂的双重角色,既可促进肿瘤发展,亦可抑制肿瘤生长,其作用取决于具体癌种及分子环境。例如:
- 在黑色素瘤中,NLRP1和NLRP3炎症小体可通过激活髓系来源抑制细胞(MDSC)促进肿瘤生长并形成免疫抑制环境。相反,化疗诱导的GSDME依赖性焦死能抑制肿瘤生长与转移(Huang, 2022;Z. Liu, 2024)。
- 在乳腺癌中,GSDMB和GSDMC的过表达与肿瘤生长、转移及不良预后相关。然而,GSDMD调控的焦亡减少则与疾病进展相关(Huang, 2022;Z. Liu, 2024)。
- 在结直肠癌中,AIM2和caspase-1缺陷与预后不良相关,表明其具有抑癌作用。然而NLRP3激活可能促进转移,且高GSDMD水平与预后不良相关(Huang, 2022;Z. Liu, 2024)。
炎症性疾病
由于焦亡在驱动细胞因子过度释放和炎症反应中的作用,其参与多种炎症性疾病,包括:
- 自身炎症性疾病(Vande Walle, 2016;Song, 2022;Chai, 2023):
- 冷蛋白相关周期性综合征(CAPS)
- 家族性地中海热(FMF)
- 皮炎相关性嗜中性粒细胞性皮肤病(PAAND)
- 伴婴儿肠炎的自身炎症(AIFEC)
- 无菌性炎症性疾病(Wu, 2022;Y. Liu, 2024):
- 心血管疾病:动脉粥样硬化、心肌梗死
- 肝脏疾病:非酒精性脂肪肝、非酒精性脂肪性肝炎(NASH)及肝纤维化
- 肺部疾病:哮喘与矽肺病
是否存在针对焦死作用的潜在治疗应用?
靶向焦亡为多种疾病提供了有前景的治疗策略,包括癌症、炎症性疾病和神经系统疾病。治疗方法取决于疾病背景:诱导焦亡对治疗癌症有益,而抑制焦亡则是治疗炎症和自身免疫性疾病的目标。
Gasdermin相关疗法:
- 抑制类:
- 此类药物通过阻断GSDMD-N端寡聚化及孔道形成来减轻病理性炎症(Y. Liu, 2024;Oladapo, 2024;Zhu, 2024):
- 富马酸二甲酯:获批用于多发性硬化症治疗。在多种动物模型中可减轻实验性自身免疫性脑脊髓炎(EAE)及家族性地中海热(FMF)的严重程度。
- C202-2729:该化合物在动物模型中可抑制EAE及内毒素性休克的炎症反应。
- 双硫仑与坏死磺酰胺:这些药物已在多种动物模型中用于治疗阿尔茨海默病、脓毒症、COVID-19及动脉粥样硬化等各类炎症性疾病。
- 此类药物通过阻断GSDMD-N端寡聚化及孔道形成来减轻病理性炎症(Y. Liu, 2024;Oladapo, 2024;Zhu, 2024):
-
- 半胱天冬酶-1抑制剂可阻止GSDMD裂解及后续的焦死过程(Wu, 2022;Oladapo, 2024):
- VX-765在EAE动物模型中被证实可减轻神经炎症。
- Ac-YVAD-CMK亦应用于临床前研究。
- 半胱天冬酶-1抑制剂可阻止GSDMD裂解及后续的焦死过程(Wu, 2022;Oladapo, 2024):
-
- LDC7559治疗已被证实能减少神经元凋亡和神经炎症,最终改善蛛网膜下腔出血研究模型中的行为和功能恢复(Cai, 2023)。
- 激活机制:促进抗肿瘤免疫(具体实例见下表):
- GSDME激动剂:顺铂、阿霉素、紫杉醇等化疗药物可激活caspase-3,裂解GSDME并诱导多种癌细胞(包括乳腺癌和肺癌)发生焦亡(Fu, 2020;Liao, 2022;Magnani, 2022;Privitera, 2023;Y. Liu, 2024)。
-
- GSDMD激动剂:索拉非尼和顺铂等药物可激活caspase-1并裂解GSDMD,从而在特定癌症(包括肝细胞癌和三阴性乳腺癌)中诱导焦亡(Liao, 2022;Y. Liu, 2024)。
-
- GSDMA3与纳米颗粒结合后,在细胞毒性T细胞和辅助T细胞存在下可产生抗肿瘤效应(Yu, 2021)。
炎性体抑制剂:NLRP3炎性体作为凋亡的上游激活因子,已成为药物研发的另一重点方向:
- 例如MCC950衍生物正应用于动物模型中的神经退行性疾病治疗(Wu, 2022;Y. Liu, 2024)。有关炎症小体治疗靶点的更多信息,请参阅我们的资源:NLRP3炎症小体与神经退行性疾病&炎症小体是什么?
尽管这些疗法对包括神经退行性疾病在内的多种炎症性疾病具有潜力,但与gasdermin相关的治疗仍存在挑战。如前所述,gasdermin的功能具有情境依赖性:它们可能在巨噬细胞中促进炎症反应,同时在肠黏膜细胞中维持稳态。因此,相关疗法存在通过超凋亡对健康细胞造成毒性的风险,因缺乏特异性可能引发全身性后果。
| 靶点 | 药物或化合物 | 癌症类型 |
| GSDME/Caspase-3 | 紫杉醇和顺铂 |
肺癌 |
| Loboplatin |
宫颈癌 | |
| 多柔比星 |
乳癌 | |
| 二氢青蒿素(DHA) |
乳癌 | |
| Polo-like kinase 1 (PLK1) 抑制剂 |
食管鳞状细胞癌 | |
| 四砷六氧化物 |
三阴性乳腺癌 | |
GSDMD/Caspase-1 | 索拉非尼 |
肝细胞癌 |
| Cisplatin |
三阴性乳腺癌 | |
| FL118 |
结直肠癌 | |
| 高山松黄酮(AIF) |
肝细胞癌 | |
| 二甲双胍 |
肝细胞癌 | |
| 维生素B12-丝素-PBLG-IR780纳米粒子 |
胃癌 | |
| 含钙螯合剂的纳米粒子 |
乳腺癌、黑色素瘤、卵巢癌 |
我们的团队很乐意解答关于凋亡的任何疑问,或提供有关我们用于治疗有效性研究的神经退行性疾病模型的具体信息。
相关内容
关于神经炎症的最新信息,以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
什么是IL-1β?
白细胞介素-1β(IL-1β)的概述、其在全身性及神经系统疾病中的促炎作用,以及基于IL-1β拮抗作用的治疗策略。
白细胞介素-1β(IL-1β)与神经退行性疾病
白细胞介素-1β(IL-1β)在神经退行性疾病中的作用,包括阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
什么是炎症小体?
概述炎性體,包括其作用機制、在疾病中的角色,以及藥物開發的目標。
什么是NLRP3?
NLRP3及NLRP3炎症小体激活的触发机制、疾病关联及治疗靶点策略综述。
NLRP3炎症小体与神经退行性疾病
NLRP3炎症小体及其在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症)中作用的概述。