什么是IL-1β?
白细胞介素-1β(IL-1β)是一种单链蛋白,被视为一种促炎性细胞因子。它属于白细胞介素-1超家族,该家族包含多种细胞因子,分子量约为17-18 kDa,包括IL-1α、IL-1Ra、IL-18、IL-33和IL-38。IL-1β的主要来源是单核细胞、巨噬细胞和中性粒细胞。在大脑中,它由小胶质细胞和星形胶质细胞分泌。尽管IL-1β在全身广泛表达,但在骨髓、泌尿系统、大脑、消化道、结缔组织和软组织、肝脏及胆囊中浓度特别高(Kaneko, 2019;Boraschi, 2022)。
IL-1β在体内发挥多种作用,参与维持免疫稳态,并在睡眠、疼痛和神经可塑性等重要生理过程中发挥作用(Ren & Torres, 2009)。其主要功能在于病理条件下促进炎症反应。IL-1β参与先天性和适应性免疫,可通过增加下丘脑中环氧化酶-2(COX-2)和前列腺素E2(PGE2)的水平来诱发发热(Boraschi, 2022)。
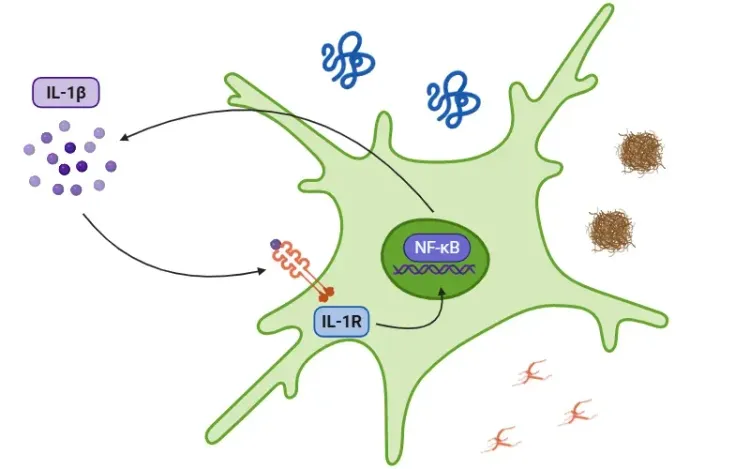
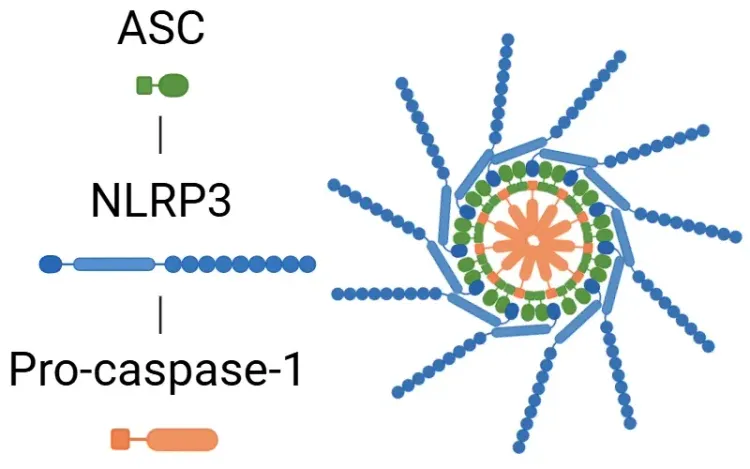
信号传导级联反应由损伤相关分子模式(DAMPs)和病原相关分子模式(PAMPs)触发,这些模式被 Toll 样受体(TLRs)识别。IL-1β的分泌可通过依赖或独立于炎症小体的途径实现。在炎症小体通路中,PAMPs或DAMPs激活NF-κB转录因子,导致前体IL-1β、前体IL-18和NLRP3释放。NLRP3随后招募ASC和前体caspase-1形成炎症小体,激活caspase-1。该酶将IL-1β和IL-18裂解为活性形式,从而促进炎症反应(Lopez-Castejon & Brough, 2011;Martin-Sanchez, 2016;Swanson, 2019)。有关NLRP3炎症小体的更多细节,请参阅我们的资源“什么是NLRP3?”。另一方面,中性粒细胞中的髓细胞素可将前体IL-1β裂解为IL-1β。无论通过何种途径,IL-1β的分泌均会触发一系列激酶级联反应,包括TAK1和MAPK,进而激活促炎性转录因子,如NF-κB和AP-1。这一过程最终导致促炎信号的释放增加,包括额外的IL-1β、IL-18和NLRP3(Weber, 2010; Kaneko, 2019;Ford, 2025)。
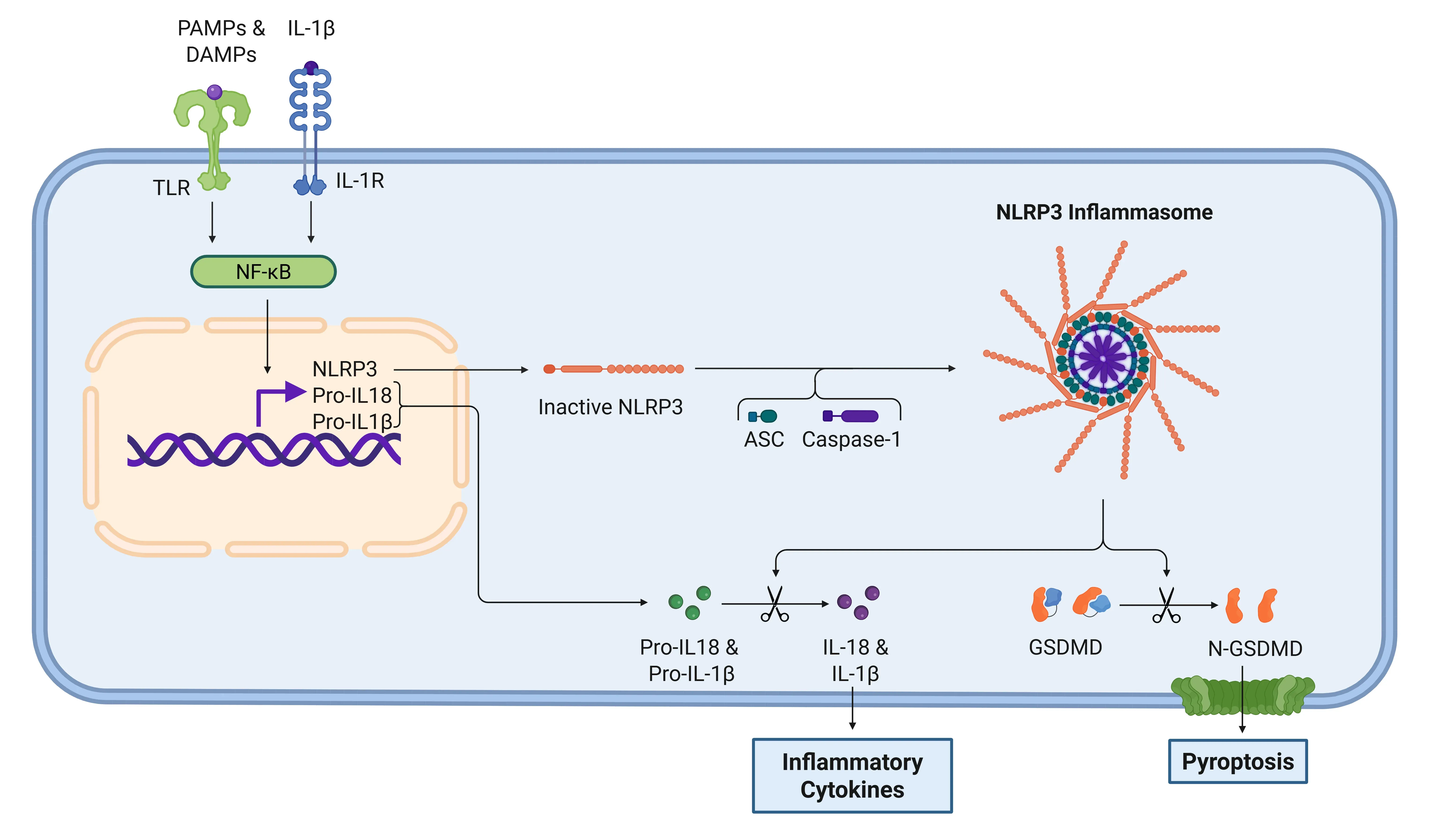
IL-1β信号传导通路通过NLRP3炎症小体。
当PAMPs和DAMPs通过TLRs被识别时,炎症小体被激活。一旦激活,转录因子NF-κB触发NLRP3的表达以及炎症细胞因子的非活性形式。炎症小体随后加工气道素D(GSDMD),导致凋亡,并激活细胞因子使其转化为功能性形式,即IL-1β和IL-18。随后,IL-1受体识别IL-1β,进一步推动炎症反应。
由于IL-1β的分泌,整体炎症反应增强。多个靶基因被转录,包括IL-1α、IL-17、COX2、PGE2、RANKL、MKP1以及更多IL-1β等。此外,炎症级联反应导致毛细血管通透性增加,使免疫细胞外渗进入受累组织,进一步促进炎症反应。IL-1β和IL-8的产生不仅能警示其他免疫细胞,同时还能调节中性粒细胞、肥大细胞、Th17细胞和破骨细胞的活性(Sakurai, 2012;Ford, 2025)。
IL-1β在系统性及神经退行性疾病中的作用是什么?
虽然IL-1β在促进急性炎症中发挥关键作用,但其水平升高可能导致过度炎症反应,从而参与多种疾病的发生。痛风和幼年特发性关节炎等疾病由IL-1β介导,且其水平在骨关节炎中也呈现升高趋势(Dinarello, 2019)。此外,IL-1β可刺激免疫抑制性髓源性抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs)的发育,这些细胞不仅促进肿瘤炎症,还助长免疫逃逸(Bent, 2018;Kaneko, 2019)。这些TAMs在多种人类癌症中均有发现,包括胰腺癌和结肠癌,且与患者预后不良相关(Caronni, 2025)。
IL-1β还通过持续免疫反应参与神经退行性疾病。它参与NLRP3炎症小体通路,对神经炎症有显著贡献(Mendiola & Cardona, 2018)。如需更多信息,可参考资源“NLRP3炎症小体与神经退行性疾病”。值得注意的是,部分研究提示IL-1β可能通过与IL-1R1+IL-1R3b受体相互作用发挥神经保护作用,并通过作用于IL-1R9受体参与记忆与学习过程(Boraschi, 2023)。
阿尔茨海默病(AD):
白细胞介素-1(IL-1)超家族细胞因子在AD的炎症过程中发挥重要作用,尤其是IL-1β和IL-18。脑脊液(CSF)中IL-1β水平升高,这可能与NLRP3炎症小体被激活有关,而该小体由淀粉样β(Aβ)触发(Mendiola & Cardona, 2018;Xu, 2025)。IL-1β的释放会引发一个有害循环,不仅增强淀粉样β的生成,还促进神经原纤维缠结的形成并进一步激活炎症小体。相反,IL-1超家族中的另一种细胞因子IL-1Ra则发挥关键的保护作用。研究表明,小鼠模型中缺乏IL-1Ra会加重疾病病理(Boraschi, 2023)。
帕金森病(PD):
PD的特征是α-突触核蛋白的错误折叠和多巴胺能神经元的退化,这些变化触发了NLRP3炎症小体的激活(Dzamko,2023;Xu, 2025)。NLRP3炎症小体通过产生关键炎症介质IL-1β在PD的发病机制中发挥重要作用(Boraschi, 2023)。PD患者脑脊液中细胞因子水平升高,如IL-1β、TNFα和IL-6,这些细胞因子参与了与疾病相关的脑炎过程。黑质中IL-1β的过度表达会导致多巴胺能神经元进一步丧失和神经炎症加重,而海马区过度表达则导致认知功能障碍(Dzamko,2023)。然而,IL-1β在PD中的确切作用尚不完全清楚(Boraschi,2023)。
有关帕金森病中α-突触核蛋白的更多信息,请参阅《小胶质细胞、星形胶质细胞与帕金森病中的α-突触核蛋白》及《AAV α-突触核蛋白模型在帕金森病药物开发中的应用》。
多发性硬化症(MS):
多发性硬化症患者体内caspase-1、IL-1β和IL-18的水平升高。NLRP3炎症小体通过促进CD4+ T细胞的迁移,在多发性硬化症的发病机制中发挥重要作用。在原发性进展型多发性硬化症中,单核细胞过度产生NLRP3炎症小体,进而促进IL-1β的产生(Mendiola & Cardona, 2018;Xu, 2025)。在实验性自身免疫性脑脊髓炎(EAE)中,IL-1β由IL-17A招募的髓系细胞通过不涉及炎症小体的通路分泌(McGinley, 2020)。 这种IL-1β不仅增加血脑屏障的通透性,还通过影响星形胶质细胞和内皮细胞促进白细胞的募集(Boraschi,2023)。
有关用于研究多发性硬化症的动物模型概述,请参见多发性硬化症模型。
肌萎缩侧索硬化症(ALS):
ALS的特征是存在TDP-43,这是ALS和额颞叶痴呆的关键病理标志物。 TDP-43包涵体已知可在原代小胶质细胞培养中激活NLRP3炎症小体,导致IL-1β的产生增加(Bright, 2021)。 有关ALS和TDP-43作用的更多信息,请参阅ALS小鼠模型与脊髓运动神经元及ALS小鼠模型在药物开发中的应用。
IL-1β还参与与突变型超氧化物歧化酶(SOD1)相关的炎症反应,SOD1是与ALS相关的两种最常见突变之一。SOD1也可激活炎症小体,引发神经炎症。值得注意的是,IL-1β可作为ALS的生物标志物,且已被发现与患者生存率呈负相关,尤其是在携带特定基因变异C9orf72HRE的患者中(Dutta, 2020;Boraschi, 2023)。
有關 IL-1β 在神經退行性疾病中的作用的全面回顧,請參閱: 白介素-1β(IL-1β)與神經退行性疾病
IL-1β能否作为治疗靶点?
IL-1β被认为是多种疾病中具有潜力的治疗靶点,这主要归因于其在炎症过程中的重要作用。IL-1受体拮抗剂(IL-1Ra)在减轻自身免疫性疾病的病情严重程度和改善预后方面显示出令人鼓舞的结果,并有望在神经退行性疾病中发挥作用。
其中一种值得关注的IL-1Ra是阿那白滞素(Anakinra),它是人体内源性的IL-1Ra。该治疗药物可抑制IL-1α和IL-1β的活性,并已获批用于治疗自身炎症性疾病,如类风湿性关节炎、新生儿起病多系统炎症疾病(NOMID)及白细胞介素-1受体拮抗剂缺乏症(DIRA)(Ford, 2025)。阿那白滞素是研究最为广泛的IL-1Ra药物,可能在神经退行性疾病中具有潜在益处,但该领域研究仍处于初期阶段。
在阿尔茨海默病(AD)动物模型中,阿那白滞素通过降低IL-1β水平并减少淀粉样β和tau蛋白沉积,改善了认知功能障碍(Xu, 2025)。相反,在ALS小鼠模型中阻断IL-1Ra虽能延长生存期,但未影响疾病发病时间。尽管已开展人类安全性和耐受性研究,但仍需进一步临床试验评估该治疗的有效性(Maier, 2015)。
另一种IL-1Ra,Rilonacept,由人类IL-1R1和IL-1R3的细胞外部分与人类IgG1的Fc部分融合而成。这种设计可实现对IL-1α和IL-1β的长期抑制,Rilonacept已获批用于治疗冷蛋白原相关周期性综合征(CAPS)。
最后,Canakinumab是一种人源化单克隆IgG1抗体,特异性靶向IL-1β,不影响IL-1α或IL-1R1。它已获批用于治疗Still病、周期性发热综合征和痛风发作(Dinarello, 2019)。
这些疗法共同凸显了靶向IL-1β在管理炎症性疾病中的潜力,为治疗多种神经退行性疾病提供了新的治疗选择。
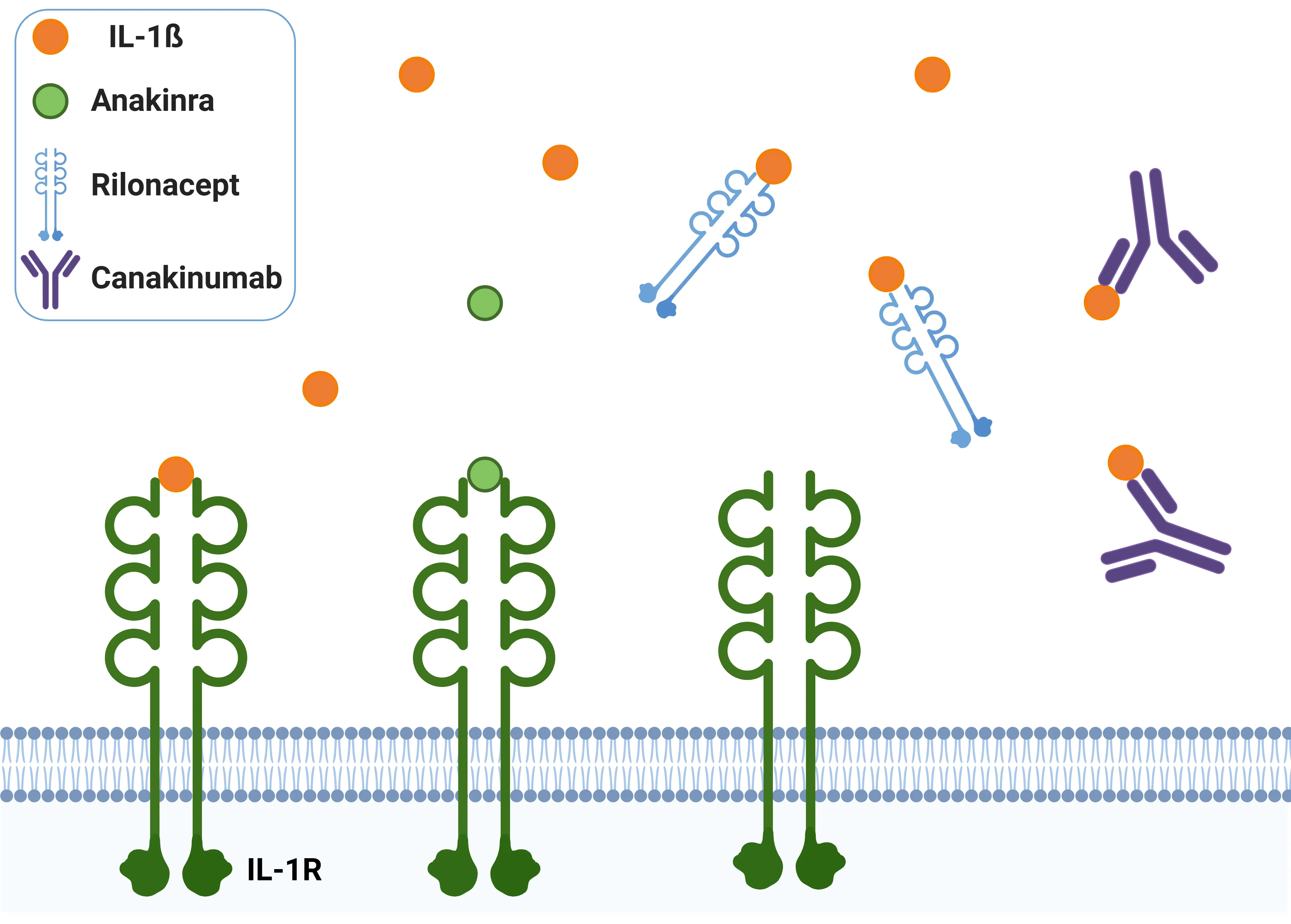
IL-1β拮抗剂。
阿那白滞素作为竞争性拮抗剂,与IL-1R结合,有效阻断IL-1β的生物学活性。里诺塞普由IL-1R的细胞外域组成,作为诱饵受体,阻止IL-1β与受体结合。卡那单抗是一种单克隆抗体,特异性靶向IL-1β,抑制其与IL-1R结合的能力,从而削弱其活性。
我们的团队很乐意回答您关于IL-1β的任何问题,或提供我们用于治疗有效性研究的神经退行性疾病模型相关具体信息。
相关内容
关于神经炎症的最新信息以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
白细胞介素-1β(IL-1β)与神经退行性疾病
白细胞介素-1β(IL-1β)在神经退行性疾病中的作用,包括阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
什么是炎症小体?
概述炎性體,包括其作用機制、在疾病中的角色,以及藥物開發的目標。
什么是NLRP3?
NLRP3及NLRP3炎症小体激活的触发机制、疾病关联及治疗靶点策略综述。
NLRP3炎症小体与神经退行性疾病
NLRP3炎症小体及其在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症)中作用的概述。
微胶质细胞和星形胶质细胞的溶酶体功能障碍
关于小胶质细胞和星形胶质细胞溶酶体功能障碍及其在神经退行性疾病中作用的概述。
线粒体功能障碍在小胶质细胞与星形胶质细胞中的作用
线粒体功能障碍在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩侧索硬化症)中对小胶质细胞和星形胶质细胞的作用。