TDP-43ΔNLS(rNLS8)ALS小鼠模型中的神经肌肉接点(NMJ)去神经支配
Biospective为神经肌肉接头染色与分析提供哪些服务?
神经肌肉接头(NMJ)在多种神经系统及肌肉疾病中受到影响,包括:
- 肌萎缩性 侧索硬化症 (ALS)(Verma, 2022)
- 重症肌无力(Vincent, 2002)
- 夏科-马里-图斯病 (Cipriani, 2018)
- 脊髓性 肌萎缩症(SMA)(Murray,2010) 以及
- 杜氏 肌 营养不良症(DMD) (Pratt, 2015)
对神经肌肉接头(NMJ)特征(如NMJ神经支配与NMJ神经脱失)进行定量分析,对于理解疾病进展及治疗干预反应至关重要,尤其 在ALS病理学及其他神经肌肉疾病模型的NMJ病理学研究中。Biospective团队已开发出针对 肌肉组织切片中NMJ的多重免疫荧光染色与定量图像分析的可靠方法 ,包括 针对ALS神经肌肉接头研究的 优化方案 。
Biospective公司神经肌肉接头(NMJ)染色与分析的流程是什么?
神经肌肉接头染色与分析流程
在Biospective,我们针对福尔马林固定肌肉中的神经肌肉接头(NMJ)染色与分析,实施了一套标准化、高度可重复的多步骤流程:
1. 组织切片
- 肌肉组织经OCT包埋后冷冻,储存于-80°C环境
- 采用专用微切片机生成高质量的固定冷冻组织切片
- 切片 固定于高性能载 玻片,确保 染色过程中的 附着稳定性
2. 组织切片神经肌肉接头多重免疫荧光染色
- 我们进行多重染色:
- 突触前末梢(SV2A)
- 运动终板(α-蝮蛇毒素)
- 支配轴突(β-III-微管蛋白)
- 染色采用 高通量自动化免疫组化/免疫荧光仪器 完成 ,确保结果一致性与可重复性
3. 切片扫描
- 采用数字化切片扫描仪以超高空间分辨率对整张切片进行数字化处理
- 所得图像 同时 用于 可视化分析与定量分析
4. 图像分割、神经肌肉接头定量分析及神经肌肉接头分析
- 我们的成像科学家开发了先进的全自动分割方法,用于分析突触前末梢(SV2A)、运动终板(α-蝮蛇毒素)及支配轴突(β-III-微管蛋白)
- 我们开发的神经肌肉接头分析工具可实现 高通量、低偏差 的神经肌肉接头 定量分析
- 我们从分割图像中提取多种定量指标 ,用于表征 神经肌肉接头的形态学 特征与 功能状态
样本采集、制备与运输指南
我们提供全面支持以确保样本完整性与数据可靠性:
- 样本采集:动物应使用冷磷酸缓冲液(PBS)和/或10%中性缓冲甲醛溶液进行灌注,并仔细取出肌肉组织。
- 样本制备:肌肉 组织须用10%中性缓冲甲醛溶液短暂固定后快速冷冻。
- 样本运输: 必须 使用隔热容器以干冰 运输 样本, 避免反复冻融循环。
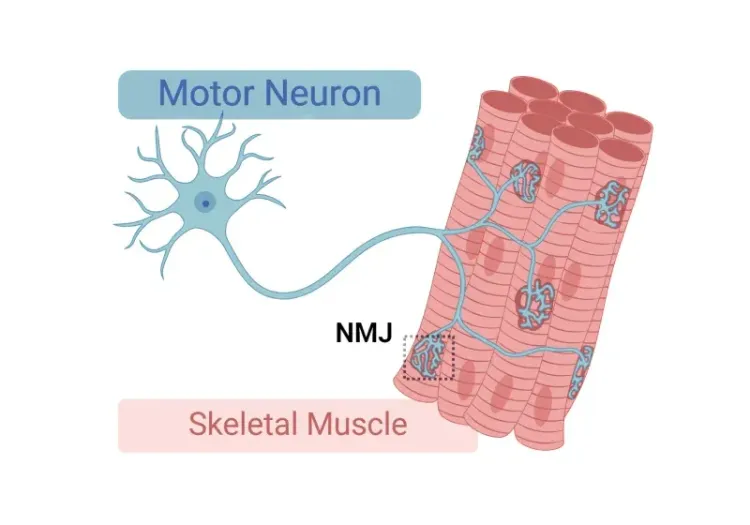
示意图展示 神经肌肉接头 (NMJ)的关键组成部分,包括 突触前 运动神经元末梢、突触后运动终板、末梢 施万细胞及 克拉诺细胞。缩写说明:神经肌肉接头(NMJ)、乙酰胆碱(ACh)、 乙酰胆碱受体(AChR)。
什么是神经肌肉接点(NMJ)?
神经肌肉接点(NMJ)是一种特殊突触,它使 运动神经元与骨骼肌纤维之间能够 进行信息传递,从而实现精确的肌肉收缩。 当 运动神经元末梢 接收到电信号时,会 释放 乙酰胆碱(ACh) , 该物质与 肌肉膜 运动终板 上的 受体结合 ,从而触发动作电位并 引发后续的 肌肉收缩。
为何要分析神经肌肉接点?
- 病理早期病灶:在多种神经退行性疾病中,NMJ受损早于运动神经元丧失(即"回溯性死亡"过程)。
- 定量读数:可在临床前模型中监测去神经支配、重塑及治疗反应。
- 实验可及性:位于体表的解剖位置便于开展高强度成像与分析,实现突触完整性的高分辨率评估。
本视频概述了我们的神经肌肉接头(NMJ)染色与分析技术,并通过ALS小鼠模型中NMJ去神经支配的实例,展示了如何运用我们的服务在临床前研究中测量神经退行性变、监测疾病进展并评估潜在疗法。
点击复制链接
神经肌肉接头分析在动物模型中的价值何在?
神经肌肉接点(NMJ)对多种神经肌肉疾病中的神经支配变化、形态改变及退化具有高度敏感性。在动物模型中进行NMJ分析,使研究人员能够监测疾病进展,并在临床前研究中评估实验性治疗药物的疗效。
依托经验证的成像平台、科学专长及丰富经验,我们能在多种模型和物种中提供可靠且可重复的神经肌肉接头定量分析。本文重点展示我们常用于测试新型治疗干预措施的ALS小鼠模型中神经肌肉接头的改变。
肌萎缩性侧索硬化症(ALS)模型与ALS 神经肌肉接头病理学
理想的ALS(或运动神经元疾病[MND])动物模型应具备以下关键特征:
- 症状与人类ALS/MND高度相似,包括运动功能缺损及神经肌肉接头易损性
- 疾病进程呈进行性发展,便于开展纵向病理学研究
- 具备疾病修饰性,可实施改变病程进展的干预措施
- 可获得适龄动物用于临床前研究
- 动物间变异性低,确保不同组别间结果可重复
TDP-43ΔNLS(rNLS8)模型
TDP-43ΔNLS (rNLS8) 模型小鼠 符合 上述标准, 使其成为ALS药物研发的理想系统。该模型表达具有缺陷性核定位信号(NLS)的人源TDP-43蛋白,该缺陷阻碍核输入过程,导致 TDP -43在神经元 胞质 中 持续积累 。 随着时间推移,这种 定位异常的 蛋白质会形成 磷酸化TDP-43聚集物,重现 了ALS患者体内观察到的关键病理特征 。
在Biospective公司,我们同时应用原始版与改良版的rNLS8 TDP-43蛋白病ALS小鼠模型:
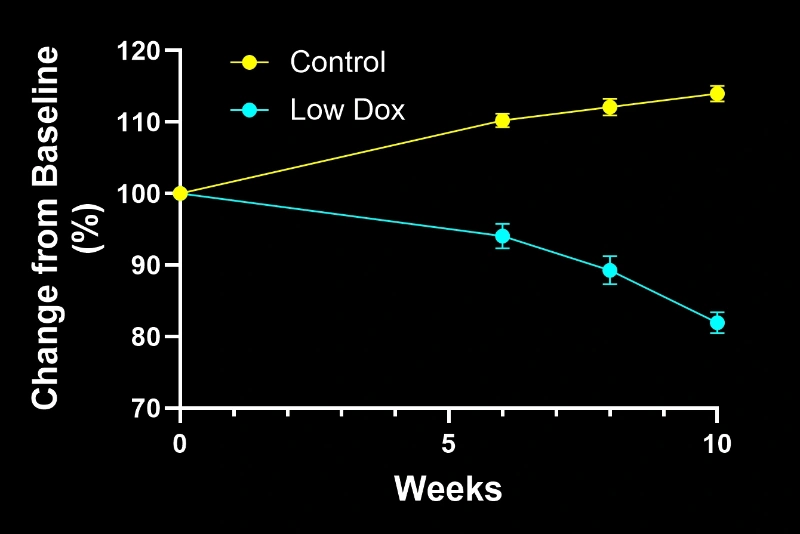
- 原始小鼠模型("Off Dox"):数周内快速疾病进展
- Biospective小鼠模型("低多西环素"):数月内缓慢渐进性疾病发展
两种模型均呈现渐进性病理变化,包括:
- 运动神经元变性及局部脑萎缩
- 胞质TDP-43积累及磷酸化TDP-43聚集物
- 运动功能缺损
- 脑、脊髓及神经肌肉接头(NMJ)病理改变
更多信息请参阅我们的资源:
在TDP-43ΔNLS(rNLS8)ALS小鼠模型中,神经肌肉接头(NMJ)如何受到影响?
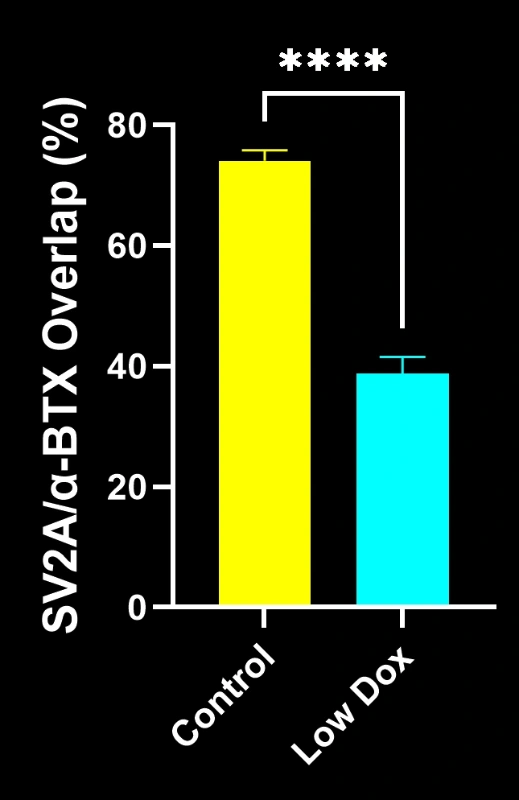
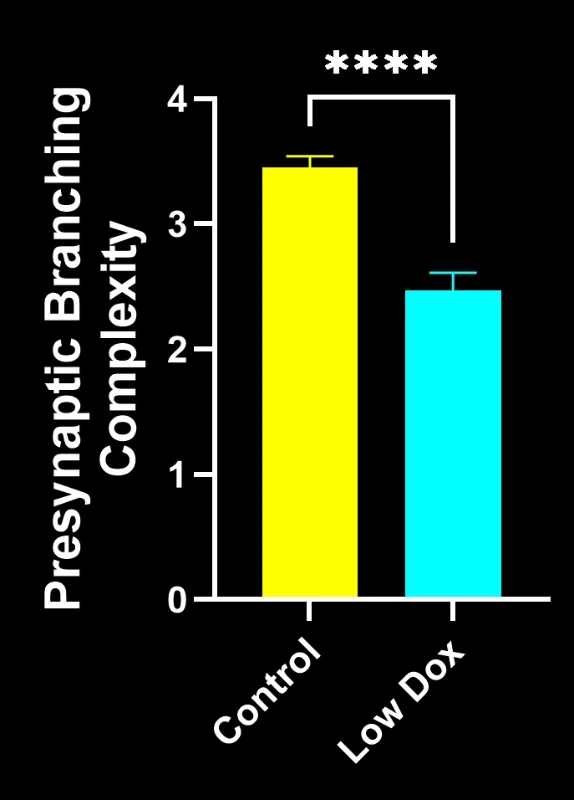
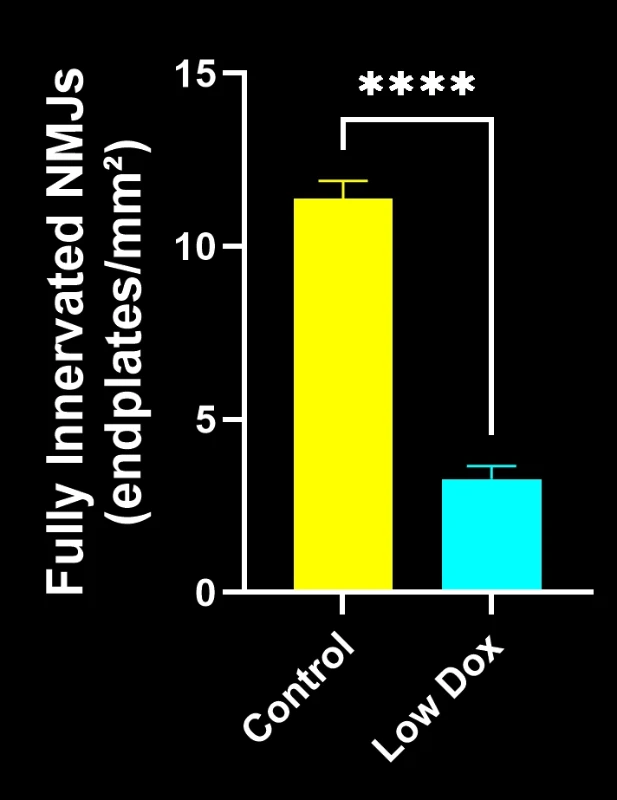
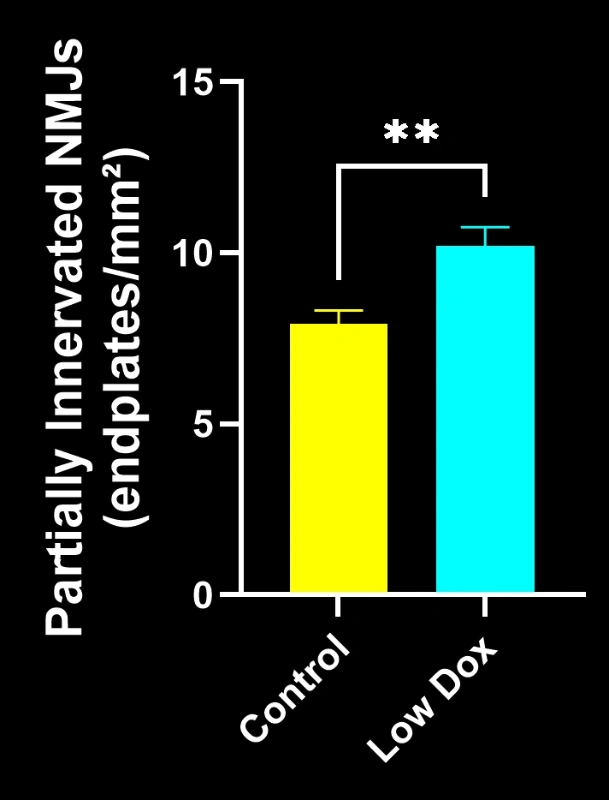
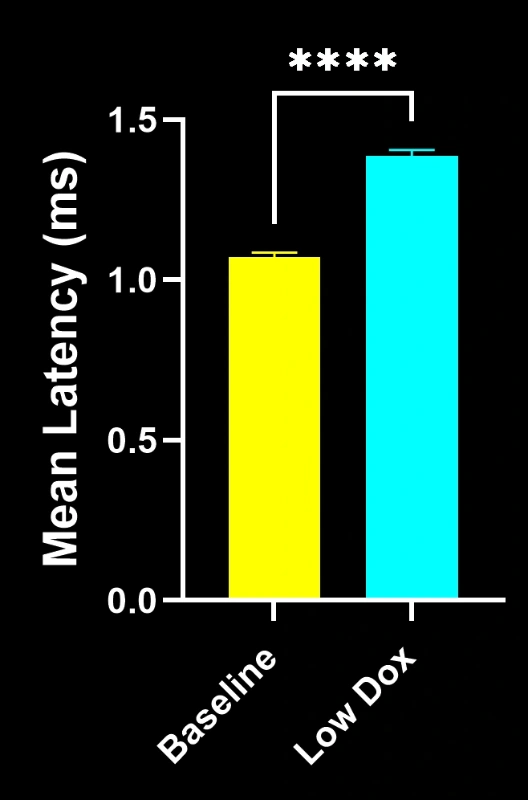
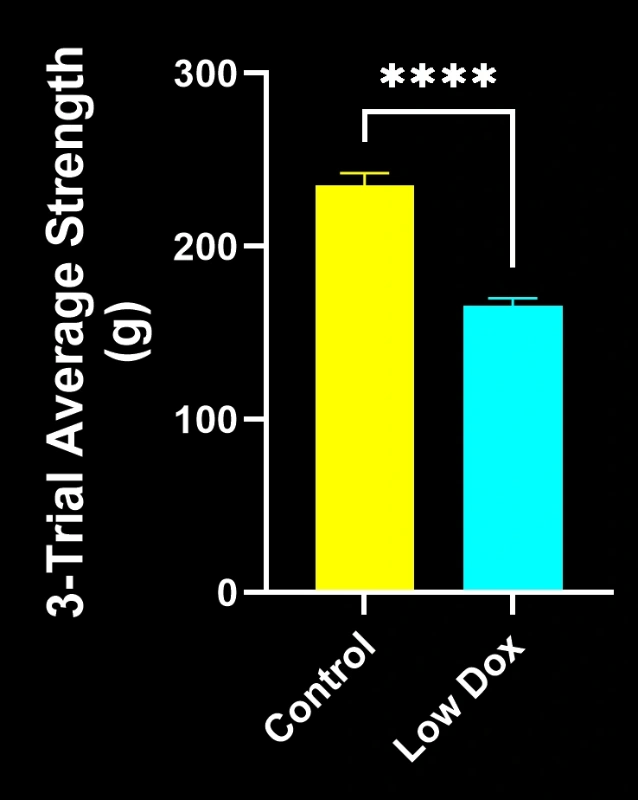
Biospective的研究科学家对TDP-43转基因小鼠模型中的神经肌肉接头完整性及去神经支配现象进行了严格评估。该研究在模型诱导后第8周,将tTA对照组小鼠与"低多柔比星"rNLS8小鼠进行了对比分析。
我们的研究表明:
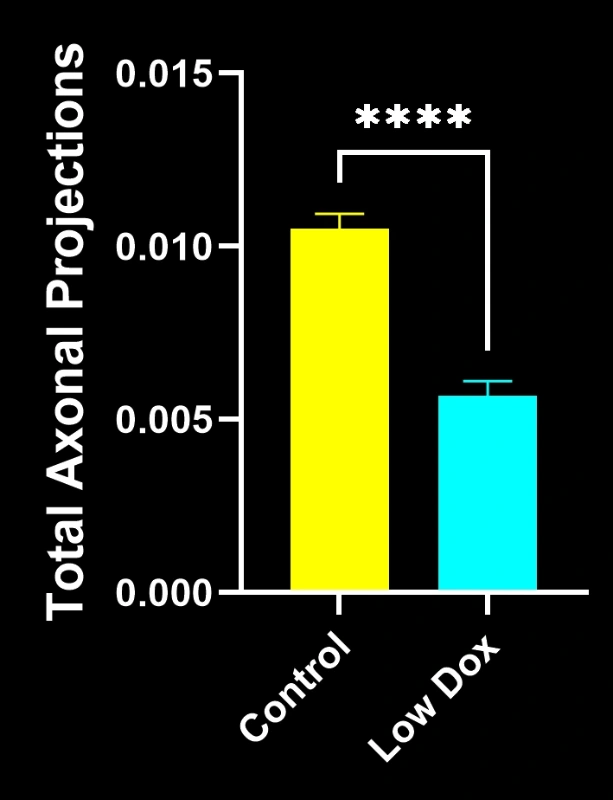
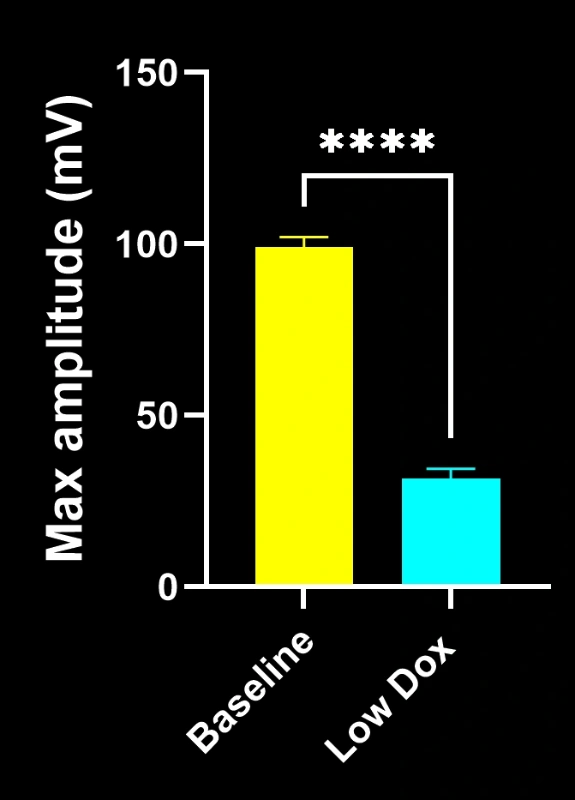
- SV2A/α-蝮蛇毒素共定位显著减少,表明神经肌肉接头去神经支配
- 轴突投射总量减少
- 突触前结构简化,反映出类似ALS的突触病理
这些发现突显了神经肌肉接头处突触功能的渐进性失调,并支持将该小鼠模型用于针对ALS中神经肌肉接头保护疗法的临床前评估。
在下方的"图像交互"中,您可查看我们对神经肌肉接头(NMJ)的分析结果,包括 Biospective公司"低多柔比星"TDP-43ΔNLS(rNLS8)小鼠模型与对照组小鼠肌肉组织的高分辨率多重免疫荧光切片。
使用鼠标左键可在图像中平移。通过 鼠标/触控板(上/下滚动)或左上角的+/-按钮可进行缩放。 右上角控制面板 支持切换通道显示(开启/关闭)、更改颜色及调整图像设置。
建议使用 全屏模式以获得 最佳交互体验。
图像交互界面展示神经肌肉接头分析结果,呈现Biospective公司"低多柔比星"TDP-43ΔNLS(rNLS8)小鼠模型的高分辨率多重免疫荧光肌肉切片,并与对照组织并列呈现。
Click to copy link
自动化如何提升研究成效?
我们采用 自动化神经肌肉接头染色与分析技术 ,结合先进 的高通量成像和定量平台。该方法确保 在多份样本和实验条件下,对神经肌肉接头结构与完整性进行精准 且可重复的评估 。
神经肌肉接头(NMJ)手动与自动化染色及分析对比
|
特征 |
手动 |
自动化 |
|
染色一致性 |
抗体孵育时间不稳定且试剂分布不均 |
精确控制时间、温度和试剂应用 |
|
通量与效率 |
耗时且分析的载玻片数量有限 |
高通量染色、成像与数据处理 |
|
可重复性 |
操作者依赖性导致的染色与分析变异性 |
标准化流程与算法驱动的NMJ定量分析 |
|
数据准确性与 |
主观性神经肌肉接头评估;定量精度有限 |
自动化分割定位与形态学分析 |
|
形态学特征分析 |
手动测量神经肌肉接头尺寸、形状及复杂度 |
自动提取神经肌肉接头面积、周长、分支及复杂度指标 |
|
空间映射 |
仅限于选定感兴趣区域(ROIs) |
神经肌肉接头分布与突触覆盖的全切片映射 |
本表从关键指标(包括染色一致性、吞吐量与效率、可重复性、数据准确性与分析深度、形态学特征分析及空间映射)对比了神经肌肉接头(NMJ)的手动与自动化染色及分析方法。
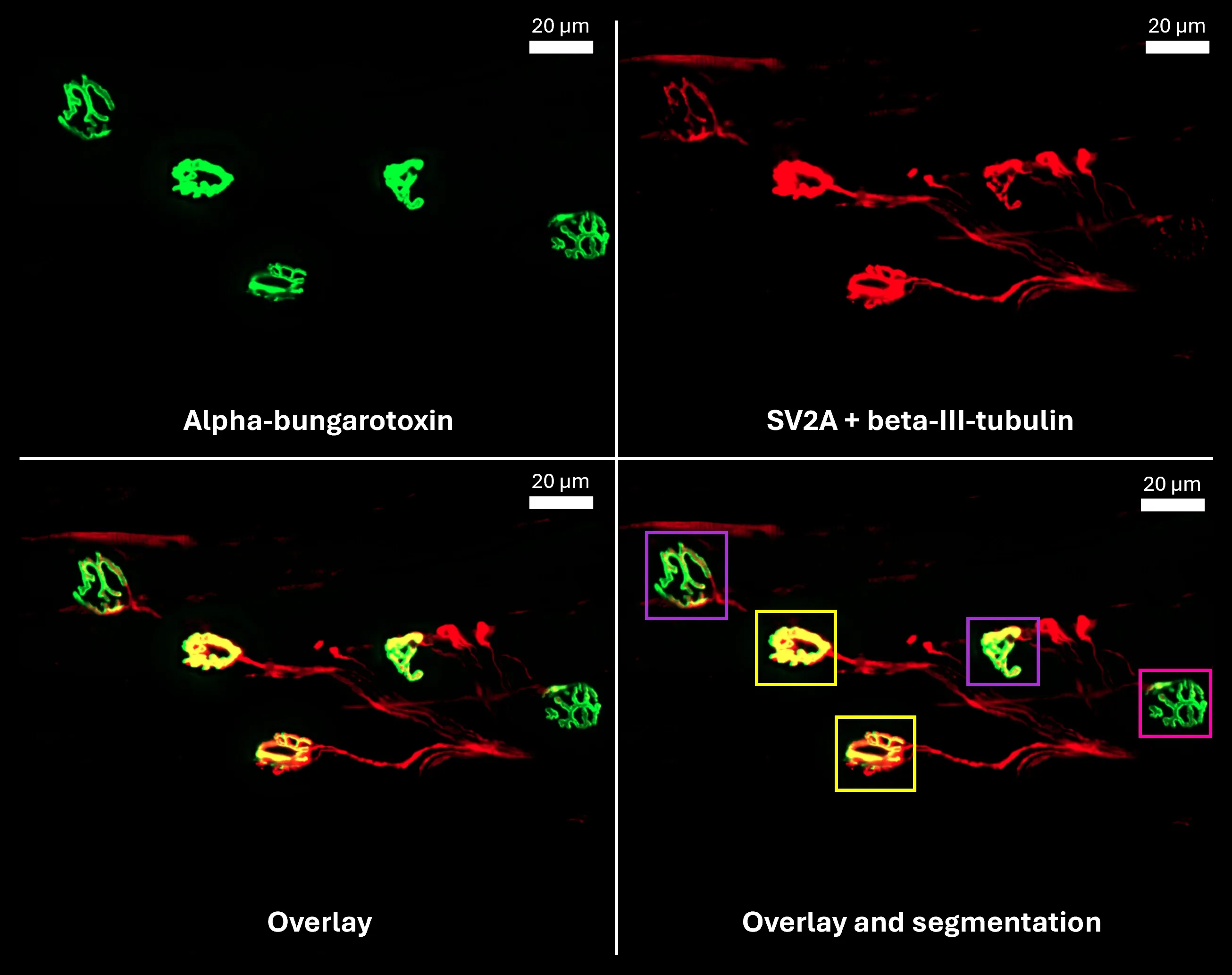
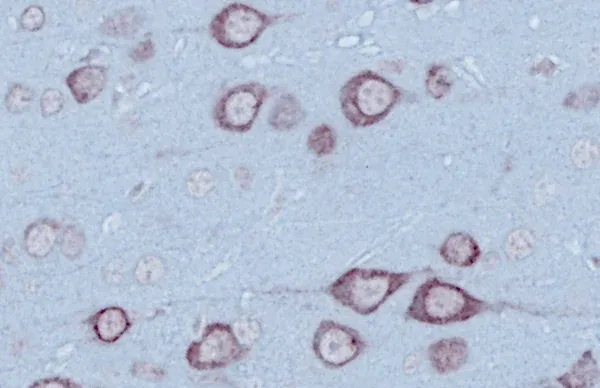
采用Biospective公司开发的自动化染色与图像分析流程处理后,小鼠肌肉神经肌肉接头(NMJ)的示例图像。
如需讨论您的研究需求或获取神经肌肉接头(NMJ)染色与定量服务的报价,请联系我们。
相关内容
关于神经肌肉接头染色与分析服务的最新信息。
神经肌肉接头(NMJ)形态学与ALS模型
对神经肌肉接头(NMJ)及其在肌萎缩侧索硬化症(ALS)中作用的深入理解,以及用于研究NMJ形态学变化的工具和方法。
ALS小鼠模型用于药物研发
指导如何最有效地使用肌萎缩侧索硬化症(ALS)的实验动物模型(小鼠和大鼠模型)进行临床前治疗测试。
ALS 小鼠模型和脊髓运动神经元
脊髓运动神经元在小鼠肌萎缩侧索硬化症(ALS)模型中疾病进展的概述。
TDP-43 ΔNLS (rNLS8) 小鼠用于ALS药物研发
该资源提供了有关使用ΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43 ALS转基因小鼠模型进行临床前治疗研究的信息。