肿瘤坏死因子-α信号传导如何影响神经退行性疾病中的星形胶质细胞功能?
星形胶质细胞通过TNFR1和TNFR2两种受体系统响应肿瘤坏死因子-α(TNF-α),这两种受体的相反活性维持着神经毒性与修复之间的平衡。在星形胶质细胞中激活TNFR1足以诱导体内突触功能障碍和记忆缺损,这在实验性自身免疫性脑脊髓炎(EAE)模型中得到验证——海马功能损伤与胶质细胞TNF信号传导直接相关(Habbas, 2015 )。在慢性不可预测轻度应激(CUMS)小鼠等前临床慢性应激模型中,TNFR1上调与以星形胶质细胞增生和神经元凋亡为特征的抑郁样症状相关,而通过药理或基因手段阻断TNFR1可逆转这些效应(Gao, 2024 )。相反,星形胶质细胞中的TNFR2信号传导在脱髓鞘条件下通过抑制促炎程序限制反应性星形胶质细胞增生并促进再髓鞘化,同时在生理状态下支持海马突触功能、可塑性和认知能力(Raphael, 2019 ;Carney, 2025 )。
这种受体功能差异创造了治疗机遇:
- 选择性中和主要激活TNFR1的可溶性TNF(sTNF),可在脱髓鞘模型(如 铜绿假单胞菌脱髓鞘模型)中增强髓鞘再生,同时保留跨膜TNF(tmTNF)-TNFR2通路的有益信号传导(Karamita, 2017 )。
- 选择性TNFR2激动剂正积极研发中,旨在利用这种差异性,同时避免非选择性TNF阻断带来的并发症(Pegoretti, 2023 )。
这些发现共同揭示了TNFR1和TNFR2作为星形胶质细胞分子开关的作用,在神经毒性与修复程序之间维持平衡,并强调受体选择性靶向是极具前景的治疗途径。
除受体特异性效应外,TNF-α还通过调控星形胶质细胞状态转换,在保护性与神经毒性程序间重塑胶质微环境。典型案例是IL-1α、TNF-α与C1q组成的细胞因子三重奏,其可将稳态星形胶质细胞驱动至以补体C3表达为标志的神经毒性A1状态。阻断该通路可阻止A1状态转化并延长ALS模型存活期,直接揭示星形胶质细胞TNF信号与疾病进展的关联(Liddelow, 2017 ;Guttenplan, 2020 )。然而该表型并非普遍有害:在朊蛋白病中,清除C3+星形胶质细胞反而加剧退化,凸显其具有疾病特异性和情境依赖性(Hartmann, 2019 )。 人诱导多能干细胞衍生的星形胶质细胞可复现该动态:TNF-α(单独或与IL-1β协同)触发NF-κB激活及C3上调,导致谷氨酸清除功能受损(Hyvärinen, 2019 )。近期多组学分析显示,人类阿尔茨海默病(AD)和肌萎缩侧索硬化症(ALS)脑组织中的A1样星形胶质细胞聚集于神经元丧失区域,强化了其致病潜力(Escartin, 2021 )。在帕金森病(PD)中,暴露于TNF-α与α-突触核蛋白纤维的星形胶质细胞呈现不同反应模式,但两者最终均导致线粒体功能障碍——这一共同终点加速疾病进展(Russ, 2021 )。综合这些发现表明,TNF-α是星形胶质细胞状态转化的关键驱动因子,推动其向神经毒性程序演变,并以依赖环境的方式影响疾病进程。
有关TNF-α在小胶质细胞中的功能及其对神经退行性疾病影响的综述,请参阅:TNF-α与神经退行性疾病中的小胶质细胞
除塑造星形胶质细胞表型外,TNF-α还直接改变对神经元和血管健康至关重要的关键星形胶质细胞功能:
- TNF-α通过TNFR1/NF-κB通路下调EAAT2/GLT-1,降低谷氨酸摄取,从而加剧运动神经元的兴奋性毒性损伤(Jiang, 2019 )。
- 在人诱导多能干细胞衍生的星形胶质细胞中,TNF-α及其他促炎细胞因子会削弱谷氨酸清除能力并增强免疫反应性特征 (Hyvärinen, 2019 )。
- TNF-α增强胶质细胞传递。在小脑回路中,伯格曼胶质细胞中TNFR1的激活通过mGluR1依赖性机制增加谷氨酸释放并改变神经元兴奋性 (Shim, 2018 )。
- 炎症条件下TNF-STAT3轴破坏血脑屏障(BBB)完整性,且炎症预处理的帕金森病星形胶质细胞无法支持微血管形态发生——该缺陷可通过MEK1/2抑制逆转(de Rus Jacquet, 2023 )。
这些发现表明TNF-α不仅驱动炎症状态改变,更破坏星形胶质细胞在谷氨酸稳态、神经元-胶质细胞通讯及血管稳定性中的关键作用,从而加速神经退行性病变进程。
这些多样化效应可归因于TNF受体下游的信号网络,该网络将炎症与代谢枢纽耦合至星形胶质细胞状态调控:
- NF-κB激活(RelA/p65)驱动炎症转录程序并导致线粒体功能障碍,其生物能量缺陷已在人源星形胶质细胞模型中得到验证(Russ, 2021 )。
- MAPK信号模块进一步与TNF通路交织:ERK/MAPK活性调控帕金森病星形胶质细胞的血脑屏障支持功能。
- 小胶质细胞TNF下游的JNK激活诱导星形胶质细胞产生CXCL1,从而重塑体内神经元-胶质细胞通讯(Zhang, 2022 ;de Rus Jacquet, 2023 )。
综上所述,TNFR1与TNFR2的二元性结合NF-κB和MAPK枢纽,使TNF-α成为星形胶质细胞状态转化的主调控因子,在神经退行性疾病中协调神经毒性或修复性程序(Raphael, 2019 )。
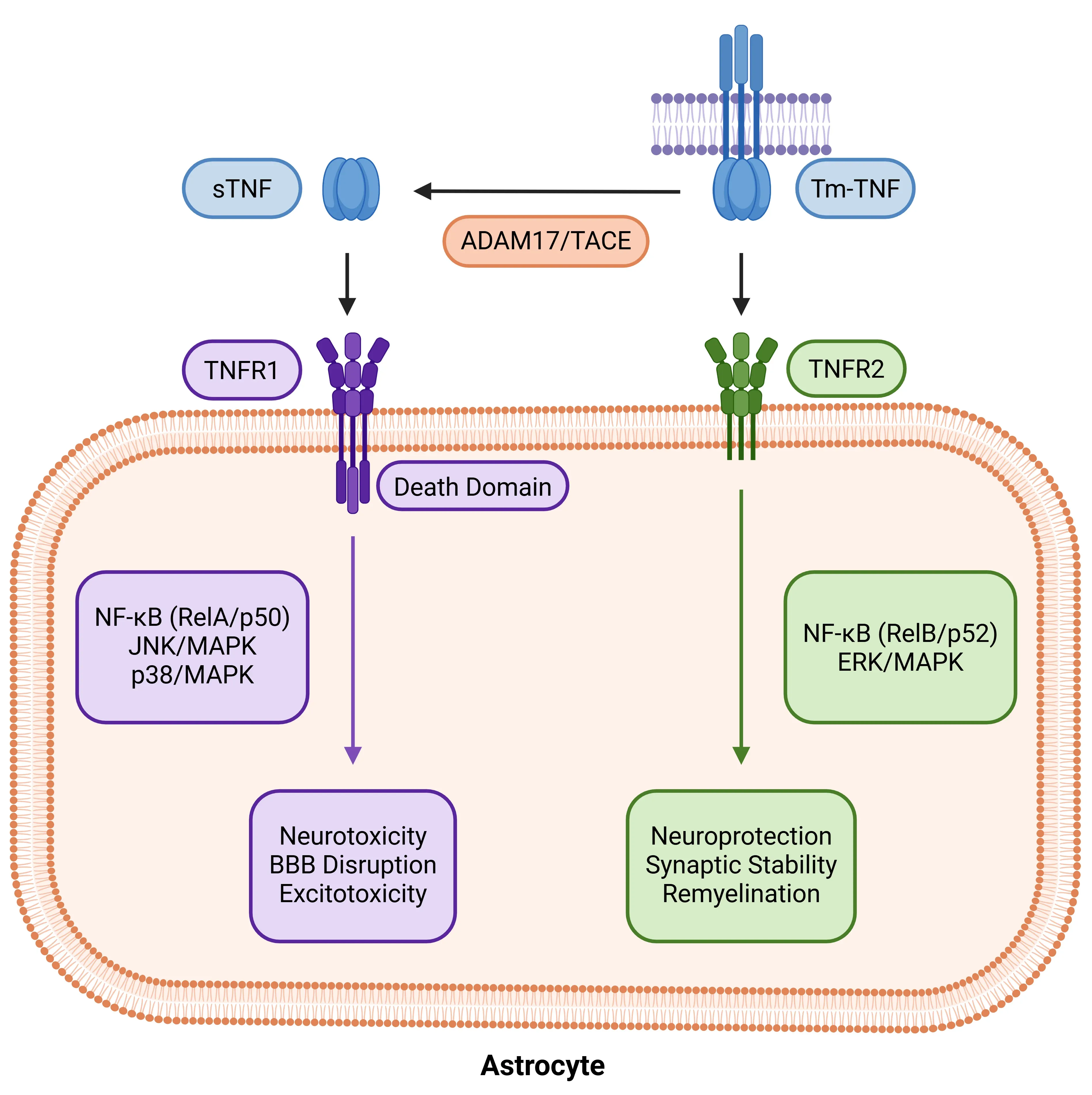
星形胶质细胞中TNF-α受体的双重性。星形胶质细胞 对TNF-α的反应取决于配体形态与受体特异性。由ADAM17/TACE从tmTNF裂解产生的sTNF激活TNFR1,触发NF-κB(RelA/p50)、JNK及p38 MAPK通路,进而诱导神经毒性及血脑屏障破坏。相反,tmTNF优先结合TNFR2,通过非经典NF-κB(RelB/p52)和ERK/MAPK通路传递信号,从而促进神经保护、突触稳定及髓鞘再生。这种双重性使TNF-α成为介于损伤与修复之间星形胶质细胞状态的关键调控因子。
反应性星形胶质细胞在TNF-α介导的神经炎症中发挥哪些作用?
在TNF-α作用下,反应性星形胶质细胞承担多种有害功能,其危害程度远超简单的胶质细胞激活。本文阐述了这些状态如何在不同疾病背景下促进神经炎症、血管功能障碍及直接神经元损伤。
胶质毒性与血管功能障碍
星形胶质细胞的反应性深受TNF-α调控,该因子在炎症脑内作为小胶质细胞-星形胶质细胞通信的关键放大器发挥作用。小胶质细胞来源的TNF-α与IL-1α及C1q共同作用,足以在体外和体内环境中将稳态星形胶质细胞转化为神经毒性A1状态,确立了TNF-α作为星形胶质细胞增生关键诱因的地位。中和这种IL-1α/TNF/C1q三重联合作用可阻止A1状态转化,并维持神经元与少突胶质细胞存活,证实TNF-α依赖性反应性是病理成因而非疾病副产物(Liddelow, 2017 )。在海马回路中,TNF-α激活星形胶质细胞的TNFR1受体,由此引发星形胶质细胞-神经元级联反应,重塑兴奋性突触并损害情境记忆(Habbas, 2015 )。
在血管界面,TNF驱动星形胶质细胞进入STAT3依赖性炎症反应状态,促使它们释放破坏血脑屏障完整性并诱导血管内皮炎症的因子(Kim, 2022 )。基于这些血管破坏证据,近期人脑芯片研究表明:TNF预处理的星形胶质细胞不仅破坏屏障功能,还损害微血管形态发生——该缺陷可通过MEK1/2抑制逆转(de Rus Jacquet, 2023 )。
综上所述,TNF-α反应性星形胶质细胞通过助长毒性胶质状态、破坏突触通讯、削弱血脑屏障与微血管完整性,成为功能障碍的关键驱动因素,从而放大神经炎症损伤。
神经炎症的炎症与氧化驱动机制
星形胶质细胞一旦进入TNF-α驱动的反应性状态,便成为炎症与氧化应激的活跃源,其破坏作用远超胶质细胞区域。核心机制在于NF-κB通路的激活,该通路诱导多种促炎介质的产生:
这些信号招募白细胞并放大中枢神经系统的局部免疫活性(Giovannoni, 2020 )。
与此同时,反应性星形胶质细胞产生活性氧/氮自由基(ROS/NOS),将TNF-α信号与氧化应激通路相联结,进一步破坏神经元和血管稳态(Ding, 2021 )。与小胶质细胞的双向交叉谈话加剧了这些反应:星形胶质细胞的NF-κB激活足以驱动小胶质细胞增殖和白细胞浸润,表明星形胶质细胞并非被动响应神经炎症,而是主动加剧神经炎症(Ouali Alami,2018 )。
人iPSC衍生的星形胶质细胞模型复现了这些特征:联合IL-1β和TNF-α刺激可诱导NF-κB核转位、形态重塑及免疫反应表型的获得(Hyvärinen, 2019 )。与这些实验模型一致,人类阿尔茨海默病和多发性硬化症组织中的单核RNA测序(snRNA-seq)表明,NF-κB驱动的星形胶质细胞状态聚集在斑块和病变周围,突显了其直接的临床相关性(Escartin,2021 )。
综合这些发现表明,TNF-α反应性星形胶质细胞作为强效的炎症和氧化应激引擎,积极放大神经炎症级联反应,加剧神经元和血管脆弱性。
神经毒性与回路功能障碍
TNF-α驱动的星形胶质细胞反应性不仅剥夺其正常支持功能,更使其成为神经元与少突胶质细胞损伤的活性源。功能层面,A1型星形胶质细胞丧失促突触形成支持作用,转而分泌杀伤神经元与少突胶质细胞的因子,直接将TNF-α诱导的反应状态与神经退行性病变关联起来 (Liddelow, 2017 )。其中一种机制涉及APOE/APOJ脂质体中饱和脂质的分泌;阻断脂质代谢酶ELOVL1可预防此毒性效应,由此揭示星形胶质细胞脂质代谢与TNF诱导神经元死亡的关联(Guttenplan, 2021 )。
在神经回路层面,持续暴露于TNF-α(单独或联合IL-6)会扰乱人源神经元-星形胶质细胞共培养体系中的神经元放电模式,导致异常节律——这可能是炎症期间认知与行为缺陷的潜在机制(Goshi, 2025 )。体内研究同样观察到类似紊乱:慢性TNF-α暴露会驱动海马区过度兴奋及癫痫样活动(Vezzani, 2020 )。
总体而言,TNF-α反应性星形胶质细胞成为神经元丧失和网络不稳定的关键驱动因素,直接将胶质细胞反应性与神经退行性疾病的进展联系起来。
这些证据共同表明,TNF-α从根本上重塑了星形胶质细胞的生物学特性,使其从中枢神经系统稳态的守护者转变为功能障碍的核心驱动器。通过将星形胶质细胞置于炎症、血管损伤与神经元脆弱性的交汇点,TNF-α揭示其并非被动响应者,而是神经退行性病变进程的关键调控者。这一视角重新定义了星形胶质细胞的定位——从慢性神经炎症对抗中的背景角色,转变为至关重要的治疗靶点。
TNF-α如何通过星形胶质细胞促进神经退行性疾病进展?
慢性TNF-α暴露会逐渐将星形胶质细胞推入有害状态,改变其基因表达、结构和代谢。即使在低浓度下,持续的TNF-α信号传导也会导致星形胶质细胞肥大、炎症基因重编程及代谢应激,促使研究者将星形胶质细胞反应性视为动态变化的状态谱系,而非简单的"保护性或毒性"二元对立(Escartin, 2021 )。
含有TNF-α的炎症性小胶质细胞信号强化了向神经毒性A1样星形胶质细胞的转变,为慢性先天免疫激活与神经退行性疾病中星形胶质细胞功能障碍建立了直接联系(Liddelow, 2017 )。人诱导多能干细胞衍生的星形胶质细胞复制了这一过程:TNF-α(±IL-1β)快速激活NF-κB,重塑形态和炎症基因网络(Hyvärinen, 2019 )。在帕金森病相关的人类星形胶质细胞中,TNF-α或α-突触核蛋白纤维驱动星形胶质细胞进入重叠的免疫代谢状态,其特征为线粒体呼吸缺陷,这表明长期细胞因子暴露如何破坏细胞能量平衡(Russ, 2021 )。
这些发现共同表明,慢性TNF-α信号传导给星形胶质细胞带来了持续的炎症和代谢负担,使其进入功能失调状态,削弱了其支持作用,并积极促进了神经退行性疾病的进展。
在突触层面,TNF-α通过改变星形胶质细胞的谷氨酸处理及胶质细胞传递机制,破坏神经回路稳定性并加剧兴奋性毒性脆弱性:
- 仅激活星形胶质细胞的TNFR1受体即可改变兴奋性传递并损害自身免疫性脱髓鞘疾病中的海马记忆功能,证实星形胶质细胞TNF-α在神经网络功能障碍中具有直接因果作用(Habbas, 2015 )。
- TNF-α通过TNFR1-NF-κB通路降低EAAT2/GLT-1转运体表达,削弱谷氨酸摄取能力,使运动神经元暴露于毒性过度刺激(Jiang, 2019 )。
- 人诱导多能干细胞衍生的星形胶质细胞在TNF-α和IL-1β共同刺激下,谷氨酸清除功能受损且炎症激活增强(Hyvärinen, 2019 )。
- TNF-α通过增加伯格曼胶质细胞的谷氨酸释放增强小脑回路中的胶质细胞传递,这通过mGluR1信号通路提高了浦肯野细胞的兴奋性,导致放电模式不稳定(Shim,2018 )。
- 持续暴露于TNF-α(±IL-6)会破坏微电极阵列(MEAs)上人源神经元-星形胶质细胞共培养体系中的神经元放电动态,表明慢性细胞因子驱动了突发性回路节律紊乱(Goshi, 2025 )。
- 体内研究表明,TNF-α过表达会增加癫痫发作易感性并加速认知衰退,将星形胶质细胞功能障碍与更广泛的网络不稳定性联系起来(Vezzani, 2020 )。
这些发现共同表明,TNF-α驱动的星形胶质细胞功能障碍破坏了谷氨酸调节和突触平衡,导致广泛的回路不稳定和渐进性认知障碍。
在神经血管单元(NVU)内,TNF-α预处理的星形胶质细胞传递炎症信号,削弱血脑屏障完整性并损害血管功能。在人类和离体模型中,TNF-α驱动星形胶质细胞进入一种STAT3依赖的反应性状态,其特征是SERPINA3(也称为α1-抗胰凝乳蛋白酶,一种急性期丝氨酸蛋白酶抑制剂)的上调,这会降低血脑屏障的完整性并促进内皮功能障碍(Kim,2022 )。
携带帕金森病相关LRRK2突变的星形胶质细胞呈现促炎表型,在人脑芯片血脑屏障系统中无法支持微血管形态发生;该缺陷可通过MEK1/2抑制逆转(de Rus Jacquet, 2023 )。这些发现与更广泛的证据相吻合:星形胶质细胞末端足及其分泌的分子调节血脑屏障稳定性,而这些界面处的炎症重塑会导致神经退行性疾病中的血管功能障碍(Yue, 2023 )。基于这些机制性发现,人类多发性硬化症病灶的空间转录组学研究证实:TNF激活的星形胶质细胞聚集于血管周围区域,形成富含细胞因子的微环境,主动破坏血脑屏障结构(Mazziotti, 2024 )。
这些发现表明,TNF-α驱动的星形胶质细胞会主动破坏血脑屏障完整性及血管健康,使其成为神经退行性疾病中神经血管功能障碍的关键促成因素。
在主要神经退行性疾病中,TNF-α驱动的星形胶质细胞程序共同充当疾病进展的放大器。通过将炎症信号与突触、代谢及血管功能障碍相耦合,星形胶质细胞将TNF-α信号转化为局部机制,加速神经元脆弱性和组织退化。尽管这些核心过程在不同疾病中具有共通性,但TNF-α反应性星形胶质细胞与疾病特异性环境的交互方式存在显著差异。下文将阐述TNF-α通过星形胶质细胞的信号传导如何促进阿尔茨海默病、帕金森病、肌萎缩侧索硬化症(ALS)及多发性硬化症(MS)的进展。
阿尔茨海默病(AD)
TNF-α已成为AD中的关键介质,将β淀粉样蛋白病理、神经炎症和突触功能障碍联系在一起。研究一致发现,轻度认知障碍(MCI)及AD患者的脑脊液(CSF)和血清中TNF-α水平持续升高,且基线浓度越高预示认知衰退越快,进展为痴呆的风险越大(Kim, 2017 ;Lista, 2024 )。值得注意的是,这些生化变化伴随着星形胶质细胞的改变。反应性星形胶质细胞生物标志物(包括脑脊液GFAP和YKL-40)介导β淀粉样蛋白与tau蛋白对海马萎缩及认知功能的影响,将星形胶质细胞反应性与活体人类的神经退行性病变下游过程相联结(Ferrari-Souza, 2022 ;Pelkmans, 2024 )。神经病理学研究进一步揭示,反应性星形胶质细胞聚集在β淀粉样斑块和神经原纤维缠结周围,渗透斑块核心,既参与病理的封存也助长其传播(Perez-Nievas, 2018 )。
有关淀粉样β斑块微环境中星形胶质细胞形态的分析,请参阅:星形胶质细胞与淀粉样β——阿尔茨海默病小鼠模型
TNF-α参与AD的核心机制在于其驱动星形胶质细胞中淀粉样蛋白生成加工的能力。具体而言,TNF-α信号通路:
- 上调淀粉样前体蛋白(APP)和BACE1表达,加速β-淀粉样蛋白生成与斑块沉积(Zhao, 2011 )。
- 通过改变兴奋性与抑制性神经元的平衡破坏突触稳态:
- 增强谷氨酸能传递
- 削弱γ-氨基丁酸能抑制
- 增加AMPA受体表面转运,
这些效应共同使海马回路易患兴奋性毒性(Pribiag, 2013 ;Heir, 2020 )。这种兴奋性毒性损伤因星形胶质细胞介导的谷氨酸释放而进一步加剧,从而损害神经元存活(Santello, 2011 )。
星形胶质细胞本身并非被动响应者,而是AD中TNF-α信号传导的关键驱动者。实验证据表明:
- 在缺乏小胶质细胞的海马培养体系中,TNF-α信号持续存在;但当星形胶质细胞特异性缺失TNF时,该信号完全消失,证实星形胶质细胞对活动依赖性TNF释放不可或缺(Heir, 2024 )。
- 星形胶质细胞NF-κB激活通过调节谷氨酸外溢诱导的TNF生成,将星形胶质细胞置于细胞因子驱动的回路重塑核心位置。
- 星形胶质细胞NF-κB信号的调控改变了AD模型中的神经元和突触结果(Jong Huat, 2024 )。
- 星形胶质细胞谷氨酸处理功能障碍(特别是EAAT2/GLT-1转运体功能减弱)与TNF驱动的兴奋性毒性共同作用,加剧神经退行性病变(Wood, 2022 )。
遗传学研究强化了TNF-α的致病作用。TNF-α启动子中的G-308A多态性可增强转录活性和蛋白表达,多项荟萃分析将其与阿尔茨海默病易感性升高相关联(王,2015 )。该变异可能与APOE-ε4基因型协同作用,加速炎症启动和疾病进展(Contreras, 2020 ),凸显了TNF信号作为散发性与家族性AD共同病理机制的重要性。
治疗研究凸显了靶向TNF-α的转化潜力。数据显示:
- 接受依那西普或阿达木单抗等TNF抑制剂治疗的全身性炎症性疾病患者,其痴呆发生率低于未治疗人群。
- 采用脊柱周围伊那西普给药的小型先导试验及病例报告显示,AD患者认知功能可快速改善且有时能持续改善。
- 但采用皮下依那西普的大型随机对照试验未能显示显著疗效,可能因大分子生物制剂血脑屏障渗透性差所致。
- 针对血脑屏障穿透型TNF抑制剂的临床前研究显示,在AD小鼠模型中,β淀粉样蛋白和tau病理损伤减轻伴随认知功能改善,强化了TNF靶向治疗的理论依据(Plantone, 2024 )。
综合而言,这些发现表明TNF-α通过星形胶质细胞驱动机制,是AD中β淀粉样蛋白沉积、兴奋性毒性及神经退行的核心驱动因素,使其成为具有生物学合理性的治疗靶点。尽管临床数据尚处初步阶段(尤其涉及血脑屏障递送),但TNF-α抑制仍为疾病修饰提供了前景广阔的途径。
帕金森病(PD)
星形胶质细胞TNF-α在帕金森病(PD)中扮演核心角色,作为连接α-突触核蛋白病理与神经炎症放大及神经元脆弱性的关键介质。在PD患者中,TNF-α及其可溶性受体在脑组织、脑脊液和血液中持续升高,与多巴胺能神经元变性、认知衰退及整体疾病严重程度呈正相关(Liu, 2022 )。 星形胶质细胞内α-突触核蛋白的积累 不仅破坏了线粒体和内质网的功能,还驱动了反应性、促炎的表型(Wang,2021 )。重要的是,含有α-突触核蛋白包涵体的星形胶质细胞会分泌高水平的TNF-α,使这种细胞因子成为连接蛋白病与炎症扩增的核心效应器(Lee,2010 )。
星形胶质细胞衍生的TNF-α促成了帕金森病中胶质细胞反应性的前馈循环。
关于α-突触核蛋白如何影响帕金森病及其他突触核蛋白病中微胶质细胞和星形胶质细胞的深入综述,请参阅:《帕金森病中的微胶质细胞、星形胶质细胞与α-突触核蛋白》
除IL-1β和IL-6外,星形胶质细胞TNF-α还具有以下作用:
- 强化小胶质细胞活化,从而加速多巴胺能神经元丧失。
- 加剧神经元脆弱性。
- 建立胶质细胞反应的前馈回路,将星形胶质细胞驱动的细胞因子信号传导与进行性黑质纹状体变性相联结(Wang, 2023 )。
实验性帕金森病模型表明,即使在明显神经元丧失前,IFN-γ和TNF-α共同维持小胶质细胞与星形胶质细胞的激活状态,这凸显了TNF-α在启动胶质细胞驱动神经炎症中的关键作用(Barcia, 2011 )。机制研究进一步揭示调节因子RGS5:
- 使星形胶质细胞中的TNFR2信号从保护性转向促炎性。
- 增强TNFR1激活
- 在帕金森病模型中促进α-突触核蛋白聚集、神经退行性变及死亡率(Yin, 2023 )。
星形胶质细胞向神经毒性A1状态的转化是TNF-α不可或缺的另一病理机制。小胶质细胞释放的IL-1α、TNF-α和C1q共同诱导星形胶质细胞转化为该有害表型。A1型星形胶质细胞已在帕金森病患者尸检脑组织中被确证(Liddelow, 2017 )。在PD动物模型(散发性PD的α-syn PFF模型及hA53T转基因小鼠模型)中, 病理性α-突触核蛋白同样促进A1星形胶质细胞形成,阻断该过程可保护多巴胺能神经元并维持运动功能(Yun, 2018 )。此类A1星形胶质细胞:
- 丧失提供营养支持与突触支持的能力。
- 分泌神经毒性因子,包括补体成分和活性氧(ROS)。
- 加剧神经元损伤(Liddelow, 2017 )。
人类研究证实星形胶质细胞TNF-α在帕金森病中的致病作用。人类帕金森病中脑的单细胞RNA测序揭示了泛胶质细胞激活现象,表现为CD44高表达的星形胶质细胞表型及细胞因子信号通路,与黑质微环境中的慢性炎症状态相吻合(Smajić, 2022 )。在培养的人类星形胶质细胞中,TNF-α与α-突触核蛋白纤维可诱发免疫反应性状态并损害线粒体呼吸,凸显出与PD发病机制相符的TNF响应性代谢缺陷(Russ, 2021 )。补体C4进一步放大该致病级联反应:
- 增强星形胶质细胞对α-突触核蛋白的促炎反应
- 促进神经元凋亡及突触病理(Zou, 2025 )。
此外,在脑芯片模型中,经炎症预处理的人类星形胶质细胞会损害微血管形态发生并破坏血脑屏障完整性(de Rus Jacquet, 2023)。机制上,TNF驱动星形胶质细胞进入STAT3依赖性急性期样状态,将全身性炎症传递至脑内皮细胞,从而促进帕金森病中的血脑屏障破坏(Kim, 2022 )。
综上所述,这些发现将星形胶质细胞TNF-α定位为连接帕金森病中α-突触核蛋白病理、胶质细胞放大效应、突触功能障碍及血管损伤的核心机制。
肌萎缩性侧索硬化症(ALS)
星形胶质细胞TNF-α信号通路已被证实是ALS中运动神经元脆弱性的早期持续驱动因素。ALS患者脑脊液和血液中持续检测到TNF-α水平升高,且与疾病进展相关(Jiang, 2022 )。类似地,在SOD1G93A小鼠中,TNF-α及其受体在症状出现前即已在脊髓中上调,表明该通路参与早期致病过程(Brambilla, 2016 )。在这些模型衍生的星形胶质细胞-运动神经元共培养体系中,运动神经元膜结合型TNF-α增加而TNFR2水平下降,导致受体信号传导失衡。值得注意的是:
- 仅删除TNFR2(而非TNFR1)即可挽救运动神经元存活,证实mTNF-α-TNFR2轴是神经毒性的关键介导通路(Tortarolo, 2015 )。
- 相反,TNFR1信号可能具有保护作用,其机制可能涉及星形胶质细胞释放胶质源性神经营养因子(GDNF),因其缺失会加剧疾病进程(Brambilla, 2016 )。
这些发现强调TNFR1与TNFR2对ALS病理作用具有高度情境依赖性,在孤立共培养系统与复杂 体内环境中表现各异。此外,两者均可激活凋亡信号调节激酶1(ASK1)/p38MAPK通路,该通路对运动神经元死亡具有关键作用。在SOD1G93A小鼠来源的星形胶质细胞/运动神经元共培养模型中,抑制p38 MAPK可保护运动神经元,表明该通路是ALS中TNF信号的关键下游效应器(Dewil, 2007 )。同时:
- 在携带突变FUS的星形胶质细胞中,TNF-α激活NF-κB并通过减少GluA2亚基的整合改变AMPA受体亚基组成。
- 该变化导致运动神经元钙渗透性增加及兴奋性毒性应激增强 (Kia, 2018 )。
- 在FUS-ALS模型中,基因性TNF-α缺失或药理学中和可挽救运动行为与神经元存活,证实星形胶质细胞来源的TNF-α是直接毒性信号(Jensen, 2022 )。
星形胶质细胞TNF-α还塑造炎症微环境,驱动胶质细胞与免疫反应共同加剧ALS病理。关键机制包括:
- 星形胶质细胞中可诱导的NF-κB激活促进小胶质细胞增殖和外周白细胞招募,加速症状进展(Ouali Alami, 2018 )。
- 小胶质细胞的IL-1α/TNF/C1q信号三联体诱导神经毒性A1星形胶质细胞表型,阻断该通路可延长SOD1G93A小鼠存活期(Guttenplan, 2020 )。
- 携带SOD1突变的星形胶质细胞因线粒体应激、蛋白酶体功能障碍及先天免疫激活而进入反应性失调状态,TNF-α信号进一步加剧该状态。
- 尽管成纤维细胞生长因子4(FGF4)可暂时恢复星形胶质细胞稳态,但TNF-α通过维持NF-κB活性覆盖了这种保护作用,使运动神经元处于易受攻击状态(Velasquez, 2024 )。
星形胶质细胞的TNF-α扰乱谷氨酸稳态,进一步加剧ALS中的兴奋性毒性应激。具体而言,通过星形胶质细胞TNFR1介导的TNF-α信号传导:
- 抑制EAAT2/GLT-1表达。
- 驱动谷氨酸释放。
- 导致谷氨酸清除受损及运动神经元兴奋性毒性应激,该机制与人类ALS病理特征一致(Jiang, 2019 )。
这种破坏与TNF诱导的AMPA受体组成变化协同作用,加剧了钙驱动的兴奋性毒性(Kia, 2018 ;Jensen, 2022 )。
综上所述,星形胶质细胞TNF-α作为ALS中炎症、受体失衡与兴奋性毒性相互作用的汇聚点,通过同步放大炎症级联反应、改变谷氨酸代谢及增强兴奋性受体通透性,加速运动神经元退化并推动疾病进展。
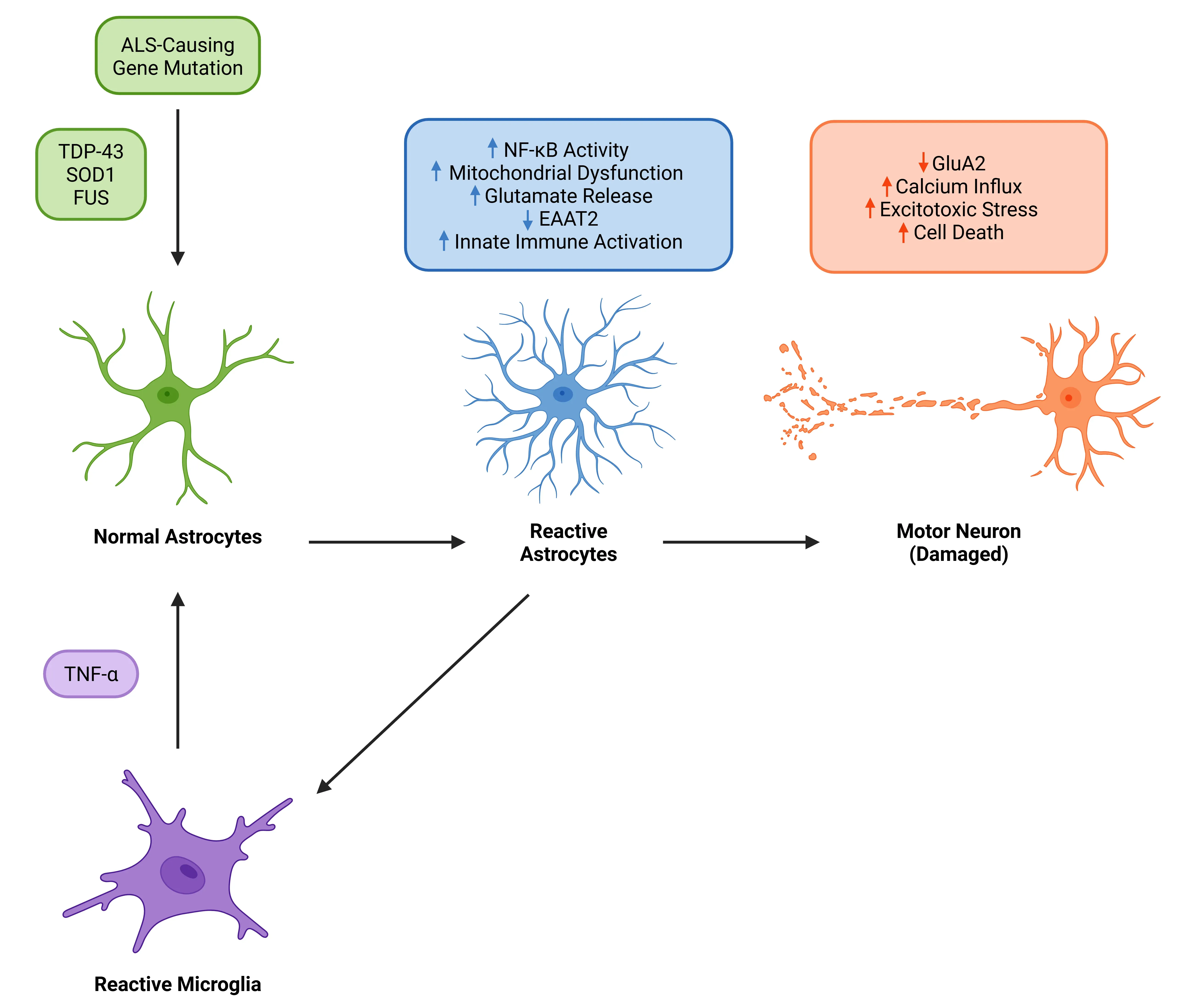
TNF-α作为ALS中星形胶质细胞反应性和运动神经元退化的关键驱动因子。在与TDP-43、SOD或 FUS突变相关的ALS中,反应性小胶质细胞释放的TNF-α通过TNFR信号通路促进星形胶质细胞反应性。该过程激活星形胶质细胞内的NF-κB通路,阻碍谷氨酸清除,进而引发兴奋性毒性应激及运动神经元死亡。反应性星形胶质细胞进一步加剧神经炎症,形成加速运动神经元丧失的反馈循环。
多发性硬化症(MS)
在多发性硬化症(MS)中,星形胶质细胞作为TNF-α效应的关键介导者,将炎症级联反应与神经毒性及修复过程相联结。TNF-α在脑脊液(CSF)中持续升高,并存在于急性及慢性活动性MS病灶中,其浓度越高与越严重的残疾及加速的疾病进展相关(Sharief, 1991 ;Kosa, 2022 )。病灶级病理学证实TNF在急性及慢性活动性斑块中上调,表明TNF信号与活动性组织损伤部位相关(Mazziotti, 2024 )。
星形胶质细胞放大局部TNF信号的关键机制在于膜结合型TNF的蛋白水解加工。在活动性MS病灶中,反应性星形胶质细胞上调ADAM17/TACE,该酶将半膜性TNF裂解为可溶性形式。这种转变优先激活TNFR1受体,从而增强凋亡和促炎级联反应(Plumb, 2006 )。在实验性自身免疫性脑脊髓炎(EAE)模型中,星形胶质细胞的TNFR1信号通路被证实驱动海马区突触重塑及认知功能障碍,直接揭示了胶质细胞TNF信号与神经网络功能障碍的关联(Habbas, 2015 )。后续基因拯救研究证实,在星形胶质细胞中特异性恢复TNFR1即可重建突触和行为学层面的EAE表型 (Di Castro, 2022 )。 综合而言,这些发现表明星形胶质细胞不仅是TNF介导神经毒性的响应者,更是其放大器。
与此同时,星形胶质细胞亦能激活保护性TNF通路,凸显其在MS中的双重作用。它们同时表达TNFR1和TNFR2,且越来越多的证据表明TNFR2信号传导有利于神经保护和修复。在脱髓鞘模型中,星形胶质细胞的TNFR2激活可促进抗炎表型,并通过pCXCL12驱动少突胶质细胞募集等机制支持再髓鞘化(Brambilla, 2011 ;Patel, 2012 )。最新研究进一步揭示,TNFR2可抑制星形胶质细胞的促炎程序,增强对髓鞘形成的营养支持,从而成为抵消TNFR1介导损伤的关键平衡因子(Raphael, 2019 ;Pegoretti, 2023 )。
这些机制性发现有助于解释为何针对MS的广谱抗TNF疗法临床尝试均告失败:
- 非选择性TNF阻断与以下现象相关:
- 脱髓鞘事件的悖论性加剧
- 中枢神经系统新发炎症综合征(W. Xie, 2024 )
因此治疗方向已转向选择性调节TNF信号通路(Brambilla, 2011 ;Pegoretti, 2023 ):
- 在临床前及转化研究中均具前景的策略包括:
- 抑制TNFR1
- 中和sTNF
- 保留或激动TNFR2
综合而言,这些发现表明TNF作为关键细胞因子,在多发性硬化症中协调星形胶质细胞反应,持续调节损伤与修复之间的平衡。星形胶质细胞TNF信号传导的双重特性凸显了治疗靶向的挑战与机遇,使受体选择性调控成为神经保护和髓鞘再生的理想策略。
哪些治疗策略针对星形胶质细胞中的TNF-α信号传导?
当前治疗策略可归纳为四大主要方向,各自针对星形胶质细胞中TNF-α信号传导的不同环节:
TNF-α受体/配体抑制剂
治疗策略日益聚焦于通过抑制病理性TNFR1活性,同时保留或增强TNFR2的修复功能,从而精细调控星形胶质细胞中的TNF-α信号传导。这种平衡至关重要,因为选择性抑制TNFR1或中和sTNF可保留tmTNF-TNFR2信号传导,该传导支持中枢神经系统内的营养和再髓鞘化程序(Fischer, 2020 )。
关键方法包括:
- 受体选择性拮抗剂
- 单价人源化TNFR1特异性拮抗剂Atrosimab已在包括EAE模型在内的炎症模型中展现疗效,验证了选择性阻断TNFR1作为星形胶质细胞中心干预策略的有效性。
- 其他临床前研究将这些益处扩展至急性神经退行性病变,凸显了该药物类别更广泛的神经保护潜力 (Ortí-Casañ, 2023 )。
- 配体靶向策略:
- 显性负性TNF与XPro1595(聚乙二醇化泛素蛋白酶)可中和sTNF,同时保留mTNF-TNFR2信号通路(MacPherson, 2017 ;De Sousa Rodrigues, 2019 )。
- ADAM17/TACE抑制可阻止tmTNF裂解为sTNF,从而进一步促进TNFR2通路(L. Xie, 2024 )。
尽管取得这些令人鼓舞的成果,临床转化仍面临挑战,因多数生物制剂难以穿透血脑屏障。该局限性推动了分子穿梭体与中枢神经系统靶向递送系统的研发(Kouhi, 2021 )。此外,非选择性全身性TNF抑制剂的临床应用经验表明,脱髓鞘疾病反而出现悖论性恶化,这凸显了在神经炎症环境中采用受体和配体选择性策略的重要性(Mazziotti, 2024 )。
靶向下游信号通路
另一种策略是调节TNF受体下游信号通路,特别是调控星形胶质细胞反应性的NF-κB和MAPK通路。
- 关键下游靶点:
- NF-κB:星形胶质细胞特异性激活可增强体内神经炎症,表明选择性抑制可能有益;但最新人体细胞研究显示其对神经元的影响具有双重性——既可保护亦可损害(Giovannoni, 2020 )。
- p38α MAPK:MW150等选择性抑制剂在AD模型中可抑制神经炎症并改善认知功能,显示出转化应用潜力(Frazier, 2024 )。
- MEK1/2(ERK通路):抑制该通路可恢复携带PD相关突变星形胶质细胞的微血管形态发生。正常状态下,MEK/ERK通路协助星形胶质细胞调节应激反应并维持平衡的炎症信号传导。但在疾病状态下,这种保护作用会病理性增强,凸显MEK/ERK作为血脑屏障稳定化可调控杠杆及神经退行性疾病潜在治疗靶点的价值(de Rus Jacquet, 2023 )。
- JNK通路:抑制可限制星形胶质细胞CXCL1释放及下游神经元应激反应,确立JNK作为平行通路靶点的地位(Zhang, 2022 )。
星形胶质细胞表型调控
互补性治疗策略旨在重编程星形胶质细胞,使其脱离神经毒性表型,转向稳态或修复状态。阻断IL-1α/TNF/C1q轴可防止星形胶质细胞向A1样亚型转化,并在体内维持神经元与少突胶质细胞存活,这是星形胶质细胞表型调控具有治疗价值的最有力证据之一(Liddelow, 2017 )。其他有前景的机制包括:
- ELOVL1抑制剂可阻断毒性脂质颗粒释放,揭示脂质代谢是另一可药物靶向的脆弱点(Guttenplan, 2021 )。
- HDAC3抑制剂可抑制炎症基因激活,同时保留星形胶质细胞的支撑功能(Clayton, 2024 )。
- GLP-1受体激动剂(如NLY01)可抑制小胶质细胞诱导的星形胶质细胞毒性,目前正用于阿尔茨海默病和帕金森病的临床试验(Yun, 2018 ;Park, 2021 )。
基因治疗与新型生物制剂
基因与生物疗法正进一步拓展星形胶质细胞特异性调控TNF信号的途径:
- 向星形胶质细胞递送IL-2基因可增加局部调节性T细胞,减轻神经炎症且不影响全身免疫(Yshii, 2022 )。
- 基于GFAP启动子、新一代星形胶质细胞特异性元件及广谱血清型增强子的AAV载体技术进步,现已实现啮齿类及大型动物模型中的星形胶质细胞选择性基因转移(O’Carroll, 2021 ;Heffernan, 2022 ;Gleichman, 2023 )。
- 序贯TNFR2激动剂与TNFR1拮抗剂联合策略在人源化EAE模型中改善预后,证实通过时序性调节受体活性可最大化疗效并最小化风险(Pegoretti, 2023 )。
总体而言,靶向星形胶质细胞TNF-α信号通路凸显了关键需求:在抑制其致病性炎症反应的同时,必须保留支持神经修复与血脑屏障稳定性的保护功能。当前疗法面临的核心障碍仍是脑部渗透性不足,但选择性抑制剂、递送系统及星形胶质细胞靶向干预技术的进步,为将TNF-α调控转化为可行神经保护疗法带来了希望。
TNF-α在神经退行性变中的作用与其他细胞因子有何不同?
在神经退行性变过程中,TNF-α与其他细胞因子存在若干关键差异,这些差异既决定了其在疾病进展中的作用,也塑造了其作为治疗靶点的潜力。
TNF-α的独特功能(凋亡、坏死性凋亡、炎症)
TNF-α在神经炎症细胞因子中占据独特地位,因其受体网络将炎症信号与程序性细胞死亡相联结。与其他介质不同,TNF-α通过TNFR1将基因诱导与凋亡和坏死性凋亡相耦合,除NF-κB驱动的生存和促炎输出外,还激活RIPK1/RIPK3/MLKL通路(Holbrook, 2019 ;van Loo, 2023 )。
相比之下:
- IL-6通过以下途径发挥作用:
- 通过膜结合型IL-6R的"经典"信号通路,促进保护性与再生性反应。
- 通过可溶性IL-6R介导的"跨膜信号传导",该途径可放大炎症反应。
- 可溶性IL-6受体主要发挥激动剂作用,与TNF受体(其可溶性形式多为拮抗剂)形成对比(Rose-John, 2021 )。
- 激活倾向性STAT3反应,增强星形胶质细胞反应性,破坏血管稳定性,导致血脑屏障破坏(Mora, 2024 )。
- 干扰素-γ(IFN-γ)重编程星形胶质细胞向抗原呈递方向发展,产生干扰素响应性反应性星形胶质细胞(IRRA),而非TNF诱导的促死亡状态(Rostami, 2020 ;Prakash, 2024 ;Lee, 2023)。
这些发现表明,TNF-α独特地将先天炎症信号与执行性死亡通路相连接,使其比IL-6或IFN-γ更接近神经退行性变的"最终共同"途径。
TNF-α 与星形胶质细胞中其他细胞因子的协同与分化
功能上,TNF-α 常作为预备性细胞因子,使星形胶质细胞为不良适应性表型做好准备,尤其在与其他介质协同作用时。
关键相互作用包括:
- TNF-α + IL-1α + C1q:驱动星形胶质细胞进入A1样状态,导致突触支持功能丧失及神经元与少突胶质细胞死亡(Liddelow, 2017 )。
- TNF-α + IL-1β:强烈激活人诱导多能干细胞来源星形胶质细胞中的NF-κB信号通路,重塑其结构并诱导强烈的免疫反应状态(Hyvärinen, 2019 )。
这些发现表明:TNF-α既协同IL-1α(与C1q共同作用)又协同IL-1β驱动神经毒性及免疫反应性星形胶质细胞状态;而IFN-γ和IL-6等细胞因子则激活不同通路,凸显了不同细胞因子程序如何塑造疾病状态下星形胶质细胞的行为模式。
TNF驱动星形胶质细胞的空间与单细胞特征
单细胞及空间转录组学揭示TNF-α响应性星形胶质细胞形成独特的疾病相关状态:
- 在阿尔茨海默病中:
- snRNA测序显示,斑块邻近星形胶质细胞丧失正常支持性基因程序,转而激活TNF驱动的补体与炎症通路(Dai, 2023 )。
- 空间转录组学进一步证实,这些斑块边界星形胶质细胞受TNF/IL-1信号强烈调控,并聚集于退化神经元周围(He, 2024 )。
- 荟萃分析显示TNF-α、IL-6和IL-1β在AD病程中呈平行升高趋势,且与认知衰退恶化直接相关(Lista, 2024 ;Serna, 2025 )。
- 在帕金森病中:
- 小核糖核酸测序揭示了胶质细胞的广泛激活,其中包括一类CD44高表达星形胶质细胞,其基因表达反映了黑质中由TNF/IL-1驱动的慢性炎症(Smajić, 2022 )。
TNF-α相较其他细胞因子的治疗选择性
TNF-α在治疗中具有独特优势,其信号传导架构可选择性靶向有害的TNFR1通路,同时保留保护性TNFR2功能。这种选择性平衡是TNF特有的,无法通过IL-6或IFN-γ阻断实现(Fischer, 2020 ;Papazian, 2021 )。
- 非选择性抗TNF疗法可能加剧中枢神经系统自身免疫反应(Mazziotti, 2024 )。
- IL-6疗法(如sgp130Fc)在阻断炎症的同时保留了保护性"经典"IL-6信号通路,但未能解决TNF受体信号特有的细胞死亡通路(Rose-John, 2021 )。
- IFN-γ疗法通过调节免疫相关星形胶质细胞功能(如抗原呈递)发挥作用,而非干预TNF驱动的凋亡与坏死级联反应(Prakash, 2024 ;Lee, 2023 )。
综合比较表明,TNF-α在细胞因子中具有独特性,其信号传导可实现精准治疗调控:选择性阻断TNFR1或sTNF既能抑制神经毒性与细胞死亡通路,又能维持TNFR2介导的修复功能——这种治疗平衡是IL-6或IFN-γ干预无法达成的。
总体而言,证据表明TNF-α通过比其他细胞因子更直接的方式影响星形胶质细胞行为,从而促进神经退行性病变进展。通过将炎症信号与细胞死亡通路耦合、放大星形胶质细胞的异常适应状态、驱动区域特异性转录变化,TNF-α使星形胶质细胞成为疾病机制与治疗机遇的核心枢纽。
我们的团队很乐意解答关于TNF-α在星形胶质细胞中的功能及其对神经退行性疾病影响的任何问题,或提供有关我们用于治疗有效性研究的阿尔茨海默病(AD)、肌萎缩侧索硬化症(ALS)和帕金森病(PD)模型的具体信息。
相关内容
关于TNF-α与小胶质细胞在神经退行性疾病中的最新研究进展,以及在神经退行性疾病动物模型中评估治疗药物的最佳实践方法。
神经退行性疾病中的TNF-α和微胶质细胞
概述肿瘤坏死因子-α(TNF-α)在小胶质细胞中的作用及其对神经退行性病变进展的影响。
什么是IL-1β?
白细胞介素-1β(IL-1β)的概述、其在全身性及神经系统疾病中的促炎作用,以及基于IL-1β拮抗作用的治疗策略。
线粒体功能障碍在小胶质细胞与星形胶质细胞中的作用
线粒体功能障碍在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩侧索硬化症)中对小胶质细胞和星形胶质细胞的作用。
小胶质细胞、星形胶质细胞与α-突触核蛋白在帕金森病中的作用
α-synuclein在帕金森病及其他α-synuclein相关疾病中对小胶质细胞和星形胶质细胞的影响。
白细胞介素-1β(IL-1β)与神经退行性疾病
白细胞介素-1β(IL-1β)在神经退行性疾病中的作用,包括阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
小胶质细胞、星形胶质细胞与tau蛋白在神经退行性疾病中的作用
胶质细胞驱动的神经炎症如何促进阿尔茨海默病及其他tau蛋白病中tau蛋白的聚集、传播及神经元死亡。