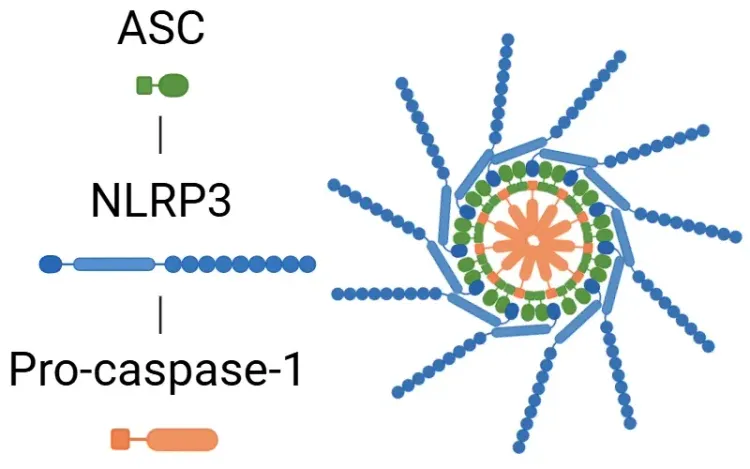
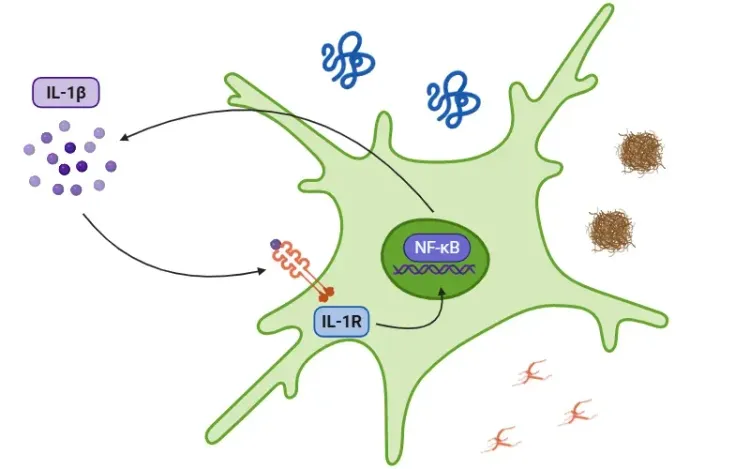
什么是炎症小体?
炎症小体是一种细胞质多蛋白复合物,在先天免疫应答中发挥关键作用,通过识别病原体和细胞应激信号来启动炎症反应。这些复合物通常在病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)刺激下形成,并作为炎症反应的中心调节器。
结构上,炎症小体由一个传感器蛋白(如NOD样受体(NLR)家族成员NLRP1、NLRP3和NLRC4,或黑色素瘤缺失蛋白2(AIM2)受体)组成。激活后,这些传感器招募适应蛋白ASC(凋亡相关斑点样蛋白,含CARD结构域)和效应酶前体caspase-1,形成活性炎症小体复合体。然而,并非所有炎症小体都遵循相同的组装过程。例如,NLRP1的CARD结构域可直接与前体半胱天冬酶-1相互作用,无需ASC的参与(Lu, 2023)。
炎症小体激活通常涉及两个步骤:启动和激活。
- 预激活通常通过NF-κB等信号通路实现,这些通路可上调炎症小体组分(如前IL-1β和前IL-18)的表达(Lu, 2023;Liao, 2025)。
- 激活发生在响应次级信号后,促使炎症小体复合体组装并激活caspase-1(Liu,2018)。
在所有已知的炎症小体中,NLRP3是最受研究的,因为它具有广泛的激活触发因素,包括ATP、β-淀粉样蛋白(Aβ)聚集物和尿酸等结晶物质。其他触发因素包括离子流、溶酶体损伤和线粒体功能障碍。
参见:什么是NLRP3?
其他炎症小体由更特异的触发因子激活:
- AIM2对细胞质DNA作出反应
- NLRC4由细菌鞭毛蛋白激活
一旦激活,caspase-1会将前体细胞因子pro-IL-1β和pro-IL-18裂解为成熟形式——IL-1β和IL-18——并分泌出来,从而引发炎症。caspase-1还诱导凋亡,一种具有促炎作用的程序性细胞死亡形式。
参见:什么是IL-1β?以获取关于IL-1β作用的更深入解释。
尽管炎症小体对宿主防御至关重要,但其慢性或失调激活与多种疾病相关,包括自身免疫性疾病、神经退行性疾病和代谢综合征(Guo, 2015)。
综上所述,炎症小体是先天免疫的重要调节器。然而,其活性必须严格调控以防止病理性炎症的发生。
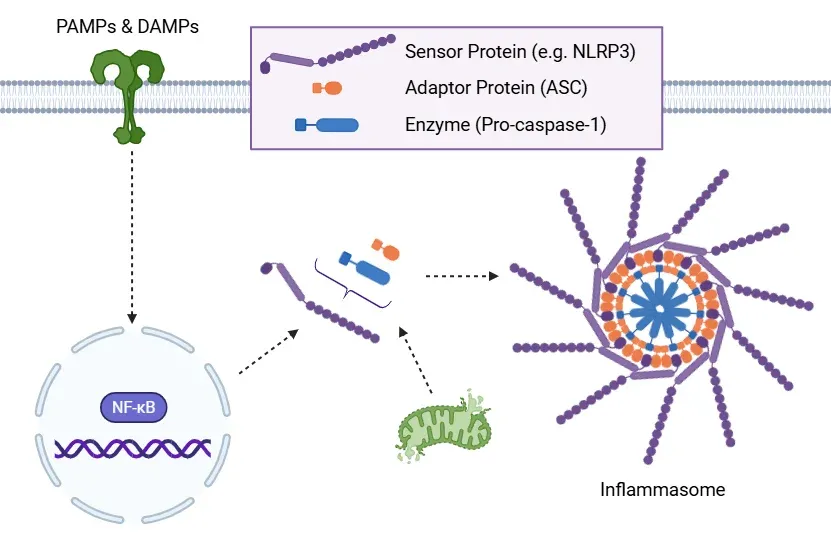
经典炎症小体激活通路。
炎症小体激活的示意图。在初始激活阶段,病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)激活NF-κB信号通路,增加炎症小体组分的表达。随后,由线粒体不稳定等因素触发的激活过程导致炎症小体组装,通过招募ASC和前体caspase-1实现。
炎症小体在疾病中的作用是什么?
尽管炎症小体对宿主防御至关重要,但炎症小体活性的失调——无论是过度、持续还是不足——都可能通过促进组织损伤、慢性炎症和免疫紊乱,导致多种急性及慢性疾病的发生。
在疾病发病机制中的关键作用
- 自身炎症性疾病与自身免疫性疾病
- NLRP3基因突变与遗传性自身炎症综合征相关,如家族性冷自身炎症综合征(FCAS)和Muckle-Wells综合征(MWS)(Kuemmerle-Deschner, 2011;Chen, 2022)。
- NLRP1、NLRP3和AIM2的调节失衡与自身免疫性疾病如系统性红斑狼疮(SLE)和类风湿性关节炎相关(Yi, 2018)。
- 癌症
- AIM2炎症小体在癌症中具有双重作用,既可作为肿瘤抑制因子,又可作为肿瘤促进因子,具体作用取决于上下文。这些作用已在结直肠癌、肝癌和胃癌等癌症中被观察到(Alanazi, 2024)。
- 心血管疾病
- 在动脉粥样硬化中,胆固醇结晶激活巨噬细胞中的NLRP3,促进斑块炎症(Yalcinkaya, 2025)。
- NLRP3、NLRC4 和 AIM2 与心力衰竭的进展相关(Wu, 2021)。
- 代谢性疾病
- 在 2 型糖尿病中,脂肪组织和胰岛中的 NLRP3 激活促进胰岛素抵抗和 β-细胞功能障碍(Lu,2023)。
- 肥胖导致慢性低度炎症,部分原因在于脂肪酸和线粒体活性氧(ROS)激活NLRP3(Ahechu,2018)。
- 痛风由尿酸钠结晶引起,这些结晶是NLRP3炎症小体的强效激活剂(Kim, 2022)。
- 神经退行性疾病
- 慢性NLRP3激活通过促进β-淀粉样病理、tau蛋白过度磷酸化及神经元损伤,参与阿尔茨海默病(AD)的发病机制(Li, 2025)。
- 新兴研究还指出炎症小体与帕金森病(PD)、肌萎缩侧索硬化症(ALS)和多发性硬化症(MS)相关。
参见:NLRP3炎症小体与神经退行性疾病,以获取详细讨论。
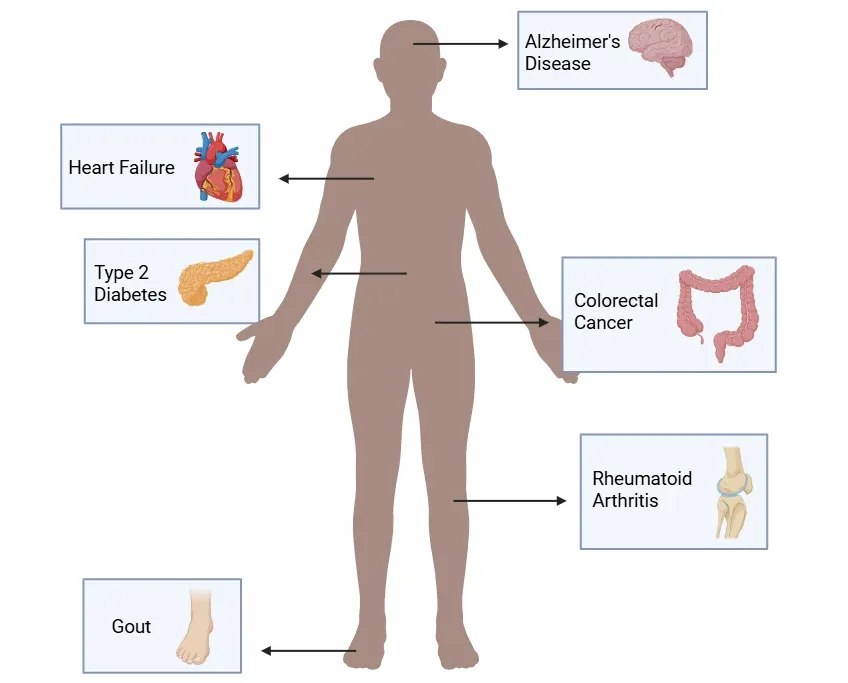
与炎症小体激活相关的代表性疾病。
炎症小体调节异常与多种疾病密切相关,包括神经退行性疾病、心血管疾病、自身免疫性疾病及代谢性疾病。图中列举了部分典型例子,但许多其他疾病也涉及炎症小体通路。
疗法是如何作用于炎症小体的?
针对炎症小体的治疗方法旨在通过干扰炎症小体信号传导通路中的关键节点来抑制病理性炎症。目前大多数策略聚焦于NLRP3,因其在多种炎症性疾病中发挥核心作用。
直接抑制NLRP3
- MCC950是一种选择性小分子抑制剂,可阻断NLRP3激活并防止IL-18和IL-1β 的 释放 。该药物在多个前临床疾病模型中显示出疗效(Dempsey, 2017;Gordon, 2018;Gao, 2019)。
- 其他药物,如达帕苏特雷(dapansutrile,OLT1177®),正处于研究阶段,其中部分已进入早期临床试验(NCT06047262;NCT05658575)。
caspase-1 抑制
- VX-765,一种caspase-1抑制剂,已在体外和体内实验中显示出减少细胞因子产生和凋亡的有效性(McKenzie, 2018;Flores, 2020)。
IL-1β通路阻断
阻断炎症小体激活后下游的IL-1β信号传导是经验证的治疗策略:
- 阿那白滞素(IL-1受体拮抗剂)
- Canakinumab(针对 IL-1β 的单克隆抗体)
- Rilonacept(可溶性诱饵受体)
这些药物已获批用于多种自身炎症性疾病,并正在探索更广泛的适应症,包括心血管和神经退行性疾病(Wu, 2021;Melchiorri, 2023)。
靶向凋亡和Gasdermin D
新兴研究正在探索气溶素D,作为凋亡的关键执行者。通过抑制气溶素D,可能实现阻断炎症性细胞死亡的同时保留细胞因子信号传导——这为提供靶向且潜在更安全的治疗策略开辟了可能性(Dai, 2023)。
综上所述,炎症小体靶向疗法在治疗多种炎症性和自身免疫性疾病方面展现出巨大潜力。然而,由于其在免疫防御中的关键作用,这些疗法必须谨慎调节以避免损害宿主免疫功能。
我们的团队很乐意回答您关于炎症小体(Inflammasomes)的任何问题,或提供我们用于治疗有效性研究的神经退行性疾病模型相关具体信息。
相关内容
关于神经炎症的最新信息以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
什么是NLRP3?
NLRP3及NLRP3炎症小体激活的触发机制、疾病关联及治疗靶点策略综述。
什么是IL-1β?
白细胞介素-1β(IL-1β)的概述、其在全身性及神经系统疾病中的促炎作用,以及基于IL-1β拮抗作用的治疗策略。
白细胞介素-1β(IL-1β)与神经退行性疾病
白细胞介素-1β(IL-1β)在神经退行性疾病中的作用,包括阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
NLRP3炎症小体与神经退行性疾病
NLRP3炎症小体及其在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症)中作用的概述。
线粒体功能障碍在小胶质细胞与星形胶质细胞中的作用
线粒体功能障碍在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩侧索硬化症)中对小胶质细胞和星形胶质细胞的作用。