この資料では以下の内容について説明しております:
NF-κBの役割とは何でしょうか?
NF-κB(核因子κB)は、転写因子として機能するタンパク質群と定義され、以下のような様々な細胞機能に関連する遺伝子の発現調節において重要な役割を果たしています:
- * 自然免疫および獲得免疫応答、炎症反応(インフラマソームの調節を含む)(Oeckinghaus, 2009;Liu, 2017)。
- 細胞増殖、細胞生存(抗アポトーシス)、代謝、細胞ストレス応答、シナプス可塑性(Oeckinghaus, 2009;Albensi, 2019;Capece, 2022)。
NF-κB転写因子ファミリーには、NF-κB1(p105/p50)、NF-κB2(p100/p52)、RELA(p65)、RELB、c-RELが含まれます(Barnabei, 2021;Capece, 2022;Guo, 2024)。NF-κBは、関与する免疫細胞の種類に応じて様々な役割を果たします(Zinatizadeh, 2021;Anilkumar, 2024;Guo, 2024):
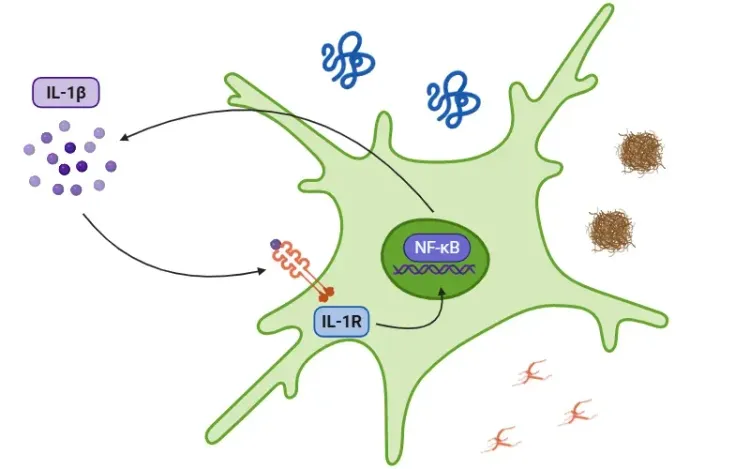
- マクロファージおよび樹状細胞:NF-κBは、TNFα、IL-1β、IL-6、IL-12、COX-2などのサイトカインの放出を通じて炎症を促進します。
- 神経炎症におけるサイトカインの詳細については、リソース「IL-1βとは?」、「IL-1βと神経変性疾患」、「TNF-α& 神経変性疾患におけるミクログリア」、および「TNF-α & 神経変性疾患におけるアストロサイト」をご参照ください。
- T細胞:NF-κBはサイトカイン産生を刺激し、主にIL-2を産生します。IL-2はT細胞の増殖およびTh1、Th2、Th17、Tregなどのサブタイプへの分化に不可欠です。
- B細胞:NF-κBはB細胞の増殖、生存、分化を促進します。
NF-κBシグナル伝達経路
- 一般的に、NF-κB は、IκB(p100、p105、IκBα、IκBβ を含む)と呼ばれる阻害タンパク質に結合し、細胞質内で不活性な状態を保っています。
- IκBキナーゼ(IKK)ファミリーはNF-κBを活性化し、活性化されたNF-κBは核へ移行して遺伝子発現を促進します。
主なシグナル伝達経路は二つあります:
- カノニカル経路(Oeckinghaus, 2009;Liu, 2017;Capece, 2022):
- 活性化は、サイトカイン(例:TNFα、IL-1β)、細菌・ウイルスの産物、活性酸素種(ROS)、放射線などの炎症促進シグナルを介して起こります。関与する主要な受容体には、インターロイキン-1受容体(IL-1R)、Toll様受容体(TLR)、TNF受容体(TNFR)、T細胞受容体(TCR)、B細胞受容体(BCR)などが挙げられます。
- 各シグナルは、異なる腫瘍壊死因子受容体関連因子(TRAF)を介してIKK複合体を活性化する独自のメカニズムを有しています。
- 全体として、このカスケードはトランスフォーミング成長因子-β活性化キナーゼ1(TAK1)を活性化し、TAK1はIKK複合体(IKKαおよびIKKβ)とその関連キナーゼであるNEMO(IKKγとしても知られる)を活性化します。
- 活性化されたIKKはIκB(主にIκBα)をリン酸化し、NF-κBの核内移行を可能にします。
- 核内では、NF-κB二量体がκB DNA配列に結合し、以下の遺伝子転写を促進します:
- IL-1β、IL-6、TNFαなどの炎症性サイトカインを産生し、炎症反応をさらに増幅させます。
- 他の免疫細胞を惹きつけるケモカイン。
- 炎症組織へ白血球を誘導する接着分子。
- その他の炎症性メディエーター(COX-2やiNOSなど)。
- 非典型経路(Lawrence, 2009;Oeckinghaus, 2009;Liu, 2017):
- この経路の活性化は、カノニカル経路よりも遅いものです。
- TNFスーパーファミリーの特定の受容体がこの経路を活性化します。これには、Bリンパ球活性化因子受容体(BAFF-R)、CD40、リンパ毒素β受容体(LTβR)、NF-κB活性化因子受容体(RANK)が含まれます。
- これらの受容体の活性化により、異なるタイプのTRAFメンバーが動員され、NF-κB誘導キナーゼ(NIK)が活性化されます。
- NIK の活性化により、IKKα ホモダイマーのリン酸化が起こります。
- NIK および IKKα は p100(NF-κB2 前駆体タンパク質)をリン酸化し、p52 として知られる活性型に変換します。
- p52 は p52/RelB 二量体を形成し、核へ移行して遺伝子転写を促進し、免疫細胞の生存、コミュニケーション、T 細胞および B 細胞の発達および成熟を調節します。
多くのシグナル伝達分子は、カノニカル経路とノンカノニカル経路の両方で活性化されるため、PI3K/AKT、MAPK、JAK-STAT、TGF-βなどの他の重要なシグナル伝達経路と直接的・間接的な相互作用が生じます(Guo, 2024)。
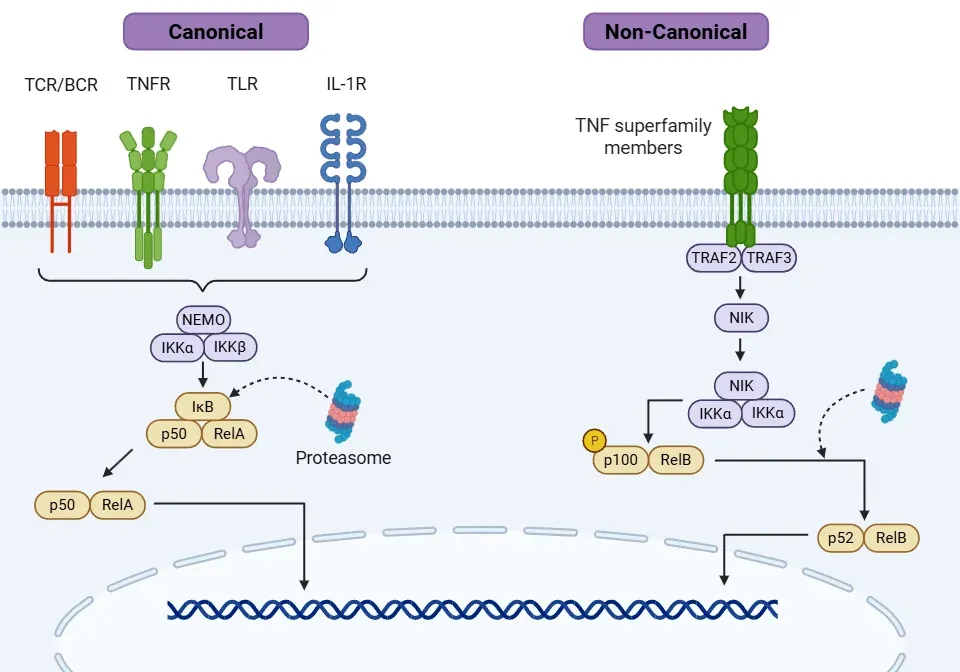
NF-κBシグナル伝達は、カノニカル経路および非カノニカル経路を介して行われます。
NF-κBの異常な調節が疾患に及ぼす影響とは何でしょうか?
NF-κBの役割は複雑で状況に依存し、有益とも有害とも考えられます(Albensi, 2019)。NF-κBは恒常性維持に不可欠ですが、その調節に問題が生じると、神経疾患、がん、炎症性疾患、自己免疫疾患など様々な疾患と関連します。
神経疾患
生理的条件下では、ニューロンにおけるNF-κBの活性は、神経新生、神経突起形成、シナプス可塑性など、正常なニューロン機能に必要です(Shih, 2015)。
- ニューロンにおいて、NF-κBは通常、Bcl-2、Bcl-XL、マンガンスーパーオキシドジスムターゼなどの抗アポトーシス遺伝子を誘導することで生存を促進します(Anilkumar, 2024)。
- ミクログリアにおいては、NF-κBの活性化が炎症促進応答を駆動し、サイトカイン(TNF-α、IL-1β、IL-6、IFN-γ)および活性酸素種(ROS)の放出につながります(Shih, 2015;Anilkumar, 2024)。
- 当社のリソース「神経変性疾患におけるTNF-αとミクログリア」をご参照ください。
- アストロサイトにおいては、NF-κBの活性化はアストロサイトの分化に必要であり、炎症反応を増強します(Anilkumar, 2024)。
- 当社のリソース「神経変性疾患におけるTNF-αとアストロサイト」をご参照ください。
しかしながら、NF-κBの制御異常な活性化は病態に関与します:
- 多発性硬化症(MS):
- NF-κBは、浸潤マクロファージ、ミクログリア、アストロサイト、および末梢免疫細胞を介して神経炎症を媒介します。
- また、NF-κBはT細胞がTregへ分化する過程にも必要であり、炎症性T細胞の病原性作用を促進します(Guo, 2024)。
- 実験的自己免疫性脳脊髄炎(EAE)では、NF-κBの活性化が神経炎症を引き起こします。興味深いことに、骨髄系細胞において特異的にIKKβを欠損させると、炎症性Th1およびTh17細胞の産生減少と関連して、EAEの発症が抑制されます(Liu, 2017)。
- アルツハイマー病(AD)およびパーキンソン病(PD):
- これらの疾患において、ミクログリアによるNF-κB活性化は、反応性ミクログリアおよびアストロサイトを介したプロ炎症性サイトカインのさらなる放出を促進し、神経毒性を引き起こし、神経変性に寄与します(Guo, 2024)。
- しかしながら、アルツハイマー病マウスモデルにおいて、NF-κBを阻害するとアミロイドβ(Aβ)およびタウタンパク質の蓄積が促進されることが示されており、NF-κBが疾患初期段階において保護的役割も果たしている可能性が示唆されています(Jong Huat, 2024)。
- 外傷性脳損傷および脊髄損傷:
- NF-κBは急性期後の炎症反応に関与し、それによって二次損傷に寄与します(Guo, 2024)。
癌
- NF-κBは、主に非典型経路の異常活性化を通じて腫瘍形成を促進する可能性があります。そのメカニズムは癌の種類によって異なります。一般的に、以下のメカニズムが含まれます(Aggarwal, 2011;Xia, 2014):
- 細胞の生存と増殖の促進:NF-κBは、サイクリンD1およびE、ならびにc-Mycの発現を増強すると同時に、Bcl-2、Bcl-XL、IAPsなどの因子を通じてアポトーシスを抑制することにより、がん細胞の制御不能な分裂に寄与します(Brown, 2008;Rinkenbaugh, 2016)。
- ピロプトーシス、アポトーシス、ネクロプトーシスに関する詳細情報は、リソース「ピロプトーシスとは何か?」をご参照ください。
- 血管新生促進:NF-κBは、VEGF、FGF、PDGF、IL-8などの血管新生促進因子による新たな血管形成を促進するとともに、上皮間葉転換を誘発し、腫瘍の増殖と転移を支持します(Brown, 2008;Park, 2016)。
- 免疫回避:NF-κBは、TGF-βを介した免疫抑制的な腫瘍微小環境の形成に寄与します(Rinkenbaugh, 2016;Guo, 2024)。
- 代謝のリプログラミング:NF-κBは代謝経路を変化させ、窒素需要の増加やミトコンドリアの異常な酸化的リン酸化 を引き起こします(Guo, 2024)。
- 細胞の生存と増殖の促進:NF-κBは、サイクリンD1およびE、ならびにc-Mycの発現を増強すると同時に、Bcl-2、Bcl-XL、IAPsなどの因子を通じてアポトーシスを抑制することにより、がん細胞の制御不能な分裂に寄与します(Brown, 2008;Rinkenbaugh, 2016)。
- NF-κBを活性化させる直接的な変異は血液がんに多く見られます。例えば、B細胞由来の非ホジキンリンパ腫ではc-Relの増幅が生じ、NF-κB2/p100は染色体転座によって頻繁に活性化されます(Xia, 2014)。
- 扁平上皮癌、乳癌、肺癌、大腸癌など、様々な癌種においてNF-κBの異常な調節が確認されています(Brown, 2008)。
自己免疫疾患および炎症性疾患
- 関節リウマチ(RA):NF-κBは慢性炎症を持続させ、RA患者の滑液中に存在することが確認されています。関節内のT細胞における炎症性サイトカイン(IFNγ、IL-15、IL-17、IL-18)の産生を促進し、骨吸収性破骨細胞の分化を促進します(Liu, 2017;Guo, 2024)。
- 炎症性腸疾患(IBD):この疾患はNF-κBの遺伝子変異と関連しており、クローン病や潰瘍性大腸炎などの疾患で同定されています。IBD患者では、結腸組織においてNF-κBの活性化が観察されています(Liu, 2017)。
- NF-κBの調節異常に関連するその他の自己免疫疾患には、全身性エリテマトーデスや1型糖尿病が含まれます(Guo, 2024)。
- NF-κBの調節異常を伴う炎症性疾患には、痛風、喘息、急性腎障害、アテローム性動脈硬化症、心筋梗塞、COVID-19感染症などが挙げられます(Lawrence, 2009;Liu, 2017)。
NEMO欠損症候群
- NEMO欠損症候群は、主に外胚葉形成異常と免疫不全を特徴とするX連鎖遺伝性疾患であり、感染症への感受性を高めます。
- この疾患は、NEMOタンパク質をコードするIKBKG遺伝子の変異によって生じます。この変異により、NF-κBの活性化が増加します(Pescatore, 2022)。
NF-κBを標的とする潜在的な治療戦略にはどのようなものがありますか?
NF-κBシグナル伝達経路の異なる部位を標的とする様々な治療戦略が開発されてきました。NF-κBが抗腫瘍性と腫瘍促進性の両方の役割を持つという二重性は、その治療応用を複雑にしております(Xia, 2018)。
- IKK阻害剤(Yu, 2020;Guo, 2024;Li, 2024):
- アスピリン:COXおよびIKKβの阻害剤であり、様々な癌の動物モデルで使用されています。
- スルファサラジン:TLR4、MyD88、NF-κB p65タンパク質の発現を阻害する抗生物質であり、骨転移予防を目的とした生体内モデルで使用されています。
- デキサメタゾン:NF-κBのRelAサブユニットを阻害するグルココルチコイドです。
- 抗腫瘍薬:サリドマイドおよびレナリドマイドはNF-κBの活性化を阻害し、肺癌、白血病、多発性骨髄腫の治療において有望性を示しています。
- モノクローナル抗体(Yu, 2020;Guo, 2024):
- プロテアソーム阻害剤(Rasmi, 2020;Guo, 2024;Li, 2024):
- ボルテゾミブ、カルフィルゾミブ、イクサゾミブ:IκBαの分解を阻害し、NF-κB活性を抑制します。これらは多発性骨髄腫、びまん性大細胞型B細胞リンパ腫、非小細胞肺癌の治療薬としてFDA承認されています。
- 核移行阻害剤(Sivamaruthi, 2023;Guo, 2024):
- タクロリムス:免疫抑制剤です。活性化T細胞核因子の活性化を阻害し、それによりNF-κBの活性化を抑制します。
- IκBαスーパーリプレッサー:NF-κBの持続的抑制を実現します。
- SN50ペプチドは、核移行を担うタンパク質複合体と競合することでNF-κBを阻害します。
- NF-κBおよびNLRP3炎症小体を標的とするナノリゴマーは、その転写と翻訳を阻害します。これにより、アルツハイマー病マウスモデルにおいて神経炎症の減少と認知機能の改善が認められました(Wahl, 2024)。
- リソース「NLRP3 インフラマソームと神経変性疾患」をご参照ください。
NF-κB阻害剤として明示的に開発されていない一部の薬剤が、NF-κBの活性化を阻害することが確認されています(Roberti, 2022):
多発性硬化症(MS)において:
- メシル酸イマチニブ:各種チロシンキナーゼを阻害し、IκBのリン酸化も抑制します。現在、多発性硬化症を対象とした第II相臨床試験が進行中です(Barnthaler, 2019)。
- トポテカン:IKKβを阻害し、EAEマウスモデルにおける炎症を軽減します(Roberti, 2022)。
アルツハイマー病において:
- アログリプチン:血糖降下薬であり、in vitro で TLR4/MyD88/NF-κB経路を調節することが可能です( El-Sahar, 2021)。
- テルミサルタン:高血圧治療薬であり、IL-1βの減少を介して間接的にNF-κB活性を低下させる可能性があります(Sivamaruthi, 2023)。
脳卒中において:
- モダフィニル:NF-κBを阻害し抗炎症作用を発揮、虚血性海馬における神経細胞変性を軽減します(Xu, 2024)。
- アトルバスタチン:HMGB1によるNF-κB活性化を阻害することで神経学的欠損を改善します(Xu, 2024)。
このように、NF-κBシグナル伝達経路を標的とすることは、神経疾患、がん、自己免疫疾患を含む様々な疾患に対する治療戦略を開発する上で有望なアプローチとなります。NF-κBの役割を包括的に理解することは、これらの戦略を最適化し、様々な疾患状況における治療成果を向上させるために不可欠です。
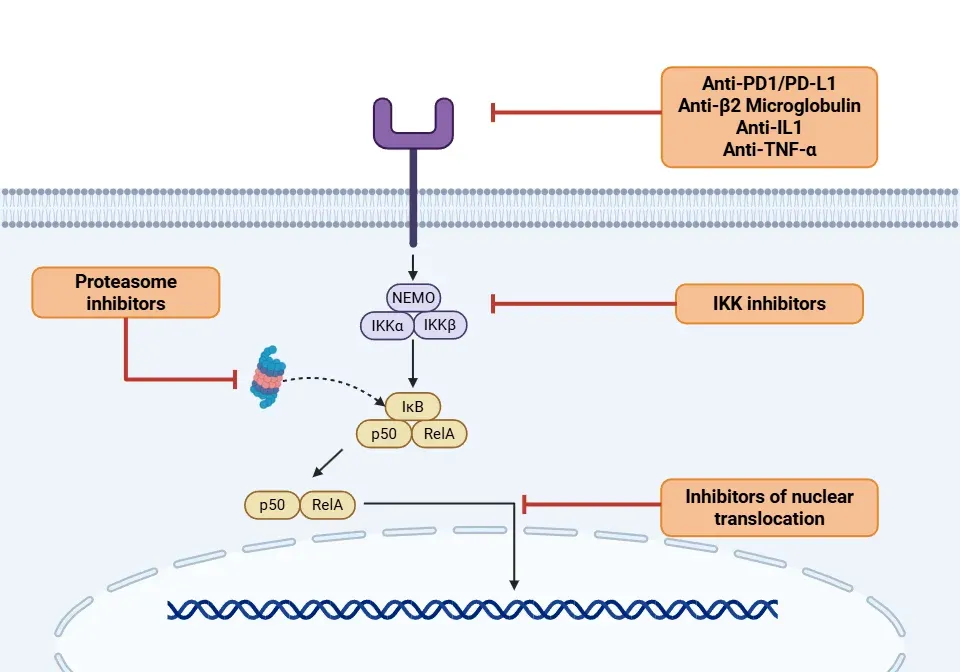
NF-κB療法の作用機序を、そのシグナル伝達経路を通じてご説明いたします。
核因子カッパBに関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報について、当チームが喜んでご回答いたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。
インターロイキン-1ベータ(IL-1β)と神経変性疾患
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患におけるIL-1βの役割。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。
神経変性疾患におけるTNF-αとアストロサイト
アストロサイトにおけるTNF-αシグナル伝達の概要、神経変性におけるその役割、およびこの経路を標的とする治療戦略について。
インフラマソームとは何ですか?
炎症小体(インフlammasome)の概要:その作用機序、疾患における役割、および薬物開発における標的化について。
ピロプトーシスとは何でしょうか?
ピロプトーシスの概要、各種疾患におけるその役割、およびピロプトーシス経路に関連する治療戦略について。