Quel est le rôle du NF-κB ?
Le NF-κB (facteur nucléaire kappa-chaîne légère-activateur des cellules B activées) est défini comme un groupe de protéines qui fonctionnent comme des facteurs de transcription, jouant un rôle crucial dans la régulation de l'expression des gènes associés à diverses fonctions cellulaires, notamment :
- La réponse immunitaire innée et adaptative et l'inflammation, y compris la régulation des inflammasomes (Oeckinghaus, 2009; Liu, 2017).
- La prolifération cellulaire, la survie cellulaire (anti-apoptose), le métabolisme, les réponses au stress cellulaire et la plasticité synaptique (Oeckinghaus, 2009; Albensi, 2019; Capece, 2022).
La famille des facteurs de transcription NF-κB comprend NF-κB1 (p105/p50), NF-κB2 (p100/p52), RELA (p65), RELB et c-REL (Barnabei, 2021; Capece, 2022; Guo, 2024). NF-κB joue différents rôles selon le type de cellule immunitaire impliquée (Zinatizadeh, 2021; Anilkumar, 2024; Guo, 2024) :
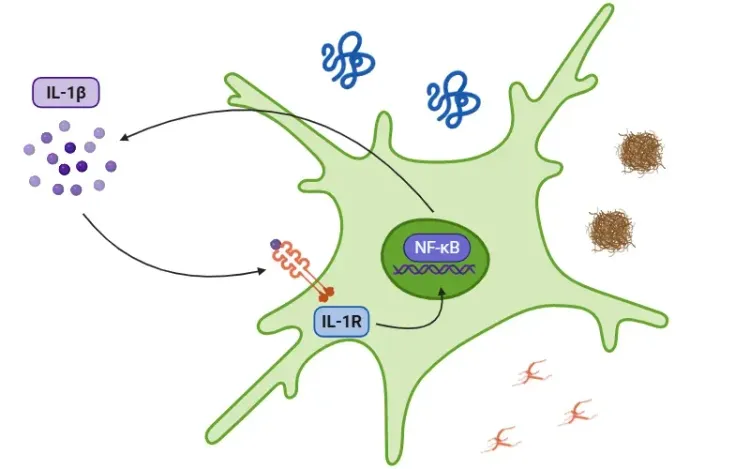
- Macrophages et cellules dendritiques : NF-κB favorise l'inflammation par la libération de cytokines telles que TNFα, IL-1β, IL-6, IL-12 et COX-2
- Pour plus d'informations sur les cytokines dans la neuroinflammation, veuillez consulter nos ressources : «Qu'est-ce que l'IL-1β ?»,« L'IL-1β et les maladiesneurodégénératives», «Le TNF-αet les microglies dans les maladies neurodégénératives » et «Le TNF-alpha et les astrocytes dans les maladies neurodégénératives ».
- Pour plus d'informations sur les cytokines dans la neuroinflammation, veuillez consulter nos ressources : «Qu'est-ce que l'IL-1β ?»,« L'IL-1β et les maladiesneurodégénératives», «Le TNF-αet les microglies dans les maladies neurodégénératives » et «Le TNF-alpha et les astrocytes dans les maladies neurodégénératives ».
- Cellules T : NF-κB stimule la production de cytokines, principalement l'IL-2, qui est essentielle à la prolifération et à la différenciation des cellules T en sous-types tels que Th1, Th2, Th17 et Treg.
- Cellules B : NF-κB facilite la prolifération, la survie et la différenciation des cellules B.
Voie de signalisation NF-κB
- En général, NF-κB est lié à une protéine inhibitrice appelée IκB (qui comprend p100, p105, IκBα et IκBβ) afin de le maintenir inactif dans le cytoplasme.
- La famille des I-kappaB kinases (IKK) active NF-κB, qui se transloque ensuite vers le noyau, où il favorise l'expression génique.
Il existe deux voies de signalisation principales :
- Voie canonique (Oeckinghaus, 2009; Liu, 2017; Capece, 2022)
- L'activation se produit par le biais de signaux pro-inflammatoires, notamment les cytokines (g. TNFα, IL-1β), les produits bactériens et viraux, les espèces réactives de l'oxygène (ROS) et les rayonnements, entre autres. Les principaux récepteurs impliqués sont le récepteur de l'interleukine-1 (IL-1R), les récepteurs Toll-like (TLR), les récepteurs du TNF (TNFR), les récepteurs des cellules T (TCR) et les récepteurs des cellules B (BCR).
- Chaque signal possède un mécanisme distinct pour activer le complexe IKK par le biais de différents facteurs associés aux récepteurs du facteur de nécrose tumorale (TRAF).
- Dans l'ensemble, la cascade active la kinase 1 activée par le facteur de croissance transformant β (TAK1), qui à son tour active le complexe IKK (IKKα et IKKβ) et sa kinase associée, NEMO (également connue sous le nom d'IKKγ).
- L'IKK activé phosphoryle l'IκB (principalement l'IκBα) et permet la translocation du NF-κB dans le noyau.
- Dans le noyau, les dimères NF-κB se lient aux séquences d'ADN κB qui favorisent la transcription génétique pour :
- Les cytokines pro-inflammatoires telles que l'IL-1β, l'IL-6 et le TNFα, afin d'amplifier davantage la réponse inflammatoire.
- Les chimiokines afin d'attirer d'autres cellules immunitaires.
- Des molécules d'adhésion afin d'attirer les leucocytes vers les tissus enflammés.
- D'autres médiateurs inflammatoires tels que la COX-2 et l'iNOS.
- L'activation se produit par le biais de signaux pro-inflammatoires, notamment les cytokines (g. TNFα, IL-1β), les produits bactériens et viraux, les espèces réactives de l'oxygène (ROS) et les rayonnements, entre autres. Les principaux récepteurs impliqués sont le récepteur de l'interleukine-1 (IL-1R), les récepteurs Toll-like (TLR), les récepteurs du TNF (TNFR), les récepteurs des cellules T (TCR) et les récepteurs des cellules B (BCR).
- Voie non canonique (Lawrence, 2009; Oeckinghaus, 2009; Liu, 2017)
- L'activation de cette voie est plus lente que celle de la voie canonique.
-
- Des récepteurs spécifiques de la superfamille TNF déclenchent cette voie, notamment le récepteur du facteur d'activation des lymphocytes B (BAFF-R), le CD40, le récepteur de la lymphotoxine β (LTβR) et l'activateur du récepteur NF-κB (RANK).
- L'activation de ces récepteurs recrute différents types de membres TRAF pour activer la kinase inductrice de NF-κB (NIK).
- L'activation subséquente de NIK conduit à la phosphorylation des homodimères IKKα.
- La NIK et l'IKKα phosphorylent la p100 (protéine précurseur du NF-κB2), la convertissant en une forme active appelée p52.
- P52 forme le dimère p52/RelB et se transloque vers le noyau pour favoriser la transcription génétique, régulant la survie des cellules immunitaires, la communication, le développement et la maturation des cellules T et B.
- Des récepteurs spécifiques de la superfamille TNF déclenchent cette voie, notamment le récepteur du facteur d'activation des lymphocytes B (BAFF-R), le CD40, le récepteur de la lymphotoxine β (LTβR) et l'activateur du récepteur NF-κB (RANK).
Étant donné que de nombreuses molécules de signalisation sont activées à la fois dans les voies canoniques et non canoniques, il existe une interaction directe et indirecte avec d'autres voies de signalisation importantes, telles que PI3K/AKT, MAPK, JAK-STAT et TGF-β (Guo, 2024).
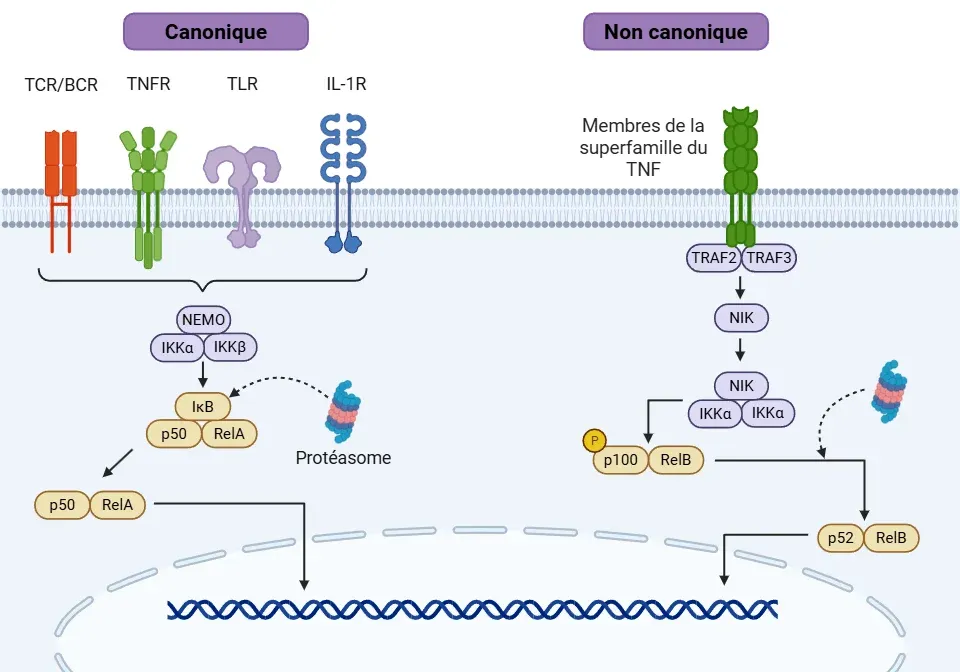
Signalisation NF-κB par les voies canoniques et non canoniques.
Quelles sont les implications d'une dérégulation du NF-κB dans la maladie ?
Le rôle du NF-κB est complexe et dépend du contexte, et il peut être considéré comme bénéfique ou néfaste (Albensi, 2019). Si le NF-κB est essentiel à l'homéostasie, des problèmes de régulation du NF-κB sont associés à diverses maladies, notamment des maladies neurologiques, des cancers, des maladies inflammatoires et des maladies auto-immunes.
Maladies neurologiques
Dans des conditions physiologiques, l'activité du NF-κB dans les neurones est nécessaire au fonctionnement normal des neurones, notamment à la neurogenèse, à la neuritogenèse et à la plasticité synaptique (Shih, 2015).
- Dans les neurones, NF-κB favorise généralement la survie en induisant des gènes anti-apoptotiques, tels que Bcl-2, Bcl-XL et la superoxyde dismutase manganèse (Anilkumar, 2024).
- Dans les microglies, l'activation du NF-κB déclenche des réponses pro-inflammatoires, conduisant à la libération de cytokines (TNF-α, IL-1β, IL-6, IFN-γ) et de ROS (Shih, 2015; Anilkumar, 2024)
- Veuillez vous référer à notre ressource «TNF-α et microglies dans les maladies neurodégénératives ».
- Veuillez vous référer à notre ressource «TNF-α et microglies dans les maladies neurodégénératives ».
- Dans les astrocytes, l'activation du NF-κB est nécessaire à la différenciation astrocytaire et augmente la réponse inflammatoire (Anilkumar, 2024)
- Veuillez consulter notre ressource «TNF-α et astrocytes dans les maladies neurodégénératives ».
Cependant, une activation dérégulée de NF-κB contribue à des conditions pathologiques :
- Sclérose en plaques (SP)
- Le NF-κB intervient dans la neuroinflammation par le biais de l'infiltration des macrophages, des microglies, des astrocytes et des cellules immunitaires périphériques.
- Le NF-κB est également nécessaire à la transition des lymphocytes T en Treg, favorisant ainsi les actions pathogènes des lymphocytes T inflammatoires (Guo, 2024).
- Dans l'encéphalomyélite auto-immune expérimentale (EAE), l'activation de NF-κB déclenche une neuroinflammation. Il est intéressant de noter que la suppression spécifique de l'IKKβ dans les cellules myéloïdes empêche l'induction de l'EAE, ce qui est associé à une diminution de la production de cellules inflammatoires Th1 et Th17 (Liu, 2017).
- Le NF-κB intervient dans la neuroinflammation par le biais de l'infiltration des macrophages, des microglies, des astrocytes et des cellules immunitaires périphériques.
- Maladie d'Alzheimer (MA) et maladie de Parkinson (MP)
- Dans ces maladies, l'activation microgliale de NF-κB favorise la libération supplémentaire de cytokines pro-inflammatoires via les microglies et les astrocytes réactifs, entraînant une neurotoxicité et contribuant à la neurodégénérescence (Guo, 2024).
- Cependant, dans les modèles murins de MA, il a été démontré que l'inhibition de NF-κB accélère l'accumulation de bêta-amyloïde (Aβ) et de tau, ce qui suggère que NF-κB pourrait également jouer un rôle protecteur aux stades précoces de la maladie (Jong Huat, 2024)
- Veuillez vous référer à nos ressources : «APOE4, microglies et maladie d'Alzheimer », «Microglies, astrocytes et protéine tau dans les troubles neurodégénératifs » et «Microglies, astrocytes et alpha-synucléine dans la maladie de Parkinson ».
- Veuillez vous référer à nos ressources : «APOE4, microglies et maladie d'Alzheimer », «Microglies, astrocytes et protéine tau dans les troubles neurodégénératifs » et «Microglies, astrocytes et alpha-synucléine dans la maladie de Parkinson ».
- Traumatisme crânien et lésion médullaire
- Le NF-κB joue un rôle dans la réponse inflammatoire après l'événement aigu, contribuant ainsi à des lésions secondaires (Guo, 2024).
- Dans ces maladies, l'activation microgliale de NF-κB favorise la libération supplémentaire de cytokines pro-inflammatoires via les microglies et les astrocytes réactifs, entraînant une neurotoxicité et contribuant à la neurodégénérescence (Guo, 2024).
Cancer
- Le NF-κB peut favoriser la tumorigenèse principalement par l'activation anormale de la voie non canonique. Les mécanismes diffèrent selon le type de cancer. En général, les mécanismes comprennent les éléments suivants (Aggarwal, 2011; Xia, 2014)
- Promotion de la survie et de la prolifération cellulaires : NF-κB contribue à la division incontrôlée des cellules cancéreuses en renforçant l'expression des cyclines D1 et E, ainsi que de c-Myc, tout en inhibant l'apoptose par le biais de facteurs tels que Bcl-2, Bcl-XL et IAP (Brown, 2008; Rinkenbaugh, 2016)
- Pour plus d'informations sur la pyroptose, l'apoptose et la nécroptose, veuillez vous référer à la ressource «Qu'est-ce que la pyroptose ? ».
- Pour plus d'informations sur la pyroptose, l'apoptose et la nécroptose, veuillez vous référer à la ressource «Qu'est-ce que la pyroptose ? ».
- Promotion de l'angiogenèse : NF-κB facilite la formation de nouveaux vaisseaux sanguins grâce à des facteurs pro-angiogéniques tels que le VEGF, le FGF, le PDGF et l'IL-8, et déclenche la transition épithélio-mésenchymateuse, qui favorise la croissance tumorale et les métastases (Brown, 2008; Park, 2016).
- Évasion immunitaire : NF-κB contribue au développement d'un microenvironnement tumoral immunosuppressif via TGF-β (Rinkenbaugh, 2016; Guo, 2024).
- Reprogrammation métabolique : NF-κB modifie les voies métaboliques, entraînant une augmentation de la demande en azote et une phosphorylation oxydative mitochondriale anormale (Guo, 2024).
- Promotion de la survie et de la prolifération cellulaires : NF-κB contribue à la division incontrôlée des cellules cancéreuses en renforçant l'expression des cyclines D1 et E, ainsi que de c-Myc, tout en inhibant l'apoptose par le biais de facteurs tels que Bcl-2, Bcl-XL et IAP (Brown, 2008; Rinkenbaugh, 2016)
- Les mutations directes activant NF-κB sont courantes dans les cancers du sang. Par exemple, l'amplification de c-Rel se produit dans les lymphomes non hodgkiniens d'origine B, et NF-κB2/p100 est fréquemment activé par des translocations chromosomiques (Xia, 2014).
- Une régulation anormale de NF-κB a été identifiée dans divers types de cancer, notamment les carcinomes épidermoïdes, le cancer du sein, le cancer du poumon et le cancer colorectal (Brown, 2008).
Maladies auto-immunes et inflammatoires
- Polyarthrite rhumatoïde (PR) : NF-κB perpétue l'inflammation chronique et a été détecté dans le liquide synovial de patients atteints de PR. Il favorise la production de cytokines inflammatoires (IFN-gamma, IL-15, IL-17, IL-18) dans les cellules T des articulations et la différenciation des ostéoclastes responsables de la résorption osseuse (Liu, 2017; Guo, 2024).
- Maladie inflammatoire chronique de l'intestin (MICI) : cette affection est associée à des mutations génétiques du NF-κB, qui ont été identifiées dans des maladies telles que la maladie de Crohn et la colite ulcéreuse. Chez les patients atteints de MICI, l'activation du NF-κB a été observée dans leurs tissus coliques (Liu, 2017).
- D'autres maladies auto-immunes associées à une dérégulation de NF-κB comprennent le lupus érythémateux disséminé et le diabète de type 1 (Guo, 2024).
- Les maladies inflammatoires associées à une dérégulation du NF-κB comprennent la goutte, l'asthme, les lésions rénales aiguës, l'athérosclérose, l'infarctus du myocarde et l'infection par la COVID-19 (Lawrence, 2009; Liu, 2017).
Syndrome de déficit en NEMO
- Le syndrome de déficit en NEMO est une maladie génétique liée au chromosome X qui se caractérise principalement par une dysplasie ectodermique et un déficit immunitaire, ce qui augmente la sensibilité aux infections.
- Cette affection résulte d'une mutation du gène IKBKG, qui code pour la protéine NEMO. La mutation entraîne une activation accrue de NF-κB (Pescatore, 2022).
Quelles stratégies thérapeutiques potentielles ciblent NF-κB ?
Diverses stratégies thérapeutiques ont été développées pour cibler la voie de signalisation NF-κB à différents niveaux. Le double rôle de NF-κB, à la fois antitumoral et pro-tumoral, complique ses applications thérapeutiques (Xia, 2018).
- Inhibiteurs de l'IKK (Yu, 2020; Guo, 2024; Li, 2024)
- Aspirine : inhibiteur de la COX et de l'IKKβ, utilisé dans des modèles animaux pour divers cancers.
- Sulfasalazine : antibiotique qui inhibe l'expression des protéines TLR4, MyD88 et NF-κB p65, utilisé dans des modèles in vivo pour prévenir les métastases osseuses.
- Dexaméthasone : glucocorticoïde qui inhibe la sous-unité RelA de NF-κB.
- Médicaments antitumoraux : la thalidomide et la lénalidomide inhibent l'activation de NF-κB et présentent un potentiel dans le traitement du cancer du poumon, de la leucémie et du myélome multiple.
- Anticorps monoclonaux (Yu, 2020; Guo, 2024)
- Anti-PD1/PD-L1 : comprend le pembrolizumab, l'atezolizumab, l'avelumab, le durvalumab et le nivolumab.
- Anticorps monoclonaux anti-β2-microglobuline : visent à réduire l'activité du NF-κB et font actuellement l'objet d'études dans le cadre du traitement du myélome multiple.
- Anti-IL1: l'anakinra, le rilonacept et le canakinumab inhibent l'activation du NF-κB via l'IL-1R dans les maladies auto-immunes, telles que le CAPS.
- Anti-TNFα : l'adalimumab, l'infliximab et l'étanercept inhibent l'activation du NF-κB et sont utilisés dans différents types de cancer.
- Inhibiteurs du protéasome (Rasmi, 2020; Guo, 2024; Li, 2024)
- Bortezomib, carfilzomib, ixazomib : inhibent la dégradation de IκBα et suppriment l'activité du NF-κB. Ils sont approuvés par la FDA pour le traitement du myélome multiple, du lymphome diffus à grandes cellules B et du cancer du poumon non à petites cellules.
- Bortezomib, carfilzomib, ixazomib : inhibent la dégradation de IκBα et suppriment l'activité du NF-κB. Ils sont approuvés par la FDA pour le traitement du myélome multiple, du lymphome diffus à grandes cellules B et du cancer du poumon non à petites cellules.
- Inhibiteurs de la translocation nucléaire (Sivamaruthi, 2023; Guo, 2024)
- Tacrolimus : agent immunosuppresseur. Il bloque l'activation du facteur nucléaire des cellules T activées, inhibant ainsi l'activation de NF-κB.
- Super-répresseur IκB&alpha ; : suppression continue de NF-&kappaB.
- Le peptide SN50 inhibe NF-κB en entrant en compétition avec les complexes protéiques responsables de la translocation nucléaire.
- Nanoligomère ciblant NF-κB et l'inflammasome NLRP3, inhibant sa transcription et sa traduction. Cela a entraîné une diminution de la neuroinflammation et une amélioration des fonctions cognitives chez des modèles murins de la MA (Wahl, 2024)
- Veuillez vous référer à notre ressource «Inflammasome NLRP3 et maladies neurodégénératives ».
- Tacrolimus : agent immunosuppresseur. Il bloque l'activation du facteur nucléaire des cellules T activées, inhibant ainsi l'activation de NF-κB.
Il a été démontré que certains médicaments qui n'ont pas été explicitement développés comme inhibiteurs de NF-κB interfèrent avec l'activation de NF-κB (Roberti, 2022) :
Dans la sclérose en plaques :
- Mésylate d'imatinib : inhibe diverses tyrosine kinases et inhibe également la phosphorylation de IκB, actuellement en phase 2 d'essais cliniques pour la SEP (Barnthaler, 2019).
- Topotécan : inhibe l'IKKβ, réduisant l'inflammation dans les modèles murins d'EAE (Roberti, 2022).
Dans la maladie d'Alzheimer :
- Alogliptine : médicament hypoglycémiant capable de moduler la voie TLR4/MyD88/NF-κB in vitro ( El-Sahar, 2021).
- Telmisartan : médicament contre l'hypertension artérielle qui peut réduire indirectement l'activité NF-κB via la réduction de l'IL-1β (Sivamaruthi, 2023).
Dans le cas d'un accident vasculaire cérébral :
- Modafinil : inhibe NF-κB et a des effets anti-inflammatoires, réduisant la dégénérescence neuronale dans l'hippocampe ischémique (Xu, 2024).
- Atorvastatine : améliore les déficits neurologiques en inhibant l'activation de NF-κB induite par HMGB1 (Xu, 2024).
Cibler la voie de signalisation NF-κB représente donc une approche prometteuse pour développer des stratégies thérapeutiques pour diverses maladies, notamment les maladies neurologiques, le cancer et les maladies auto-immunes. Une compréhension approfondie des rôles de NF-κB est essentielle pour optimiser ces stratégies et améliorer les résultats des traitements dans divers contextes pathologiques.
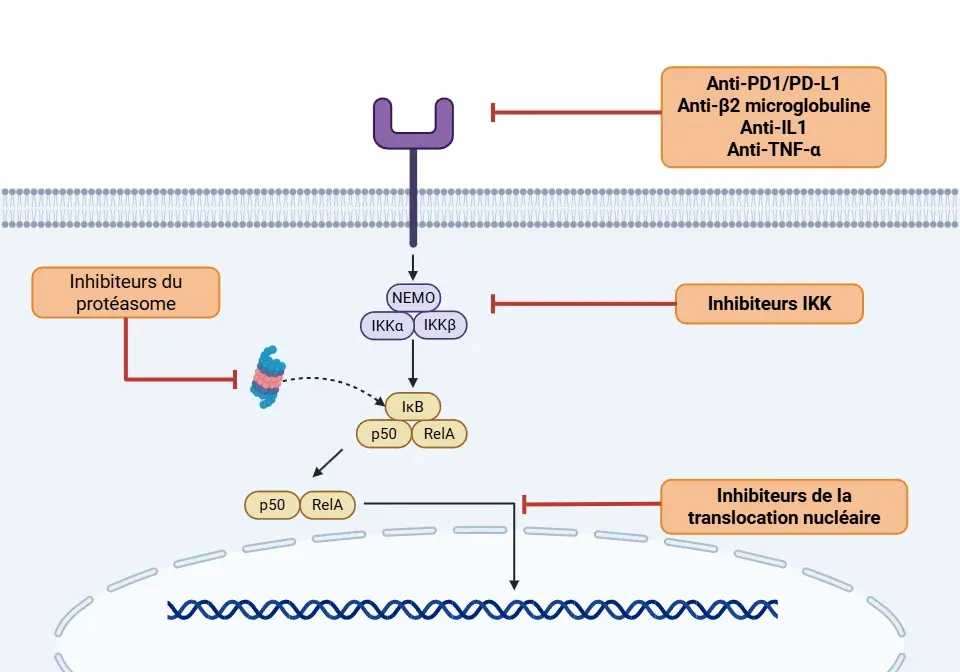
Le mécanisme d'action des thérapies NF-κB illustré à travers sa voie de signalisation.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant le facteur nucléaire kappa B ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Qu'est-ce que l'IL-1β?
Présentation générale de l'IL-1β, de son rôle pro-inflammatoire dans les maladies systémiques et neurologiques, et des stratégies thérapeutiques impliquant l'antagonisme de l'IL-1β.
Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
Le rôle de l'IL-1bêta dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA), la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA).
TNF-α et microglie dans les maladies neurodégénératives
Un aperçu de la fonction du facteur de nécrose tumorale alpha (TNF-α) dans la microglie et de sa contribution à la progression de la neurodégénérescence.
Le TNF-α et les astrocytes dans les maladies neurodégénératives
Présentation générale de la signalisation du TNF-α dans les astrocytes, de son rôle dans la neurodégénérescence et des stratégies thérapeutiques ciblant cette voie.
Qu'est-ce qu'un inflammasome?
Présentation générale des inflammasomes, notamment leurs mécanismes d'action, leur rôle dans les maladies et leur ciblage pour le développement de médicaments.
Qu'est-ce que la pyroptose ?
Présentation de la pyroptose, de son rôle dans diverses maladies et des stratégies thérapeutiques liées aux voies de la pyroptose.