什么是IL-1β?
白细胞介素-1β(IL-1β或IL-1β)是白细胞介素-1超家族中的一种促炎性细胞因子,主要由单核细胞、巨噬细胞和中性粒细胞产生,在多种组织中浓度较高。它在宿主防御、炎症反应、发热诱导、免疫细胞活化和脑功能中发挥着关键作用。在中枢神经系统(CNS)的生理条件下,IL-1β促进神经元增殖、分化、凋亡及长时程增强。IL-1β在损伤相关分子模式(DAMPs)和病原相关分子模式(PAMPs)刺激下分泌,通过激活NLRP3炎症小体及多种激酶(包括TNF-α和IL-18)等机制,促进炎症反应(Lopez-Castejon, 2011;Kaneko, 2019)。
IL-1β水平升高可导致过度炎症,通过促进炎症和帮助肿瘤细胞逃避免疫系统,参与痛风、骨关节炎和癌症等疾病的发生。在神经退行性疾病中,IL-1β参与神经炎症,特别是通过NLRP3炎症小体,与阿尔茨海默病(AD)和帕金森病(PD)等神经退行性疾病相关。
如需更详细的IL-1β概述,请参阅我们的资源“什么是IL-1β?”。
IL-1β在阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)中的作用是什么?
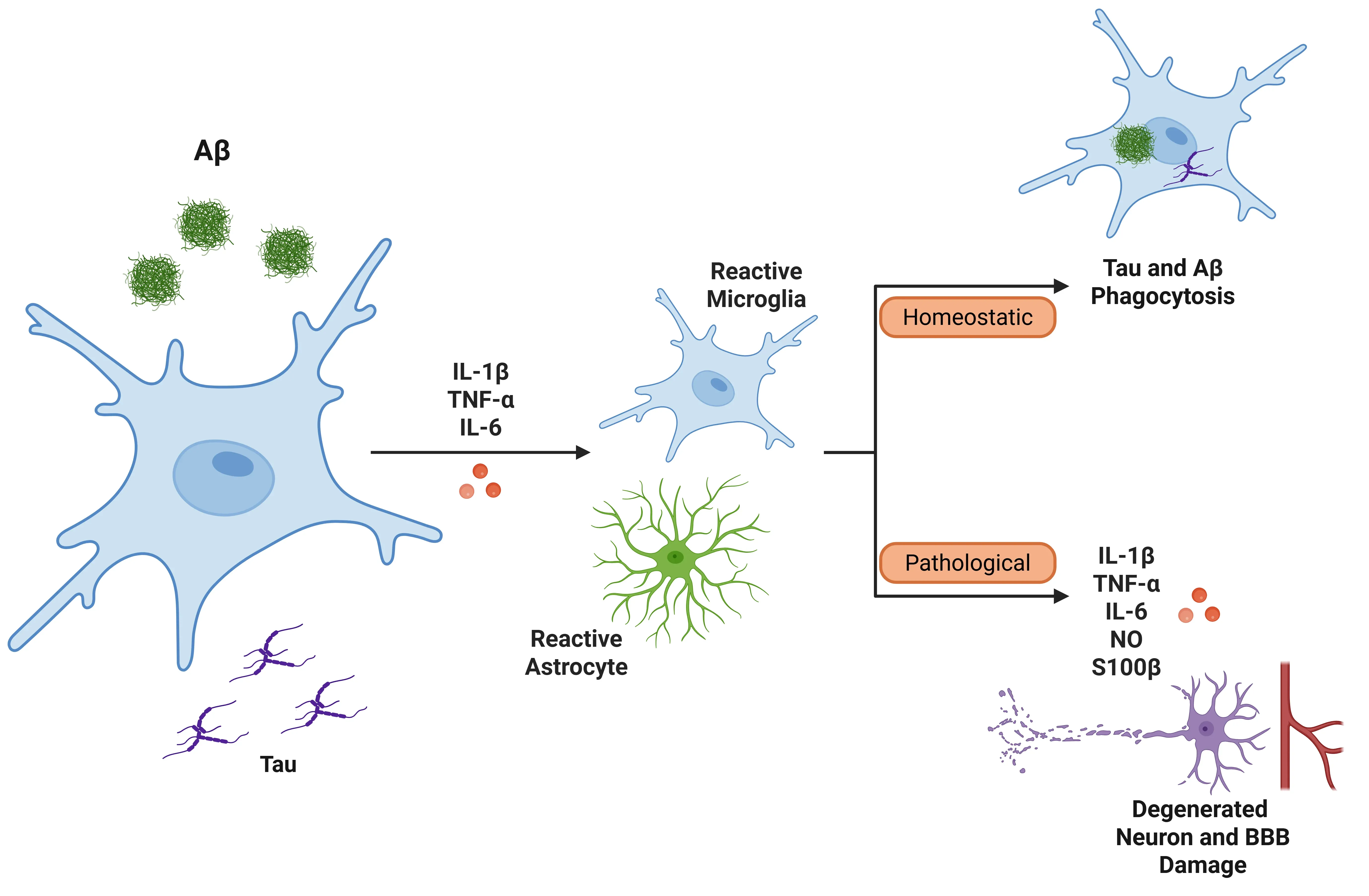
小胶质细胞和星形胶质细胞是中枢神经系统(CNS)中两种重要的胶质细胞类型,有助于维持神经系统的稳态。这两种细胞在脑免疫反应中发挥着关键作用,是神经炎症的重要贡献者,常出现在神经退行性疾病中:
- 小胶质细胞可在促炎条件下分泌IL-1β。具体而言,与疾病相关的小胶质细胞(DAMs)在神经退行性疾病中可具有保护性和有害作用。最初,它们通过吞噬作用清除神经毒性聚集物来保护神经元。然而,DAMs 也会释放促炎细胞因子,如 IL-1β 和 TNF-α,这些因子可能加剧慢性炎症和神经退行性变。DAM-样小胶质细胞已在多种神经退行性疾病中被识别,包括tau病、AD、PD 和 ALS。
- 星形胶质细胞在促炎条件下也可分泌IL-1β。部分反应性星形胶质细胞可形成胶质瘢痕作为保护机制,作为屏障防止进一步损伤和感染扩散。然而,反应性星形胶质细胞也可产生促炎性细胞因子,加剧神经元损伤。
小胶质细胞和星形胶质细胞在神经退行性疾病中的详细作用在题为《小胶质细胞、星形胶质细胞与tau在神经退行性疾病中的作用》和《小胶质细胞、星形胶质细胞与α-突触核蛋白在帕金森病中的作用》的资源中进行了讨论。
阿尔茨海默病(
)阿尔茨海默病是目前最常见的痴呆症类型,其特征为脑内蛋白质异常堆积,表现为淀粉样斑块和神经原纤维缠结。IL-1β在阿尔茨海默病病理过程中扮演关键角色,其作用机制复杂,既可调节淀粉样β蛋白病理,又可影响tau蛋白病理。其功能具有双面性(Shaftel, 2008;Matousek, 2012;Boraschi, 2023)。在负面作用方面,IL-1β由NLRP3炎症小体产生,导致与AD相关的脑炎和神经元损伤(Lopez-Rodriguez, 2021;Boraschi, 2023)。
其他细胞因子也参与了AD发病机制中的炎症过程。AD患者外周血中IL-6、IL-12、IL-18、TNF-α和TGF-β的水平显著升高(Xu, 2024)。遗传因素也参与了该疾病的发病机制。与AD风险增加相关的IL-1基因特异性多态性包括(Mrak,2001):
- IL-1A 2 (-889):该变异与IL-1α表达水平升高相关。
- IL-1B 2(外显子5):该变异与IL-1β表达水平升高相关。
IL-1β可在AD背景下激活小胶质细胞和星形胶质细胞(Ghosh, 2013)。当IL-1β释放时,它会诱导其他促炎细胞因子(如TNF-α和IL-6)的表达,进一步放大炎症反应。
- 小胶质细胞:小胶质细胞最初可通过清除β淀粉样蛋白协助对抗AD;但慢性激活会压倒该系统,导致神经炎症。这种激活形成反馈循环,小胶质细胞释放更多IL-1β及额外炎症介质,最终阻碍β淀粉样蛋白清除并损伤血脑屏障(BBB)(Shaftel, 2008;Valiukas, 2025)。
- 星形胶质细胞:星形胶质细胞在β-淀粉样蛋白的预处理下,可对IL-1β产生过度反应,进一步加剧炎症。IL-1β诱导的一氧化氮释放也可能导致神经毒性。特别是那些过度表达IL-1β的细胞,可释放S100β,一种与神经元损伤和炎症过程加剧相关的蛋白质(Mrak, 2000;Sama, 2008)。
IL-1β参与tau病理过程,其通过激活小胶质细胞和MAPK信号通路刺激tau蛋白的过度磷酸化,这可能破坏微管稳定性并促进神经原纤维缠结的形成(Griffin, 2006;Shaftel, 2008;Ghosh, 2013)。此外,IL-1β与淀粉样β的产生和沉积相关。炎症细胞因子,包括IL-1β、IL-6和TGF-β,在AD患者脑内淀粉样斑块周围积累(Italiani, 2018)。IL-1β的过度表达与斑块形成增加及营养不良性神经突的生长相关(Mrak,2001)。
值得注意的是,尽管具有促炎作用,IL-1β可能还参与AD的保护机制。在一种IL-1β过表达的AD转基因小鼠模型中,持续的神经炎症导致星形胶质细胞和小胶质细胞活化,同时伴随促炎细胞因子的增加。在IL-1β过表达四周后,观察到淀粉样病理减少,提示小胶质细胞对淀粉样β的清除增强(Shaftel, 2007;Shaftel, 2008;Matousek, 2012)。
除IL-1β在脑内的直接作用外,外周系统性炎症也可影响并升高脑内IL-1β水平,从而潜在影响AD病理(Wang, 2023)。多项小鼠模型研究表明,系统性药物如脂多糖(LPS)可增加Aβ沉积并引发认知缺陷(Xie, 2021)。
由于IL-1β在AD中的作用,其已成为潜在生物标志物,但研究显示其在患者脑脊液(CSF)和脑组织中的水平存在不一致结果(Ng,2018;Scarabino,2020)。最终,需要进一步研究以阐明IL-1β、神经炎症与阿尔茨海默病各种病理特征之间的复杂关系。了解IL-1β影响tau病理和淀粉样蛋白清除的具体机制,可能为开发针对这一毁灭性疾病的靶向治疗方法铺平道路。
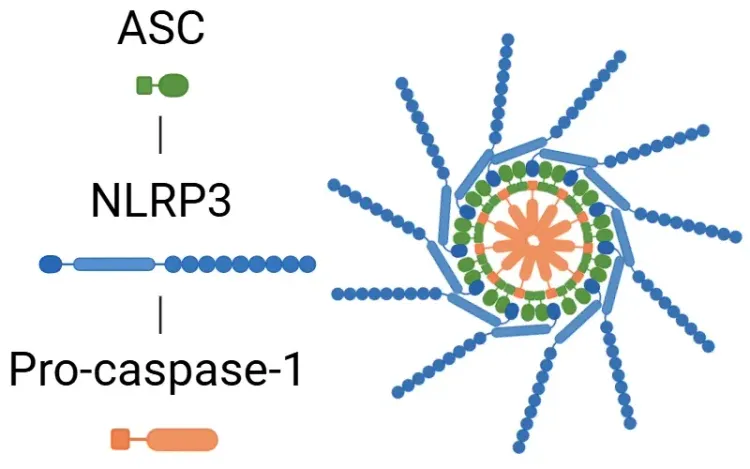
与炎症小体活化相关的代表性疾病。
炎症小体调节异常与多种疾病密切相关,包括神经退行性疾病、心血管疾病、自身免疫性疾病及代谢性疾病。图中列举了部分典型例子,但实际上还有许多其他疾病也涉及炎症小体通路。
帕金森病
PD 是一种神经退行性疾病,其特征为基底节区黑质中多巴胺能神经元的进行性退化。这种退化与神经元内 α-突触核蛋白的聚集密切相关。
促炎性细胞因子IL-1β在帕金森病的神经炎症和神经退行性变中发挥重要作用。其产生与小胶质细胞中NLRP3炎症小体的激活密切相关。异常折叠的α-突触核蛋白激活小胶质细胞的TLR2/TLR4信号通路,导致炎症小体组装、caspase-1激活,并促使前体IL-1β转化为其活性分泌形式(Koprich, 2008;Pott Godoy, 2008;Leal, 2013;Stojakovic, 2017;Tansey, 2022;Dzamko, 2023)。脑内多巴胺能区域、脑脊液及血液中检测到升高的IL-1β水平,与疾病严重程度及症状进展(包括认知障碍)呈正相关 (Dursun, 2015;Liu, 2022;Dzamko, 2023;Qu, 2023)。此外,其他促炎性细胞因子,如TNF-α、IFN-γ、IL-6、IL-2和IL-10,也被发现血浆中水平升高(Xu,2024)。
在帕金森病(PD)背景下,小胶质细胞是IL-1β的主要产生和分泌细胞:
- 慢性激活通过释放IL-1β、TNF-α、IL-6、活性氧(ROS)、一氧化氮和TGF-β,维持神经炎症,在黑质和纹状体中为多巴胺能神经元创造一个有毒环境(Leal, 2013;Tansey, 2022;Liu, 2022)。
- 在帕金森病动物模型中观察到小胶质细胞的强烈激活,包括向吞噬状态的转变,这促进了神经元损伤与炎症的恶性循环(Ferrari, 2006;Pott Godoy, 2008)。
- 基因突变,如LRRK2和PINK1,可增强小胶质细胞IL-1β的产生并加剧神经炎症(Liu, 2022)。
- 尽管小胶质细胞主导IL-1β的产生,但星形胶质细胞在炎症刺激下会上调包括IL-1β和IL-6在内的细胞因子,并可通过NF-κB依赖性通路增强小胶质细胞的反应。
- 星形胶质细胞的活化随慢性炎症加重而增加,参与星形胶质细胞增生、瘢痕形成及炎症微环境的调节。
- 星形胶质细胞与小胶质细胞的相互作用放大多巴胺毒性(Ferrari,2006;Leal,2013)。
总体而言,主要由小胶质细胞驱动并得到星形胶质细胞支持的IL-1β/炎症小体轴,会传播慢性神经炎症、多巴胺能神经元丧失及帕金森病症状进展(Leal, 2013;Tansey, 2022;Dzamko, 2023)。
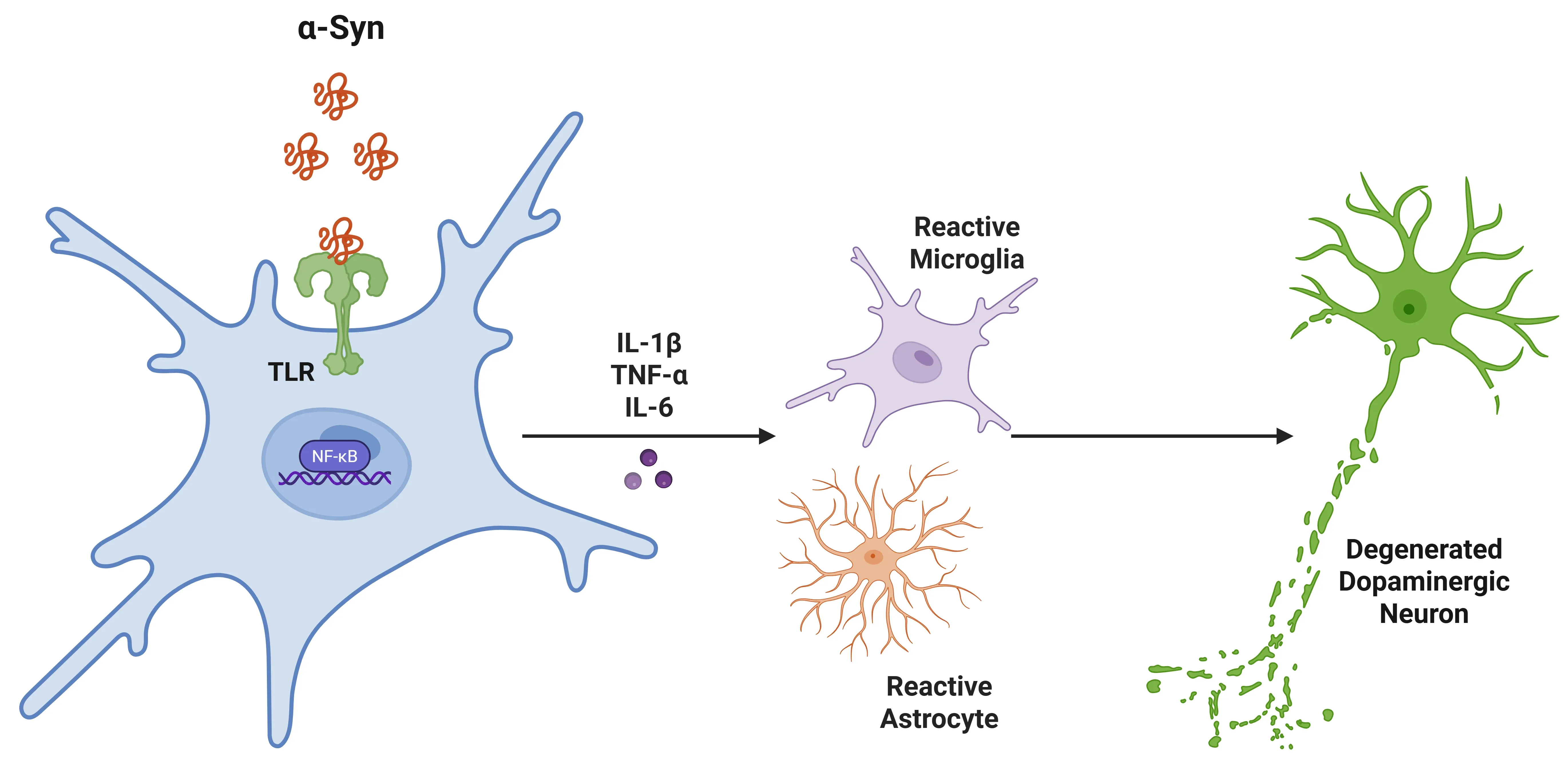
IL-1β在帕金森病(PD)中的作用。
α-突触核蛋白与小胶质细胞的 Toll 样受体(TLRs)结合,触发信号传导级联反应,激活 NF-κB。这导致促炎性细胞因子的增加,进而招募更多小胶质细胞和星形胶质细胞,促进炎症反应。最终,这导致黑质中多巴胺能神经元的退化。
肌萎缩侧索硬化症
促炎性细胞因子,如IL-1β、IL-6、IL-18和TNF-α,是ALS中神经炎症的介质。这些细胞因子的水平在ALS患者的脑脊液和血清中 以及ALS动物模型中均有升高(Xu, 2024)。
TDP-43和突变型SOD1(与家族性ALS相关)可被小胶质细胞摄取,激活含caspase-1的炎症小体,将前体IL-1β加工为活性形式IL-1β。这一过程触发神经毒性炎症级联反应,从而加速疾病进展(Fogal, 2008;Meissner, 2010;van der Meer, 2010;Italiani, 2014;Olesen, 2020;Garofalo, 2022)。星形胶质细胞通过采用反应性表型、调节炎症基因表达以及影响炎症微环境等方式参与神经炎症,尽管其直接参与IL-1β生成作用较弱(Meissner, 2010;Garofalo, 2022)。
脑脊液(CSF)和血清中IL-1β的水平与疾病更具侵袭性的形式相关,尤其是在特定遗传亚型如C9orf72 ALS中。相反,IL-1β的组织特异性效应在散发性ALS中更为明显(Italiani, 2014;Olesen, 2020)。ALS患者脑脊液的主成分分析表明,IL-1β是更广泛炎症标志物的一部分,其中包括IL-2、IL-6、IL-13、TNF-α等。
关于神经炎症是运动神经元退化的主要驱动因素还是次要后果,目前仍存在争议。这主要由于人类样本中IL-1β的检测变异性与动物模型存在差异,以及IL-1β的双重作用——其作用可根据上下文和时间点呈现神经毒性或神经保护性(Italiani, 2014;Boraschi, 2023;Femiano, 2024)。
总体而言,IL-1β及相关炎症分子通过神经毒性、氧化应激和突触功能障碍等机制增强神经元脆弱性,从而强调炎症在ALS进展中的作用。
在神经退行性疾病的治疗中,哪些治疗干预措施针对IL-1β?
IL-1β在多种神经退行性疾病相关的神经炎症中发挥关键作用。因此,IL-1β已成为减少神经炎症的靶点,主要通过使用IL-1受体拮抗剂(IL-1Ra)实现。主要的IL-1Ra选项包括:
- 阿那白滞素(Anakinra):这是一种人源化IL-1Ra,可抑制IL-1α和IL-1β的活性。
- Rilonacept:该药物将人IL-1R1和IL-1R3的细胞外片段与人IgG1的Fc片段结合,以长期抑制IL-1α和IL-1β。
- 卡那单抗(Canakinumab):这是一种人源化单克隆IgG1抗体,特异性靶向IL-1β。
- 在3xTg-AD小鼠中长期给予IL-1受体阻断抗体,已被证明可减少脑部炎症、缓解认知障碍并减轻tau病理,同时部分降低某些形式的β淀粉样蛋白。这些变化与NF-κB活性降低及磷酸化tau和tau激酶水平下降相关(Kitazawa, 2011)。
- 需要注意的是,IL-1β对淀粉样β的清除是必要的,这可能部分解释了用IL-1β阻断治疗AD时获得的混合结果(Rivera-Escalera, 2019)。
在不同大鼠帕金森病模型中:
- 外周给药的阿那白滞和AAV过表达IL-1Ra在减少多巴胺神经元变性和促炎细胞因子方面显示出潜力(Dzamko,2023)。
- 在暴露于6-羟基多巴胺后向黑质(SN)注射脂多糖(LPS)导致神经退行性变和运动症状加重,而IL-1Ra治疗可抑制这些效应(Koprich, 2008)。
在ALS动物模型中:
- 在SOD1转基因小鼠的临床前研究中,安akinra延长了生存期并改善了疾病活动期(active phase)的运动功能(van der Meer, 2010;Meissner, 2010)。
- 在ALS小鼠模型中阻断IL-1Ra也被证实可延长生存期,但不影响疾病发病时间(Maier, 2015)。
- 尽管阻断IL-1β可减轻神经炎症,但将这些发现应用于人类ALS面临挑战,原因包括中枢神经系统药物渗透不良及治疗中性抗体的快速产生。为有效到达中枢神经系统,需使用高剂量阿那白滞素(van der Meer, 2010;Maier, 2015)。
其他降低IL-1β水平和微胶细胞活化的治疗方法包括使用地塞米松(一种抗炎类固醇)和MCC950(一种NLRP3抑制剂)(Pott Godoy, 2008;Liu, 2022)。
综上所述,靶向IL-1β介导的炎症具有治疗潜力。然而,IL-1β的多效性功能(包括毒性和保护性作用)表明,泛抗IL-1β疗法可能效果有限。近期针对IL-1β的治疗方法,如Rilonacept和Canakinumab,仍在研究中,并有望成为未来神经退行性疾病治疗的新方向。
我们的团队非常乐意回答有关白细胞介素-1β(IL-1β)的任何问题,或提供有关我们用于疗效研究的神经退行性疾病模型的具体信息。
相关内容
关于白细胞介素-1β(IL-1β)的最新信息以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
什么是炎症小体?
概述炎性體,包括其作用機制、在疾病中的角色,以及藥物開發的目標。
什么是NLRP3?
NLRP3及NLRP3炎症小体激活的触发机制、疾病关联及治疗靶点策略综述。
什么是IL-1β?
白细胞介素-1β(IL-1β)的概述、其在全身性及神经系统疾病中的促炎作用,以及基于IL-1β拮抗作用的治疗策略。
NLRP3炎症小体与神经退行性疾病
NLRP3炎症小体及其在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症)中作用的概述。