小胶质细胞与星形胶质细胞在神经退行性疾病中的相互作用机制是什么?
小胶质细胞和星形胶质细胞是中枢神经系统(CNS)中两种关键的胶质细胞类型,在维持稳态和应对损伤方面发挥着至关重要的作用。这两种细胞类型均参与大脑的免疫反应,并在神经炎症中扮演关键角色,而神经炎症是神经退行性疾病的常见特征。
小胶质细胞
小胶质细胞是中枢神经系统的主要免疫细胞,起源于卵黄囊巨噬细胞,与外周免疫细胞不同(Ginhoux, 2010;Leavy, 2010)。它们具有高度动态性,通过其特异性受体谱系持续监测脑微环境(Qin, 2023)。小胶质细胞在吞噬作用、突触修剪以及分泌调节神经元功能的信号分子方面发挥关键作用(Gao, 2023)。
近期研究揭示了小胶质细胞存在多种状态,超越了传统M1(促炎性)和M2(抗炎性)的二元分类。实际上,小胶质细胞展现出功能表型谱系,其状态受环境信号、遗传因素及疾病进展影响而动态变化。例如,在阿尔茨海默病(AD)中,与疾病相关的微胶细胞(DAM)定位于淀粉样斑块附近,并参与清除淀粉样-β聚集物(Keren-Shaul, 2017;Gao, 2023)。相反,小胶质细胞的持续激活会导致细胞因子过度产生,损害突触功能并加剧神经元损伤(Kwon, 2020)。小胶质细胞还会释放外泌体,通过传播异常折叠蛋白(如AD中的tau和β-淀粉样蛋白,以及帕金森病(PD)中的α-突触核蛋白)促进神经退行性变(Gao, 2023)。
星形胶质细胞
星形胶质细胞是中枢神经系统中数量最多的神经细胞,对维持稳态、调节血流以及支持突触传递至关重要。它们积极参与血脑屏障(BBB)的调节,是甘淋巴系统的重要组成部分,在突触和神经元功能中发挥主要作用,并控制细胞外离子和神经递质的平衡以及清除死亡细胞(Abbott, 2010;Sweeney, 2018;Kwon, 2020)。
星形胶质细胞与小胶质细胞类似,可处于从保护性到有害性的反应状态。促炎性星形胶质细胞(A1表型)释放细胞因子,如IL-1β、TNF-α和补体级联蛋白,这些物质已知会损伤神经元和突触。相反,抗炎性星形胶质细胞(A2表型)通过分泌神经营养因子和其他保护性分子促进神经元存活和修复。星形胶质细胞功能障碍在神经退行性疾病中常见,常加剧神经炎症并促进疾病进展(Kwon, 2020)。
例如,在阿尔茨海默病(AD)中,星形胶质细胞的活化与谷氨酸清除障碍相关,导致兴奋性毒性及神经元死亡。此外,由小胶质细胞细胞因子诱导的反应性星形胶质细胞可破坏血脑屏障(BBB),进一步加剧神经元脆弱性(Kwon, 2020)。类似地,在肌萎缩侧索硬化症(ALS)中,表达毒性因子(如C3)的反应性星形胶质细胞参与运动神经元退化(Gao, 2023)。
小胶质细胞-星形胶质细胞相互作用
小胶质细胞和星形胶质细胞对维持中枢神经系统(CNS)稳态至关重要,并在应对损伤和疾病过程中发挥关键作用。它们的相互作用高度动态,可通过保护性或有害方式影响神经炎症和神经退行性变,具体取决于其状态和环境背景(Liu, 2020;Kim, 2021;Gotoh, 2023)。在病理刺激下,小胶质细胞活化并释放促炎因子,如IL-1α、TNF-α和C1q。这些分子驱动星形胶质细胞向反应性A1表型转化,其特征为释放更多促炎细胞因子,从而维持小胶质细胞的活化状态。这种相互作用的信号传导建立了一个破坏性的反馈循环,放大炎症并加速神经退行性过程(Gao, 2023)。在这种反应性状态下,小胶质细胞还会增加突触修剪,这一过程在正常情况下对神经回路的精细化至关重要,但在炎症条件下可能变得有害。同时,星形胶质细胞刺激神经元释放补体蛋白,进一步激活小胶质细胞吞噬突触甚至整个神经元,导致神经元损失(Sierra, 2013)。这种炎症的恶性循环可破坏血脑屏障(BBB),削弱其保护功能,允许外周免疫细胞(如B细胞、T细胞和单核细胞)侵入中枢神经系统。这些浸润细胞通过增强胶质细胞释放细胞因子,进一步加剧炎症,形成持续的免疫激活环境,可能对神经组织造成进一步损伤(Abbott, 2010;Sweeney, 2018)。
尽管存在这些有害相互作用,小胶质细胞和星形胶质细胞也具备促进保护性和再生过程的能力。在特定条件下,小胶质细胞可通过IL-10信号通路诱导星形胶质细胞采用抗炎的A2表型,从而营造更有利于修复的微环境,限制组织损伤并促进修复(Mohammad, 2024)。中枢神经系统损伤后,星形胶质细胞增殖增多并形成"胶质瘢痕",这一物理屏障有助于局限损伤部位并防止进一步组织损伤。尽管该瘢痕有时会抑制神经再生,但在恢复早期阶段稳定中枢神经系统环境方面发挥关键作用。除瘢痕形成外,小胶质细胞和星形胶质细胞均释放促进细胞外基质(ECM)重建、新生血管形成和血管生成的因子。这些过程为神经元存活创造有利环境,促进干细胞迁移以替代受损神经元,并促进轴突重塑以恢复丢失的连接(Yang,2019;Heithoff,2021)。
最终,小胶质细胞与星形胶质细胞之间的相互作用复杂且高度调控,其结果会因促炎与抗炎信号的平衡而显著不同。尽管它们的相互作用可能引发破坏性炎症和神经元损失,但同样对促进修复及恢复损伤或疾病后中枢神经系统稳态至关重要。理解这些双重作用对于制定策略以减轻神经退行性损伤并增强中枢神经系统内在再生能力至关重要。
神经炎症与tau病如何相互作用?
tau病是一组以tau蛋白过度磷酸化并形成细胞内纤维状聚集物为特征的神经退行性疾病。这些聚集物在同工型组成、结构构象和定位上存在差异,最常见于神经元内。tau病可分为原发性形式,其中tau沉积是主要的病理特征,例如进行性核上性麻痹(PSP)、皮层基底节变性(CBD)和额颞叶痴呆(FTD);继发性形式,其病理特征还包括其他病理成分,如阿尔茨海默病(AD)中的β淀粉样蛋白;以及地理性形式,如瓜德罗普帕金森病(Lannuzel, 2007)。在疾病进展过程中,tau蛋白会发生翻译后修饰,导致其错误折叠形成β-片层丰富的聚集物,随后通过类似朊蛋白的机制从原发沉积部位向解剖学上相连的区域传播。这一过程涉及tau蛋白病理种子招募tau单体(Jucker, 2018)。胶质细胞(包括小胶质细胞和星形胶质细胞)最初试图通过吞噬细胞外tau并释放保护因子来减轻损伤,但慢性暴露会使其进入反应性状态。这些反应性状态的特征包括NF-κB通路的激活、炎症小体驱动的转录、过量细胞因子释放、溶酶体清除受损以及突触修剪异常。这种持续的神经炎症状态促进tau蛋白种子形成,加速神经元功能障碍,并与认知衰退紧密相关,进一步加剧tau病变的进展。
小胶质细胞在神经退行性疾病中的tau病理形成中发挥什么作用?
越来越多的研究表明,促炎性和小功能性小胶质细胞在促进tau病理和神经退行性变中发挥着不同的作用(Streit, 2014;Angelova, 2019;Odfalk, 2022)。Odfalk在最近题为《小胶质细胞:tau病变中的朋友与敌人》的综述中,简洁地概括了这一范式(Odfalk, 2022)。在疾病的早期阶段,小胶质细胞发挥保护作用。它们迁移至退化性神经突,吞噬来自死亡神经元释放的可溶性及纤维状tau蛋白,并分泌抗炎介质以帮助恢复组织稳态。然而,这种有益的监视状态极为脆弱。持续的蛋白病理应激、年龄相关性预处理、遗传风险等位基因及/或合并的脑血管损伤会驱动小胶质细胞向疾病相关小胶质细胞(DAM)表型转变。DAMs下调稳态标志物,同时上调吞噬溶酶体和脂质代谢相关基因,这些基因悖论性地增强了更具种子活性的tau蛋白的摄取、细胞内碎裂及后续释放。
大量证据表明小胶质细胞吞噬作用在清除tau蛋白中发挥积极作用(Luo, 2015;Bolós, 2017;Leyns, 2017)。实验表明,通过改变小胶质细胞表型(如抑制TNFα(Gabbita, 2015)或阻断IL-1信号通路在3xTgAD小鼠中(Kitazawa, 2011))来减少神经炎症,可改善tau病理。此外,有证据表明小胶质细胞通过多种机制直接促进tau病理进展,包括其稳态功能的紊乱(Perea,2018;2020)。例如,小胶质细胞可促进tau种子在细胞间的传递,随后形成聚集。这一机制得到了Asai等人的支持,他们发现小胶质细胞的耗竭可减少tau的传播(Asai,2015)。此外,有令人信服的证据表明,斑块相关小胶质细胞在转基因小鼠模型中促进tau蛋白传播(Clayton, 2021)。
tau病变背景下正常与病理平衡的典型例子是碎裂素受体CX3CR1的作用(Perea, 2018)。在正常情况下,小胶质细胞处于静息状态,此时神经元上表达的CX3C配体(CX3CL1)(Jiang, 2023)与小胶质细胞上表达的受体(CX3CR1)(Bhaskar, 2010;Zhan, 2014;Maphis, 2015)相互作用,维持正常功能。该轴通过膜结合型和可溶性CX3CL1与小胶质细胞受体CX3CR1的结合维持,确保免疫功能正常。当细胞外tau存在时,小胶质细胞被激活并试图通过吞噬作用清除过量tau,这一过程受CX3CL1/CX3CR1轴调控。在阿尔茨海默病中,随着病理进展和神经元死亡增加,细胞外tau显著积累,干扰CX3CL1/CX3CR1通路的正常功能。过量tau与CX3CL1竞争结合CX3CR1,从而阻碍小胶质细胞清除tau(Bolós,2017)。作为回应,小胶质细胞发生过度活化、增殖,并通过增加CX3CL1和CX3CR1的表达试图补偿。尽管CX3CL1/CX3CR1轴的表达增加,但该轴仍处于失调状态,进一步促进tau蛋白的积累和疾病进展。这种功能失调的小胶质细胞反应凸显了免疫调节在该过程中的复杂作用。
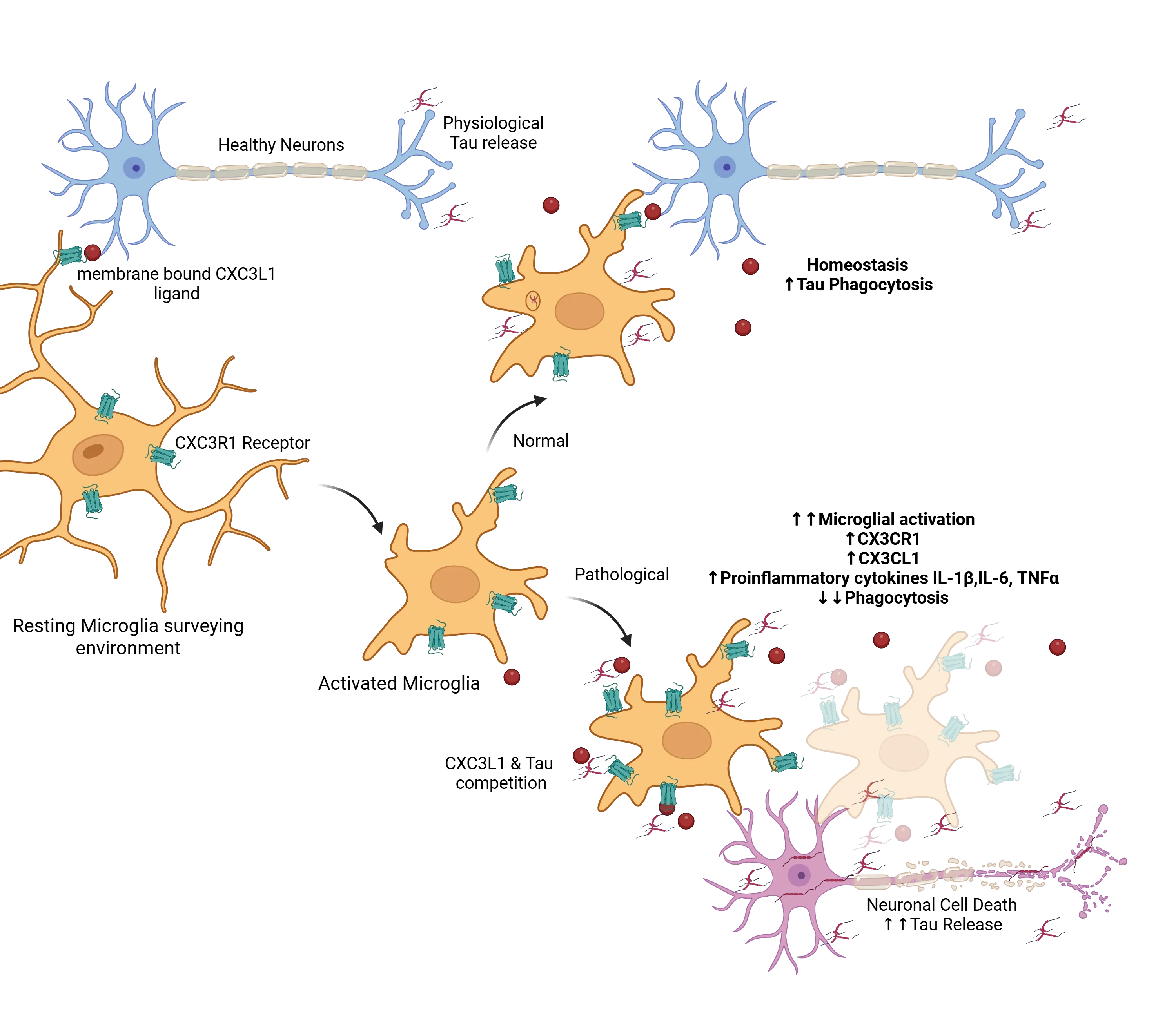
信号分子如CXCL1/CXC3R1有助于维持小胶质细胞在监测环境时的静息状态。当细胞外存在tau时,这些小胶质细胞会被激活,并在正常情况下吞噬tau并帮助维持稳态。在病理条件下,过量的tau与CXCL1/CXC3R1相互作用竞争,导致激活的小胶质细胞进入功能障碍状态,表现为激活增强、吞噬作用减弱、tau清除减少,进而导致细胞外tau积累增加,从而加剧毒性循环。图改编自Perea等( Perea, 2018),根据知识共享署名许可协议(Creative Commons Attribution License)转载。
星形胶质细胞如何放大并传递tau病理?
星形胶质细胞越来越被认为是tau病理的核心参与者,而不仅仅是被神经功能障碍影响的被动成分,而是tau稳态调节及其在脑区病理性扩散的积极贡献者。最新研究表明,星形胶质细胞通过复杂机制内化tau,影响其积累与清除。这些胶质细胞展现出双重作用:一方面,它们可作为缓冲器,试图减轻细胞外tau的负担;另一方面,其功能障碍或过度激活可能放大tau的聚集与传播。这一复杂作用凸显了星形胶质细胞作为潜在治疗靶点的重要性,有望通过调节tau动态来干预神经退行性疾病(Reid, 2020)。
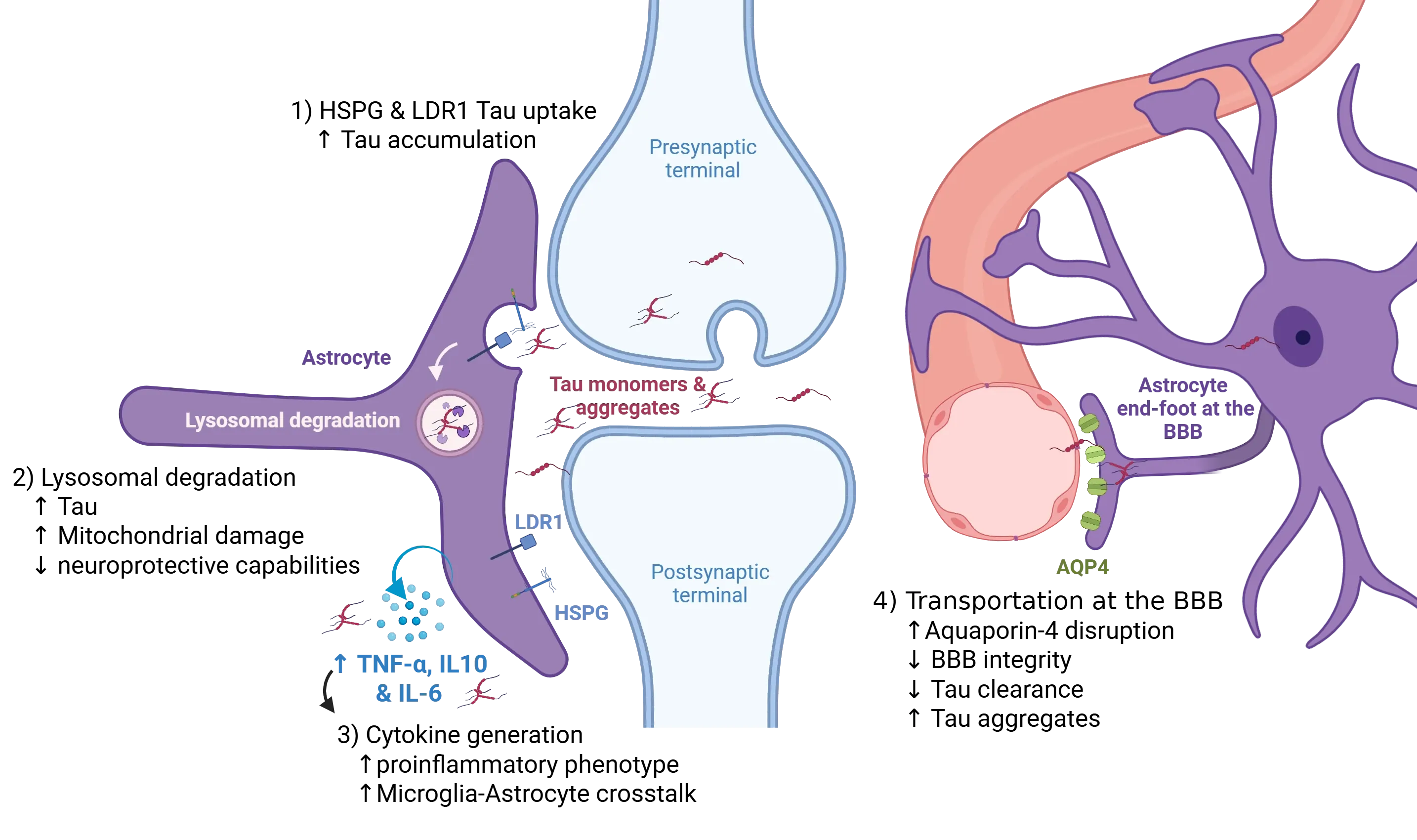
星形胶质细胞在调节中枢神经系统内tau病理的传播中发挥着积极作用。神经元通过多种途径将tau蛋白释放到细胞外空间,包括囊泡分泌和突触前释放。突触周围星形胶质细胞通过受体介导的内吞作用摄取细胞外tau,主要通过特定的肝素硫酸蛋白聚糖(HSPGs),这些蛋白聚糖优先结合聚集的tau,以及低密度脂蛋白受体相关蛋白1(LRP1),后者介导单体和寡聚体tau的摄取(1)。这些通路的破坏会扰乱细胞外tau的清除与积累平衡,可能促进tau的扩散。内化后的tau被运输至溶酶体进行降解(2);然而,溶酶体功能障碍(如内在过载或病理信号传导)导致细胞内tau积累并形成具有种子活性的聚集物。同时,以肿瘤坏死因子-α(TNF-α)和白细胞介素-10(IL-10)及白细胞介素-6(IL-6)等细胞因子升高为特征的促炎微环境,会增强星形胶质细胞的反应性并促进星形胶质细胞与小胶质细胞的相互作用(3),从而增加可用于传播的致病性tau蛋白池。此外,水通道蛋白-4(AQP4)在血管周围星形胶质细胞终末足的定位受损,会破坏tau的甘淋巴清除机制(4)。该血管周围清除机制的破坏导致细胞外tau蛋白的进行性积累,进而加剧tau病理在脑实质中的扩散。图改编自Reid等(Reid, 2020),采用知识共享署名许可 。
在突触处,神经元会释放单体和聚集态的tau蛋白至突触间隙,星形胶质细胞通过受体介导的内吞作用迅速清除这些蛋白(Reid, 2020)。星形胶质细胞独特地表达高度硫酸化肝素硫酸蛋白聚糖(HSPGs),这些蛋白聚糖对纤维状tau具有纳摩尔级亲和力,可高效引导其进入内溶体-溶酶体降解通路(Puangmalai, 2020)。这一能力通过溶酶体调节因子TFEB的上调得到增强,TFEB可扩大星形胶质细胞的溶酶体 compartment,从而提升其处理吞噬tau的能力(Martini-Stoica, 2018)。值得注意的是,星形胶质细胞对tau的摄取不仅限于纤维状结构。低密度脂蛋白相关蛋白-1(LRP1)与HSPGs协同作用,可内化单体和寡聚体tau,从而扩大星形胶质细胞能够处理的tau种类范围(Reid, 2020)。尽管星形胶质细胞的这一机制最初旨在清除突触tau并维持稳态,但它却悖论性地形成了tau聚集物的细胞内储库。这些具有种子活性的聚集物可随后释放,放大朊蛋白样传播,使星形胶质细胞成为双重角色:既是突触tau平衡的保护者,又是其病理扩散的贡献者。
血脑屏障处的星形胶质细胞在tau清除中也发挥重要作用,尤其通过与甘淋巴系统(glymphatic system)的连接。其血管周围的终足富含水通道蛋白AQP4,该蛋白促进间质液流动并驱动甘淋巴交换(Sun, 2025)。该系统有助于清除脑内可溶性tau,从而减轻tau病理。然而,AQP4功能的紊乱,通过多种机制,包括基因缺失、定位异常、睡眠碎片化或衰老,可破坏甘淋巴流并降低血脑屏障完整性,从而减少tau清除并加剧细胞外tau的积累和聚集。相反,旨在恢复AQP4极性或增强甘淋巴功能的干预措施在前临床研究中显示出减少tau负担和改善认知结局的潜力(Zhou, 2025)。例如,针对性策略,如行为干预、药物治疗和神经调节方法,通过优化甘淋巴泵送和AQP4表达,为治疗潜力提供了有力证据(Sun, 2025)。
胶质细胞介导的tau聚集物清除能否通过治疗手段增强?
增强小胶质细胞对tau聚集体的清除作用
小胶质细胞在清除异常折叠的tau蛋白中发挥关键作用。旨在增强这一清除功能的治疗方法正在研究中。其中一个有前景的途径是TREM2激动剂,例如人单克隆抗体VG-3927,目前正在完成I期剂量递增研究。通过激活TREM2,该疗法旨在恢复小胶质细胞的稳态表型并增强其对细胞外tau的吞噬清除能力。另一种方法是NLRP3炎症小体抑制,该方法在多种动物模型中显示出潜力(Zhang, 2020)。Quan的研究表明,NLRP3缺陷可减少tau转基因小鼠的神经炎症并改善认知功能(Quan, 2024)
最先进的治疗策略之一是 TREM2 激动剂:全人源 IgG1 单克隆抗体 VG-3927 正在完成首个人体剂量递增和药效学研究,旨在增强脂质感知通路、恢复小胶质细胞代谢并提升 tau 吞噬作用。早期抗体(如Alector的AL002、Denali的DNL-919)在II期临床试验中表现不佳,但更新的TREM2激动剂Novartis VHB937于2024年进入阿尔茨海默病和肌萎缩侧索硬化症的临床试验,凸显了该策略的持续潜力。与受体激动剂互补,脑渗透性小分子MCC950通过抑制NLRP3炎症小体抑制IL-1β成熟,从而抑制下游趋化因子级联反应。多种具有改善药代动力学特性的下一代NLRP3抑制剂已进入IND支持性研究阶段。
欲深入探討TREM2對小膠質細胞功能的作用,請參閱:TREM2與小膠質細胞
免疫疗法策略
针对tau的活性和被动免疫疗法均处于研发阶段,有望通过重塑细胞外tau微环境来调节小胶质细胞功能(Jadhav, 2019)。主动免疫疗法,如肽或mRNA疫苗,以及被动免疫疗法,包括人源化抗体,旨在选择性清除可溶性tau种子。通过减少具有种子活性的构象或截短片段,这些疗法可间接影响小胶质细胞活化,增强tau聚集物的摄取和清除,同时避免引发过度神经炎症。第二代抗体,设计用于靶向特定病理性tau亚型,正处于I-II期临床试验阶段,其成功部分取决于小胶质细胞处理抗体包被tau的能力。这些策略仍处于早期阶段,但持续研究正不断优化其治疗tau相关神经退行性疾病的潜力。
星形胶质细胞靶点:从甘淋巴流到蛋白质稳态
星形胶质细胞通过AQP4依赖的血管周围交换促进间质溶质的批量清除,并分泌热休克蛋白以协助错误折叠tau的折叠(Zhou, 2025)。实验性上调AQP4极性或药理学激活星形胶质细胞TFEB(溶酶体生物发生的主调控因子)可加速小鼠tau病模型中的tau清除,目前正通过小分子TFEB激动剂和AQP4调节剂进行探索(Verkman, 2013)。此外,星形胶质细胞对小胶质细胞释放的细胞因子(如IL-33驱动的脂质清除程序)的转化,凸显了胶质细胞间双向交叉谈话作为潜在治疗策略的潜力(Carlock, 2017;Sun, 2021)。
tau蛋白翻译后加工的代谢调节
除炎症外,对tau蛋白本身进行代谢调节仍具吸引力 作为治疗干预靶点。 选择性 抑制O-GlcNAcase(OGA)可增加tau的O-GlcNAcylation,从而通过空间位阻抑制病理性磷酸化和聚集(Kielbasa, 2024;Selnick, 2019;Wang, 2020)。MK-8719,一种口服给药的强效选择性小分子OGA抑制剂,已进入PSP的Ib期临床试验;尽管早期疗效信号较为有限,但脑脊液(CSF)药代动力学生物标志物证实了靶点结合的强效性。另一种 OGA 抑制剂 ceperognastat(原名 MK-8722)因在 AD Ⅱ期临床试验中暴露量不足,于 2025 年 2 月被 Eli Lilly 暂停开发,但结构与活性优化工作仍在进行中。值得注意的是,这些代谢干预措施依赖于功能正常的胶质细胞蛋白稳态机制,进一步强化了小胶质细胞和星形胶质细胞支持是实现最大治疗效益先决条件的观点。
展望
综合来看,受体激动剂、炎症小体阻断、免疫疗法及代谢调节等研究数据均指向一个核心主题:胶质细胞具备尚未充分开发的清除病理性tau蛋白的能力,但该能力需重新定位以实现平衡的稳态表型。未来临床试验需结合精准分子靶向与敏感的体液及影像学生物标志物,以实时监测胶质细胞状态及tau蛋白负荷的变化。单一胶质细胞调节剂是否能实现临床意义上的疾病进展减缓,或其最佳应用形式是与抗tau抗体或反义寡核苷酸的理性联合用药,仍是待解答的问题。需特别指出,该领域正快速发展,针对星形胶质细胞与小胶质细胞-tau相互作用的其他治疗候选药物正处于研究阶段。正在进行的研究继续揭示胶质细胞在tau病中的复杂作用,旨在开发有效的疾病修饰治疗方法。
我们的团队很乐意回答关于小胶质细胞、星形胶质细胞及tau蛋白在神经退行性疾病中的任何问题,或提供关于我们用于治疗有效性研究的阿尔茨海默病(AD)和tau病变模型(tauopathies)的具体信息。
相关内容
关于小胶质细胞、星形胶质细胞及tau蛋白在神经退行性疾病中的最新研究进展,以及在神经退行性疾病动物模型中评估治疗药物时的最佳实践方法。
TREM2与小胶质细胞
TREM2概述:其在小胶质细胞中的作用、与神经退行性疾病的关联及潜在治疗意义
小胶质细胞与神经元相互作用与神经退行性疾病
对小胶质细胞与神经元之间直接相互作用的简要综述,以及这些细胞间相互作用在神经退行性疾病中可能受到的影响。
小胶质细胞、星形胶质细胞与α-突触核蛋白在帕金森病中的作用
α-synuclein在帕金森病及其他α-synuclein相关疾病中对小胶质细胞和星形胶质细胞的影响。
神经退行性疾病中的TNF-α和微胶质细胞
概述肿瘤坏死因子-α(TNF-α)在小胶质细胞中的作用及其对神经退行性病变进展的影响。
NLRP3炎症小体与神经退行性疾病
NLRP3炎症小体及其在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症)中作用的概述。