このリソースでは、以下について説明しています。
IL-1βとは何ですか?
インターロイキン-1β(IL-1β)は、炎症誘発性サイトカインとして知られる単鎖タンパク質です。これは、分子量約17-18 kDaのさまざまなサイトカインを含むIL-1スーパーファミリーに属し、IL-1α、IL-1Ra、IL-18、IL-33、IL-38などが含まれます。IL-1βの主な産生源は、単球、マクロファージ、好中球です。脳では、ミクログリアとアストロサイトから分泌されます。IL-1βは体全体に広く発現していますが、骨髄、尿路、脳、消化管、結合組織および軟組織、肝臓、胆嚢において特に高濃度で検出されます(Kaneko, 2019;Boraschi, 2022)。
IL-1βは体内で多様な役割を果たし、恒常性免疫応答に寄与するほか、睡眠、痛み、神経可塑性などの重要な生理的プロセスにも関与しています(Ren & Torres, 2009)。その主な機能は、病理状態における炎症の促進にあります。IL-1βは、先天性免疫と獲得免疫の両方に関与し、視床下部のCOX-2とPGE2のレベルを増加させることで発熱を刺激します(Boraschi, 2022)。
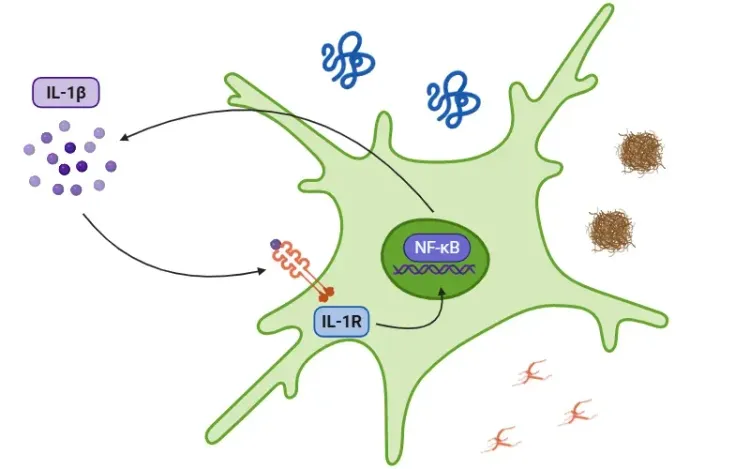
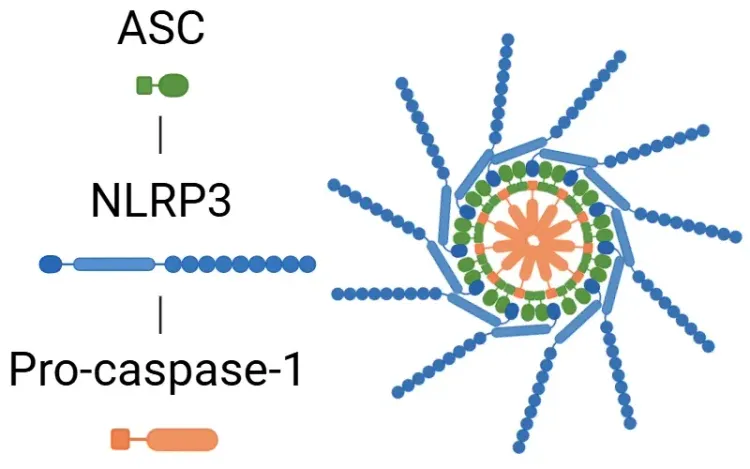
シグナル伝達カスケードは、損傷関連分子パターン(DAMPs)および病原体関連分子パターン(PAMPs)がトール様受容体(TLRs)によって検出されることで開始されます。IL-1βの分泌は、炎症小体依存的または非依存的な経路を通じて行われます。インフラマソーム経路では、PAMP または DAMP による NF-κB 転写因子の活性化により、プロ IL-1β、プロ IL-18、および NLRP3 が放出されます。その後、NLRP3 は ASC およびプロカスパーゼ-1 を動員してインフラマソームを形成し、カスパーゼ-1 を活性化します。この酵素は、IL-1βおよびIL-18を活性型に切断し、炎症を促進します(Lopez-Castejon & Brough、2011;マーティン・サンチェス、2016;スワンソン、2019)。NLRP3インフラマソームの詳細については、リソース「NLRP3とは何ですか?一方、プロ IL-1β は、好中球のミエロブラスタインによって IL-1β に切断されます。経路にかかわらず、IL-1β の分泌の結果、TAK1 や MAPK などのキナーゼのカスケードが引き起こされ、NF-κB や AP-1 などの炎症誘発性転写因子が活性化されます。このプロセスは、最終的には、追加の IL-1β、IL-18、NLRP3 などの炎症誘発性シグナルの放出の増加につながります(Weber, 2010、金子、2019 年、フォード、2025 年)。
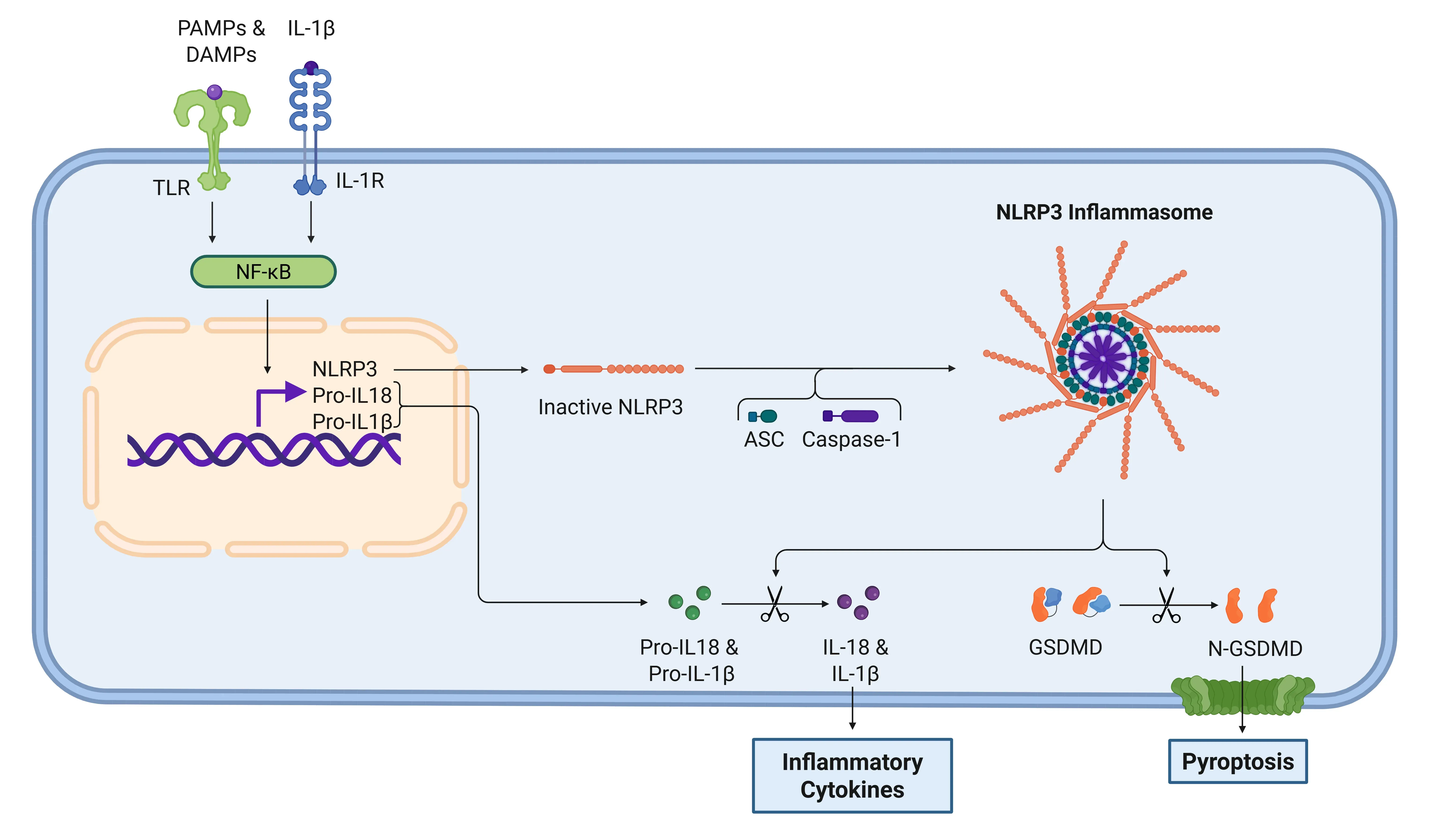
IL-1βシグナル伝達カスケードを介したNLRP3炎症小体。
炎症小体は、TLRを介してPAMPsおよびDAMPsが検出されると活性化されます。活性化されると、転写因子NF-κBがNLRP3の発現と炎症性サイトカインの不活性型の発現を誘発します。炎症小体はこの後、ガスダーミンD(GSDMD)を処理し、ピロプトーシスを引き起こし、サイトカインを機能的な形態であるIL-1βとIL-18に活性化します。このステップの後、IL-1RがIL-1βを認識し、炎症反応をさらに促進します。
IL-1βの分泌により、炎症反応全体が亢進します。IL-1α、IL-17、COX2、PGE2、RANKL、MKP1、さらにIL-1βなど、複数の標的遺伝子が転写されます。さらに、炎症カスケードは毛細血管の透過性を高め、免疫細胞が影響を受けた組織に浸潤し、炎症をさらに促進します。IL-1βとIL-8の産生は、他の免疫細胞に警報を伝える役割を果たす一方で、好中球、マスト細胞、Th17細胞、破骨細胞の活動を調節します(Sakurai, 2012;Ford, 2025)。
IL-1βは全身性疾患および神経変性疾患においてどのような役割を果たしていますか?
IL-1βは急性炎症の促進に重要な役割を果たしますが、そのレベルが上昇すると過剰な炎症反応を引き起こし、さまざまな疾患に寄与します。痛風や若年性特発性関節炎はIL-1βによって仲介され、変形性関節症(Dinarello, 2019)においてもそのレベルの上昇が観察されています。さらに、IL-1βは免疫抑制性骨髄由来抑制細胞(MDSCs)と腫瘍関連マクロファージ(TAMs)の分化を促進し、これらは腫瘍炎症を促進するだけでなく、免疫逃避を助ける役割も果たします(Bent, 2018;Kaneko, 2019)。これらのTAMは、膵がんや大腸がんを含む複数のヒトがんにおいて同定されており、患者の予後不良と関連しています(Caronni, 2025)。
IL-1βは、免疫応答を持続させることで神経変性疾患にも関与しています。NLRP3炎症小体経路に関与し、神経炎症に大きく寄与しています(Mendiola & Cardona, 2018)。詳細については、リソース「NLRP3炎症小体と神経変性疾患」をご参照ください。興味深いことに、一部の研究では、IL-1βがIL-1R1+IL-1R3b受容体との相互作用を通じて神経保護効果を発揮する可能性が示唆されており、IL-1R9受容体への作用を通じて記憶と学習に関与していることが示されています(Boraschi, 2023)。
アルツハイマー病(AD):
IL-1スーパーファミリーに属するサイトカインは、ADにおける炎症に深く関与しており、特にIL-1βとIL-18が重要です。IL-1βの血中濃度は、アミロイドβ(Aβ)によって活性化されるNLRP3炎症小体(NLRP3 inflammasome)の活性化により、脳脊髄液(CSF)で上昇することが報告されています(Mendiola & Cardona, 2018;Xu, 2025)。IL-1βの放出は、アミロイドβの産生を促進するだけでなく、神経原線維変化の形成とさらに炎症小体の活性化を促進する有害なサイクルを引き起こします。一方、IL-1スーパーファミリーに属する別のサイトカインであるIL-1Raは、重要な保護因子として作用します。マウスモデルにおいてIL-1Raが欠如すると、疾患の病理が進行することが示されています(Boraschi, 2023)。
パーキンソン病(PD):
PDは、α-シヌクレインの異常な折り畳みとドーパミン神経細胞の変性により、NLRP3炎症小体(NLRP3 inflammasome)の活性化を引き起こす疾患です(Dzamko, 2023;Xu, 2025)。NLRP3炎症小体は、主要な炎症媒介物質であるIL-1βを産生することで、PDの発症に重要な役割を果たしています(Boraschi, 2023)。PD患者では、CSF中のサイトカイン(IL-1β、TNFα、IL-6など)のレベルが上昇し、疾患に関連する神経炎症プロセスに寄与しています。黒質におけるIL-1βの過剰発現はドーパミン神経細胞のさらなる喪失と神経炎症の増強を引き起こす一方、海馬における過剰発現は認知機能障害を引き起こします(Dzamko, 2023)。しかし、PDの文脈におけるIL-1βの正確な役割は依然として完全に解明されていません(Boraschi, 2023)。
パーキンソン病におけるα-シヌクレインに関する追加情報については、「パーキンソン病におけるミクログリア、アストロサイト、およびα-シヌクレイン」および「パーキンソン病治療薬開発のためのAAV α-シヌクレインモデル」を参照してください。
多発性硬化症(MS):
MS患者では、カスパーゼ-1、IL-1β、およびIL-18のレベルが上昇しています。NLRP3炎症小体(NLRP3 inflammasome)は、CD4(+) T細胞の移動を促進することで、MSの発症に重要な役割を果たしています。原発性進行性MSでは、単球によるNLRP3炎症小体過剰産生が起こり、これがIL-1βの産生を促進します(Mendiola & Cardona, 2018;Xu, 2025)。実験的自己免疫性脳脊髄炎(EAE)の文脈では、IL-1βは、炎症小体に関与しない経路を通じてIL-17Aによって募集された骨髄系細胞から分泌されます(McGinley, 2020)。このIL-1βは、血液脳関門の透過性を高めるだけでなく、主にアストロサイトと内皮細胞に影響を与えることで白血球の募集を促進します(Boraschi, 2023)。
MSの研究に用いられた動物モデルの概要については、Multiple Sclerosis Modelsをご参照ください。
筋萎縮性側索硬化症(ALS):
ALSは、ALSと前頭側頭型認知症の両方で重要な病理学的マーカーであるTDP-43の存在が特徴です。TDP-43の沈着物は、一次ミクログリア培養においてNLRP3炎症小体(inflammasome)を活性化し、IL-1βの産生増加を引き起こすことが知られています(Bright, 2021)。ALS および TDP-43 の役割に関する追加情報については、「ALS マウスモデルと脊髄運動神経細胞」および「ALS マウスモデルを用いた薬物開発」を参照してください。
IL-1βは、ALSと関連する2つの最も一般的な変異の1つである変異型スーパーオキシドディスムターゼ(SOD1)に関連する炎症にも関与しています。SOD1はまた、炎症小体活性化を引き起こし、神経炎症を誘発します。興味深いことに、IL-1βはALSのバイオマーカーとして機能し、特に特定の遺伝子変異体C9orf72HREを有する患者において、患者生存率と負の相関関係が認められています(Dutta, 2020;Boraschi, 2023)。
神経変性疾患におけるIL-1βの役割に関する包括的なレビューについては、以下の文献を参照してください:インターロイキン-1ベータ(IL-1β)と神経変性疾患
IL-1βは治療標的として機能する可能性がありますか?
IL-1βは、炎症における重要な役割から、さまざまな疾患における有望な治療標的として認識されています。IL-1受容体拮抗薬(IL-1Ra)は、自己免疫疾患における疾患の重症度軽減と予後改善に有望な結果を示しており、神経変性疾患における可能性も示唆されています。
IL-1Raの代表的な例として、ヒト固有のIL-1Raであるアナキンラが挙げられます。この治療法は、IL-1αとIL-1βの両方の活性を阻害し、関節リウマチ、新生児発症多系統炎症性疾患(NOMID)、インターロイキン-1受容体拮抗薬欠乏症(DIRA)などの自己炎症性疾患における使用が承認されています(Ford, 2025)。アナキンラは最も広く研究されているIL-1Ra薬剤であり、神経変性疾患における効果の可能性が示唆されていますが、この分野の研究は依然として限定的です。
アルツハイマー病(AD)の動物モデルにおいて、アナキンラはIL-1βのレベルを低下させ、アミロイドβとタウの沈着を減少させることで認知機能障害を改善することが示されています(Xu, 2025)。一方、ALSのマウスモデルにおいてIL-1Raを阻害することは生存期間を延長することが示されていますが、疾患の発症には影響を及ぼしませんでした。ALSの治療における安全性および忍容性試験はヒトで実施されていますが、この治療法の有効性を評価するためにはさらなる臨床試験が必要です(Maier, 2015)。
別のIL-1Raであるリロナセプトは、ヒトIL-1R1とIL-1R3の細胞外領域をヒトIgG1のFc領域と融合させたものです。この設計により、IL-1αとIL-1βの両方を長期的に阻害することが可能であり、リロナセプトはクリオピリン関連周期性症候群(CAPS)の治療に承認されています。
最後に、カナキヌマブは、IL-1βを特異的に標的とし、IL-1αやIL-1R1に影響を与えないヒトモノクローナルIgG1抗体です。スティル病、周期性発熱症候群、および痛風発作の治療に承認されています(Dinarello, 2019)。
これらの療法は、炎症性疾患の管理においてIL-1βを標的とする可能性を浮き彫りにし、多様な神経変性疾患の治療に新たな選択肢を提供しています。
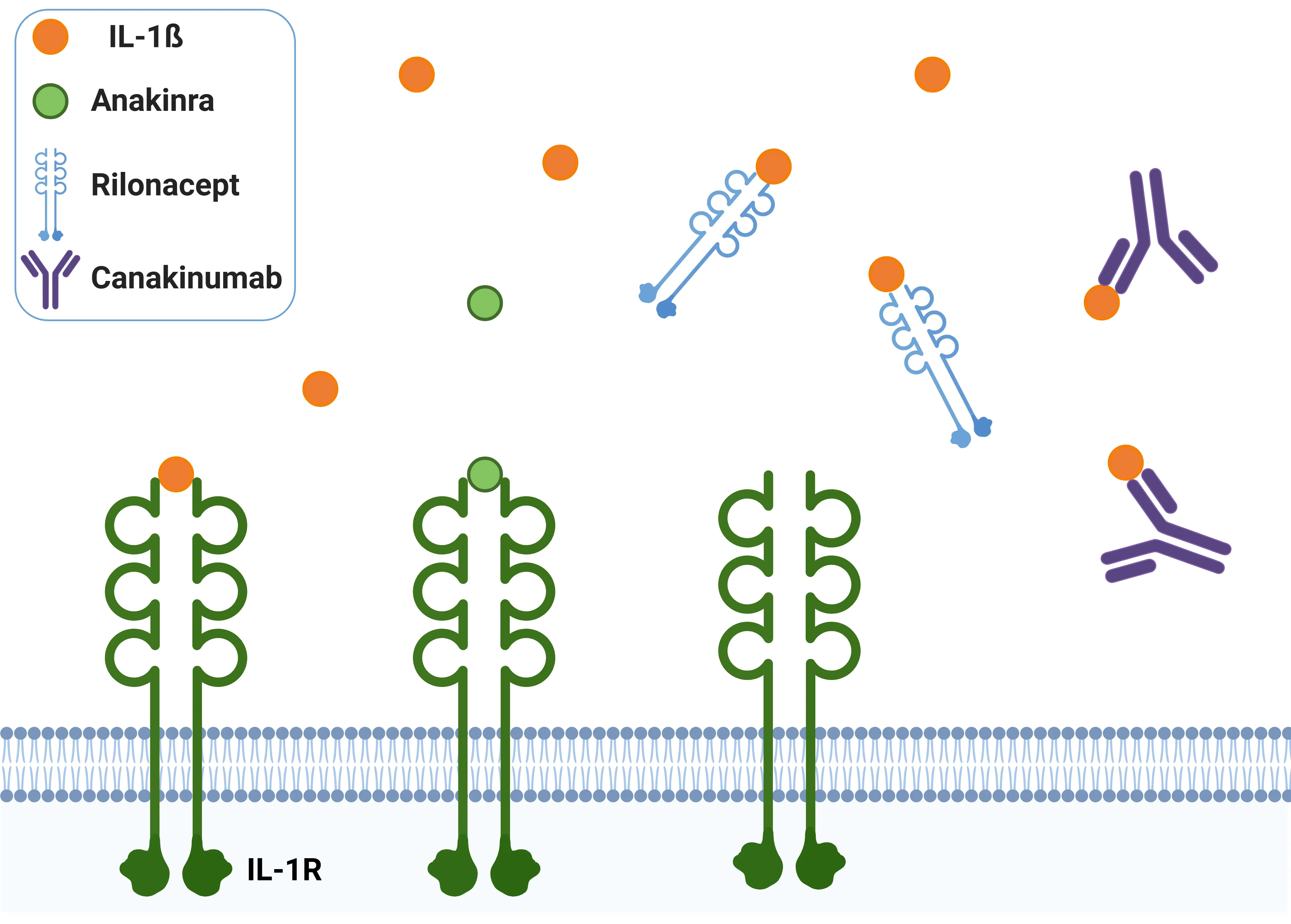
IL-1β拮抗薬。
アナキンラは競合的拮抗薬として作用し、IL-1Rに結合してIL-1βの作用を効果的に阻害します。リロナセプトはIL-1Rの細胞外領域から構成され、デコイ受容体として機能し、IL-1βが受容体に結合するのを防ぎます。カナキヌマブは、IL-1βを特異的に標的とするモノクローナル抗体で、IL-1βがIL-1Rに結合する能力を阻害し、その活性を抑制します。
当社のチームは、IL-1βに関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて詳しく見る
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
インターロイキン-1ベータ(IL-1β)と神経変性疾患
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患におけるIL-1βの役割。
インフラマソームとは何ですか?
炎症小体(インフlammasome)の概要:その作用機序、疾患における役割、および薬物開発における標的化について。
NLRP3とは何ですか?
NLRP3およびNLRP3炎症小体活性化トリガー、疾患関連、および治療的標的戦略の概要。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。
ミクログリアとアストロサイトのライソゾーム機能不全
ミクログリアとアストロサイトのライソゾーム機能不全の概要と、神経変性疾患におけるその役割。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。