IL-1βとは何ですか?
インターロイキン-1ベータ(IL-1βまたはIL-1beta)は、IL-1スーパーファミリーに属するプロ炎症性サイトカインで、主に単球、マクロファージ、好中球によって産生され、さまざまな組織で高濃度で存在します。宿主防御、炎症、発熱誘発、免疫細胞の活性化、脳機能などに重要な役割を果たします。中枢神経系(CNS)の生理的条件下では、IL-1βは神経細胞の増殖、分化、アポトーシス、および長期増強を促進します。IL-1βは、損傷関連分子パターン(DAMPs)や病原体関連分子パターン(PAMPs)に応答して分泌され、NLRP3炎症小体や TNF-α、IL-18を含むさまざまなキナーゼを介した炎症促進シグナル伝達経路を活性化します(Lopez-Castejon, 2011;Kaneko, 2019)。
IL-1βのレベルが上昇すると、過剰な炎症を引き起こし、炎症を促進し、腫瘍細胞が免疫系から逃れるのを助けることで、痛風、変形性関節症、がんなどの疾患に寄与します。神経変性疾患では、IL-1βは神経炎症に関与し、特にNLRP3炎症小体を通じて、アルツハイマー病(AD)やパーキンソン病(PD)などの神経変性疾患に及ぼす影響が示唆されています。
IL-1βの詳細な要約については、リソース「IL-1βとは何ですか?」をご参照ください。
IL-1βはアルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)においてどのような役割を果たしていますか?
ミクログリアとアストロサイトは、中枢神経系(CNS)の恒常性維持に重要な役割を果たす2つの主要なグリア細胞です。これらの細胞は脳の免疫応答に不可欠な役割を果たし、神経炎症の主要な要因として、神経変性疾患においてよく観察されます:
- ミクログリアは、炎症促進状態においてIL-1βを分泌します。特に、疾患関連ミクログリア(DAMs)は、神経変性疾患において保護作用と有害作用の両方を有します。初期段階では、ファゴサイトーシスにより神経毒性のある凝集体を除去することで疾患から保護する役割を果たします。しかし、DAMはIL-1βやTNF-αなどの炎症促進性サイトカインを放出することで、慢性炎症や神経変性を悪化させる可能性があります。DAM様ミクログリアは、タウ病変、AD、PD、ALSを含むさまざまな神経変性疾患で同定されています。
- アストロサイトも、炎症促進条件下でIL-1βを分泌します。一部の反応性アストロサイトは、保護メカニズムとしてグリア瘢痕を形成し、さらなる損傷や感染の拡散を防ぐバリアとして機能します。しかし、反応性アストロサイトは、神経細胞損傷を悪化させる炎症促進性サイトカインを産生する可能性もあります。
神経変性疾患におけるミクログリアとアストロサイトの役割の詳細は、リソース「神経変性疾患におけるミクログリア、アストロサイト、およびタウ」および「パーキンソン病におけるミクログリア、アストロサイト、およびα-シヌクレイン」で議論されています。
アルツハイマー病(
) ADは、最も一般的な認知症の形態として認識されており、脳内のタンパク質の蓄積が特徴で、アミロイド斑と神経原線維タウ変性として現れます。ADの病理における主要な役割を果たすのはIL-1βで、アミロイドβとタウ病理の調節に複雑な役割を果たします。その機能は有益な面と有害な面の両方があります(Shaftel, 2008;Matousek, 2012;Boraschi, 2023)。負の側面では、IL-1βはNLRP3炎症小体によって産生され、アルツハイマー病に関連する神経炎症と神経細胞損傷を引き起こします(Lopez-Rodriguez, 2021;Boraschi, 2023)。
他のサイトカインもADの炎症過程に関与しています。AD患者の末梢血中では、IL-6、IL-12、IL-18、TNF-α、およびTGF-βのレベルが著しく上昇しています(Xu, 2024)。遺伝的要因も疾患の発症に寄与しています。ADのリスク増加と関連するIL-1遺伝子の特定の多型には、以下のものが含まれます(Mrak, 2001):
- IL-1A 2 (-889): この変異体は、IL-1αの発現レベルの上昇と関連しています。
- IL-1B 2(エクソン5):この変異体は、IL-1βの発現レベルの上昇と関連しています。
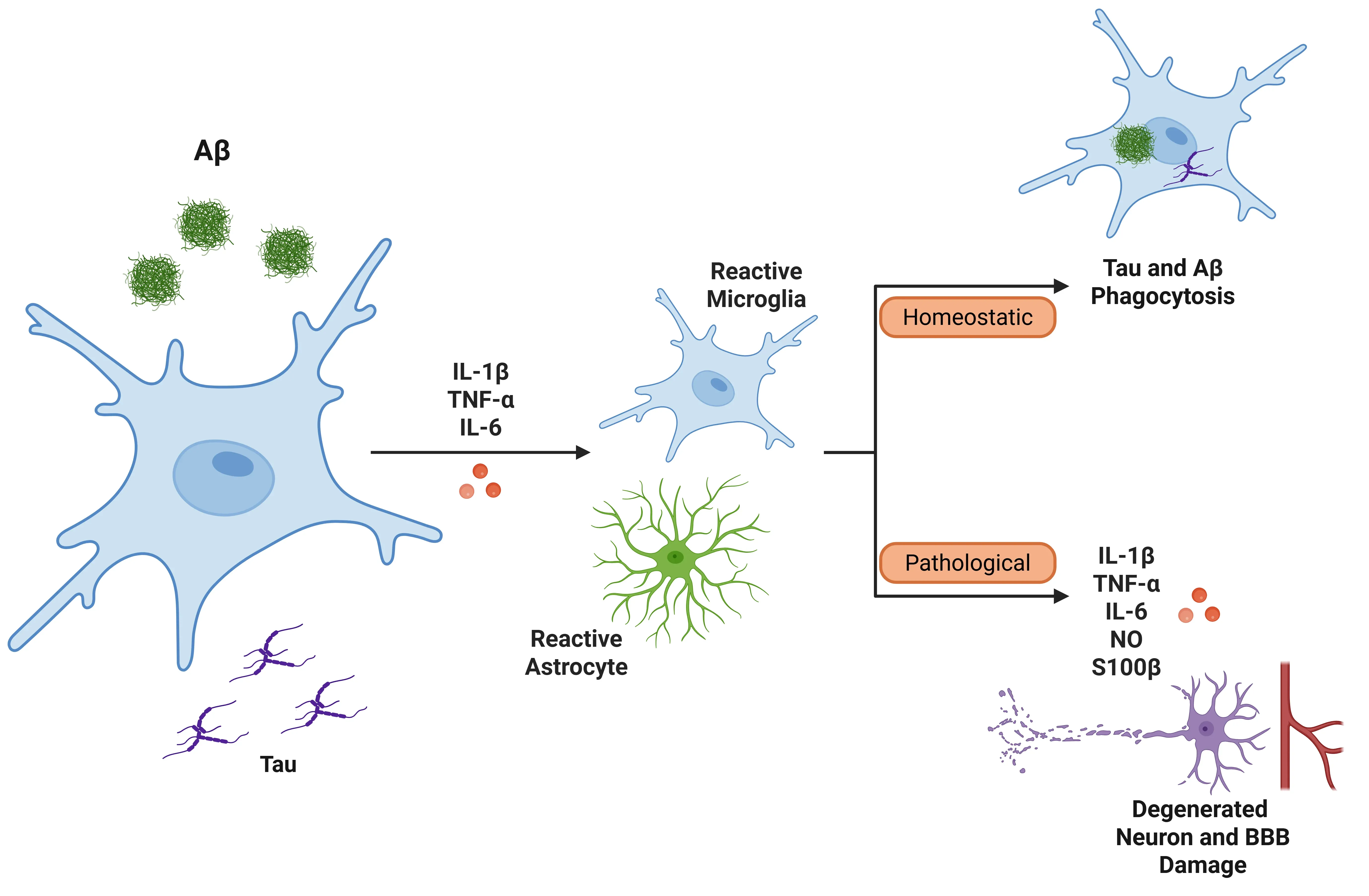
IL-1βは、アルツハイマー病の文脈でミクログリアとアストロサイト活性化します(Ghosh, 2013)。IL-1βが放出されると、TNF-αやIL-6などの他のプロ炎症性サイトカインの発現を誘導し、炎症反応をさらに増幅します。
- ミクログリア:ミクログリアは、アミロイド-βの除去によりADに対して初期段階での防御作用を果たしますが、慢性的な活性化はシステムを過剰に刺激し、神経炎症を引き起こします。この活性化は、ミクログリアがさらにIL-1βと炎症性メディエーターを放出するフィードバックループを引き起こし、最終的にアミロイド-βの除去を妨げ、血液脳関門(BBB)を損傷します(Shaftel, 2008;Valiukas, 2025)。
- アストロサイト:アストロサイトは、アミロイドβによって活性化されると、IL-1βに対する過剰な反応を引き起こし、炎症をさらに促進します。IL-1βによって誘発される一酸化窒素の放出も神経毒性を引き起こす可能性があります。特にIL-1βを過剰発現するアストロサイトは、神経損傷と炎症過程の悪化に関与するタンパク質であるS100βを放出します(Mrak, 2000;Sama, 2008)。
IL-1βは、ミクログリアの活性化とMAPKシグナル伝達経路を介してタウタンパク質の過リン酸化を刺激し、微小管の安定性を乱し、神経原線維変化の形成に寄与することで、タウ病理に関与しています(Griffin, 2006;Shaftel, 2008;Ghosh, 2013)。さらに、IL-1βはアミロイドβの産生と沈着と関連しています。炎症性サイトカイン(IL-1β、IL-6、TGF-βなど)は、アルツハイマー病患者の脳内のアミロイド斑の周囲に蓄積します(Italiani, 2018)。IL-1βの過剰発現は、プラークの形成増加と変性神経突起の成長と相関しています(Mrak, 2001)。
興味深いことに、IL-1βは炎症促進作用を有するにもかかわらず、ADに対する保護メカニズムにも関与している可能性があります。IL-1βの過剰発現を設計したADのトランスジェニックマウスモデルにおいて、持続的な神経炎症はアストロサイトとミクログリアの活性化、および炎症性サイトカインの増加を引き起こしました。IL-1βの過剰発現後4週間で、アミロイド病理の減少が観察され、ミクログリアによるアミロイドβのクリアランスが強化された可能性が示唆されました(Shaftel, 2007;Shaftel, 2008;Matousek, 2012)。
脳内のIL-1βの直接的な関与に加え、末梢の全身性炎症も脳内のIL-1βレベルを増加させ、ADの病理に影響を与える可能性があります(Wang, 2023)。さまざまなマウスモデル研究では、リポ多糖(LPS)などの全身性薬剤がAβの沈着を増加させ、認知機能障害を引き起こすことが示されています(Xie, 2021)。
IL-1βがADに関与していることから、潜在的なバイオマーカーとして注目されていますが、患者様の髄液(CSF)や脳組織におけるそのレベルについては、研究結果が一致していません(Ng, 2018;Scarabino, 2020)。最終的に、IL-1β、神経炎症、およびアルツハイマー病のさまざまな病理学的特徴との複雑な関係を解明するためには、さらなる研究が必要です。IL-1βがタウ病理とアミロイドのクリアランスに及ぼす具体的なメカニズムを理解することは、この深刻な疾患に対する標的療法の開発につながる可能性があります。
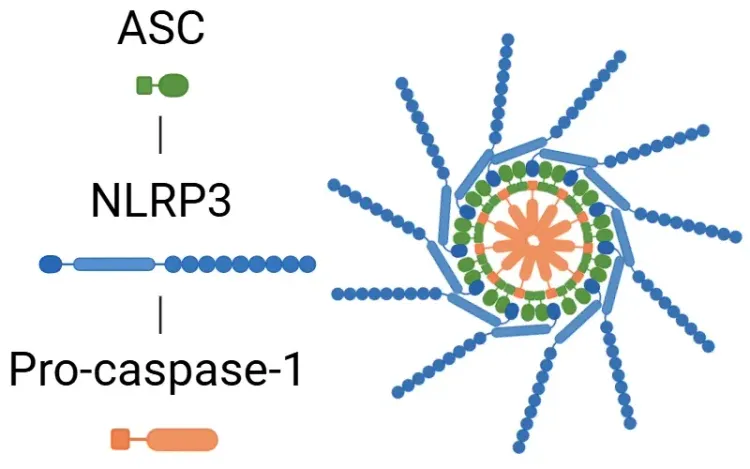
炎症小体活性化に関連する代表的な疾患。
炎症小体機能の異常は、神経変性疾患、心血管疾患、自己免疫疾患、代謝疾患など、幅広い疾患と関連しています。図では主要な例を強調していますが、炎症小体経路が関与する他の多くの疾患も存在します。
パーキンソン病
PDは、中脳にある基底核の黒質においてドーパミン作動性神経細胞の進行性変性を特徴とする神経変性疾患です。この変性は、神経細胞内の α-シヌクレインの凝集と関連しています。
プロ炎症性サイトカインであるIL-1βは、パーキンソン病における神経炎症と神経変性において重要な役割を果たします。その産生は、ミクログリアにおけるNLRP3炎症小体(inflammasome)の活性化と密接に関連しています。異常な構造のα-シヌクレインは、ミクログリアのTLR2/TLR4シグナル伝達を活性化し、炎症小体(inflammasome)の組み立て、カスパーゼ-1の活性化、およびプロ-IL-1βの活性型分泌型への変換を引き起こします(Koprich, 2008;Pott Godoy, 2008;Leal, 2013;Stojakovic, 2017;Tansey, 2022;Dzamko, 2023)。IL-1βの増加は、脳のドーパミン神経系領域、髄液、および血液で検出され、疾患の重症度と症状の進行(認知機能障害を含む)と相関しています(Dursun, 2015;Liu, 2022;Dzamko, 2023;Qu, 2023)。さらに、TNF-α、IFNγ、IL-6、IL-2、IL-10などの他のプロ炎症性サイトカインも血漿中で上昇していることが報告されています(Xu, 2024)。
パーキンソン病(PD)の文脈では、ミクログリアがIL-1βの主要な産生細胞および分泌細胞です:
- 慢性的な活性化は、IL-1β、TNF-α、IL-6、反応性酸素種(ROS)、一酸化窒素、およびTGF-βの放出を介して神経炎症を持続させ、黒質と線条体におけるドーパミン神経細胞にとって毒性のある環境を創出します(Leal, 2013;Tansey, 2022;Liu, 2022)。
- PD動物モデルにおいて、貪食状態への移行を含む強力なミクログリア活性化が観察されており、神経細胞損傷とさらに炎症の悪循環を促進しています(Ferrari, 2006;Pott Godoy, 2008)。
- LRRK2やPINK1などの遺伝的変異は、ミクログリアのIL-1β産生を促進し、神経炎症を悪化させます(Liu, 2022)。
- ミクログリアがIL-1βの産生を主導する一方、アストロサイトは炎症刺激によりIL-1βやIL-6を含むサイトカインの発現を上昇させ、NF-κB依存性経路を介してミクログリアの反応を強化します。
- アストロサイトの活性化は慢性炎症に伴い増加し、アストロサイト増殖、瘢痕形成、および炎症環境の調節に寄与します。
- アストロサイトとミクログリアの相互作用はドーパミン毒性を増強します(Ferrari, 2006;Leal, 2013)。
総合的に、主にミクログニアによって駆動され、アストロサイトによって支援されるIL-1β/炎症小体軸は、慢性神経炎症、ドーパミン神経細胞の喪失、およびPD症状の進行を促進します(Leal, 2013;Tansey, 2022;Dzamko, 2023)。
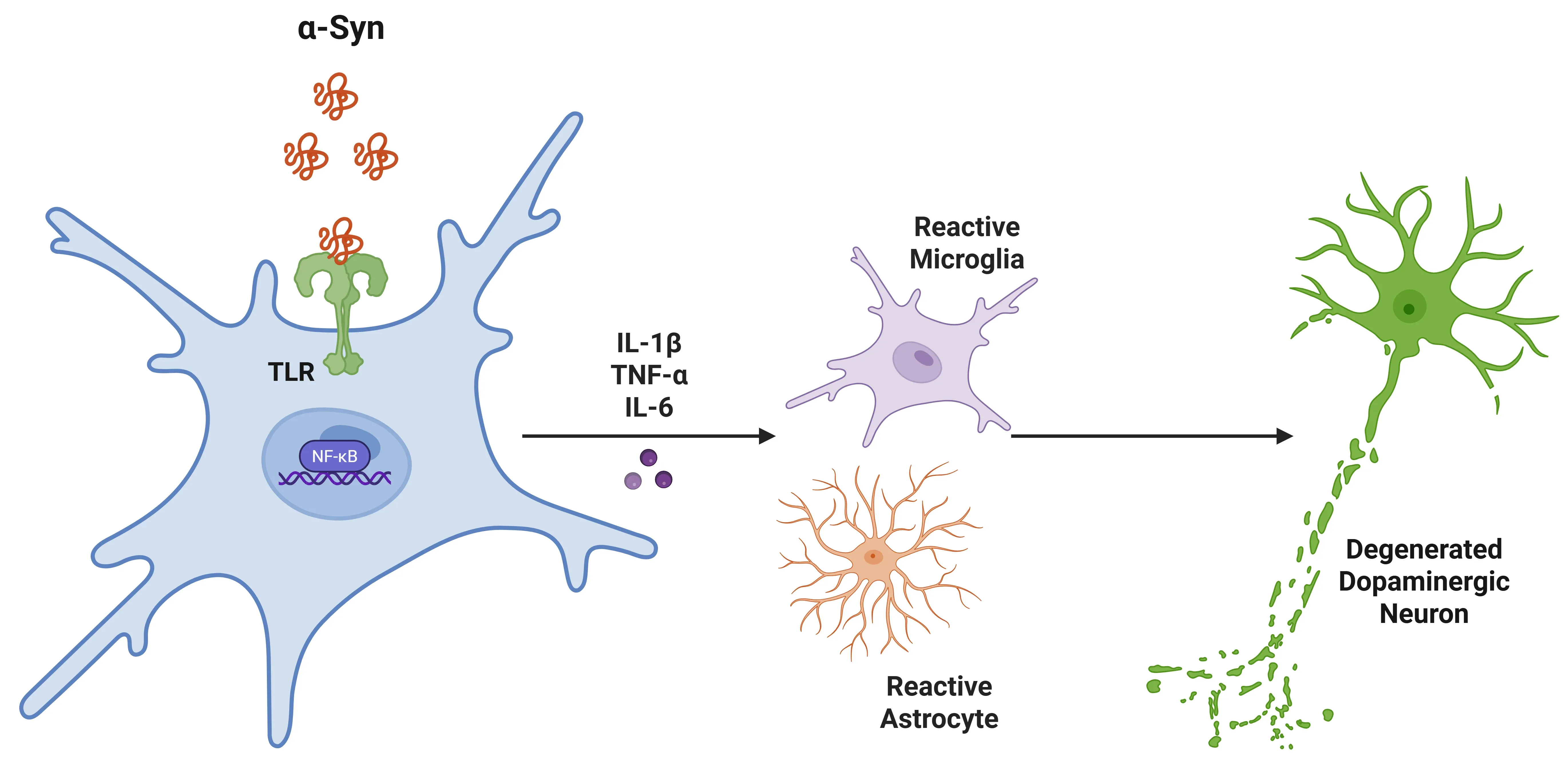
パーキンソン病(PD)におけるIL-1β。
アルファ-シヌクレインはミクログリアのトール様受容体(TLR)に結合し、NF-κBを活性化させるシグナル伝達カスケードを誘発します。これにより、炎症性サイトカインの増加が起こり、さらにミクログリアとアストロサイトが募集され、炎症が促進されます。最終的に、これは黒質におけるドーパミン神経細胞の変性を引き起こします。
筋萎縮性側索硬化症(ALS)
IL-1β、IL-6、IL-18、およびTNF-αなどのプロ炎症性サイトカインは、ALSにおける神経炎症の仲介物質です。これらのサイトカインの増加は、ALS患者の中枢神経液(CSF)および血清、ならびにALSの動物モデルにおいて観察されています(Xu, 2024)。
TDP-43と変異型SOD1(家族性ALSと関連している)はミクログリアに取り込まれ、カスパーゼ-1を含む炎症小体(インフlammasome)を活性化し、プロIL-1βを活性型であるIL-1βに処理します。このプロセスは神経毒性炎症の連鎖を引き起こし、病気の進行を加速させます(Fogal, 2008;Meissner, 2010;van der Meer, 2010;Italiani, 2014;Olesen, 2020;Garofalo, 2022)。アストロサイトは、反応性フェノタイプを採用し、炎症関連遺伝子の発現を調節し、炎症環境に影響を与えることで神経炎症に寄与しますが、IL-1βの産生への直接的な関与はそれほど重要ではありません(Meissner, 2010;Garofalo, 2022)。
CSFと血清中のIL-1βのレベルは、特にC9orf72 ALSのような特定の遺伝的亜型において、病気のより進行した形態と相関しています。一方、IL-1βの組織特異的な効果は、散発性ALSにおいてより顕著です(Italiani, 2014;Olesen, 2020)。ALS患者におけるCSFの主成分分析は、IL-1βがIL-2、IL-6、IL-13、TNF-αなどを含む広範な炎症シグネチャの一部であることを示しています。
神経炎症が運動神経細胞の変性の主要な駆動因子か、それとも二次的な結果であるかについては、ヒトサンプルにおけるIL-1βの検出可能性の変動と、IL-1βの二重の役割(文脈やタイミングに応じて神経毒性または神経保護作用を示す)を考慮すると、依然として議論が続いています(Italiani, 2014;Boraschi, 2023;Femiano, 2024)。
全体として、IL-1βおよび関連する炎症性分子は、神経毒性、酸化ストレス、シナプス機能障害を介したメカニズムを通じて神経細胞の脆弱性に寄与し、炎症がALSの進行要因の一つであることを示しています。
神経変性疾患の治療において、IL-1βを標的とする治療介入にはどのようなものがありますか?
IL-1βは、さまざまな神経変性疾患に関連する神経炎症において重要な役割を果たしています。そのため、IL-1βは神経炎症を軽減する目的で標的とされており、主にIL-1受容体拮抗薬(IL-1Ra)が使用されています。主なIL-1Raの選択肢には以下のものが含まれます:
- アナキンラ:これは、IL-1αとIL-1βの両方の活性を阻害するヒト由来のIL-1Raです。
- リロナセプト:この薬剤は、ヒトIL-1R1とIL-1R3の細胞外領域とヒトIgG1のFc領域を結合させ、IL-1αとIL-1βの長期的な阻害を誘導します。
- カナキヌマブ:これは、IL-1βを特異的に標的とするヒトモノクローナルIgG1抗体です。
- 3xTg-ADマウスにIL-1受容体阻害抗体を慢性投与すると、脳炎症の軽減、認知機能障害の緩和、タウ病理の軽減が示され、特定の形態のアミロイド-βのレベルが部分的に低下しました。これらの変化は、NF-κB活性の低下とリン酸化タウおよびタウキナーゼのレベルの低下と相関していました(Kitazawa, 2011)。
- IL-1βはアミロイドβのクリアランスに必要であるため、IL-1β阻害によるAD治療の混合結果の一部を説明できる可能性があります(Rivera-Escalera, 2019)。
異なるラットのパーキンソン病モデルにおいて:
- アナキンラの末梢投与とIL-1RaのAAV過剰発現は、ドーパミン神経変性およびプロ炎症性サイトカインの減少に有望な結果を示しました(Dzamko, 2023)。
- 6-ヒドロキシドーパミン曝露後に黒質(SN)にリポ多糖を注射すると、神経変性および運動症状が増加しましたが、IL-1Ra治療により抑制されました(Koprich, 2008)。
- SOD1トランスジェニックマウスにおける前臨床研究では、アナキナラが病気の活動期において生存期間を延長し、運動機能を改善することが示されました(van der Meer, 2010;Meissner, 2010)。
- ALSマウスモデルにおいてIL-1Raを阻害することは、生存期間を延長するが、病気の発症には影響を与えないことが示されています(Maier, 2015)。
- IL-1βを阻害すると神経炎症が軽減されますが、中枢神経系(CNS)への薬物浸透が不良であることや、治療を中和する抗体が迅速に発達するなどの問題のため、これらの知見をヒトのALSに適用することは困難です。CNSに効果的に到達するためには、アナキンラの高用量が必要となります(van der Meer, 2010;Maier, 2015)。
IL-1βのレベルとミクログリアの活性化を減少させる他の治療法には、デキサメタゾン(抗炎症ステロイド)とMCC950(NLRP3阻害剤)の投与が含まれます(Pott Godoy, 2008;Liu, 2022)。
要約すると、IL-1β依存性炎症を標的とする治療法は治療の可能性を秘めています。しかし、IL-1βの多機能性(毒性と保護作用の両方)の複雑さは、一般的な抗IL-1β療法の効果が限定的である可能性を示唆しています。IL-1βを標的とする最近の治療法であるリロナセプトとカナキヌマブは、現在研究中で、神経変性疾患の将来的な治療法として有望です。
インターロイキン-1β(IL-1β)に関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報については、お気軽にお問い合わせください。
当社の神経変性疾患モデルについて詳しく見る
関連コンテンツ
神経変性疾患の動物モデルにおける治療薬の評価に関する、インターロイキン-1ベータ(IL-1β)の最新情報とベストプラクティス。
インフラマソームとは何ですか?
炎症小体(インフlammasome)の概要:その作用機序、疾患における役割、および薬物開発における標的化について。
NLRP3とは何ですか?
NLRP3およびNLRP3炎症小体活性化トリガー、疾患関連、および治療的標的戦略の概要。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。