ALSのTDP-43ΔNLS (rNLS8) マウスモデルにおける NMJ の脱神経
バイオスペクティブ社は神経筋接合部(NMJ)染色およびNMJ解析に関して、どのようなサービスを提供しておりますか?
神経筋接合部(NMJ)は、以下のような多様な神経疾患および筋疾患において影響を受けます:
- 筋萎縮性 側索硬化症 (ALS)(Verma, 2022)
- 重症筋無力症(Vincent, 2002)
- シャルコー・マリー・トゥース病 (Cipriani, 2018)
- 脊 髄性 筋萎縮症(SMA)(Murray,2010)
- デュシェンヌ型 筋ジストロフィー(DMD) (Pratt, 2015)
神経筋接合部(NMJ)の特徴、例えばNMJの神経支配や脱神経などの定量分析は、 特にALS病態およびその他の神経筋疾患モデルにおけるNMJ病態に関して、疾患の進行や治療介入への反応を理解する上で極めて重要です 。バイオスペクティブ社のチームは 、筋組織切片からのNMJに対する多重免疫蛍光染色および定量的画像解析のための堅牢な手法を開発しており 、 ALS神経筋接合部研究のための 最適化も含まれております 。
バイオスペクティブ社の神経筋接合部(NMJ)染色および解析のプロセスについてご説明いたします。
神経筋接合部(NMJ)の染色および解析プロセスについて
バイオスペクティブでは、ホルマリン固定筋からの神経筋接合部(NMJ)の染色および分析のために、標準化され再現性の高い多段階プロセスを導入しております:
1. 組織切片作成
- 筋肉組織をOCTに包埋した後、凍結し-80℃で保存いたします
- 専用マイクロトームを用いて高品質な固定凍結組織切片を作成します
- 切片は 染色工程中の 剥離防止のため、高性能ガラススライド に固定します
2. 組織切片の多重免疫蛍光神経筋接合部(NMJ)染色
- 以下の多重染色を実施しております:
- シナプス前終末(SV2A)
- 運動終板(α-ブンガロトキシン)
- 神経支配軸索(β-III-チューブリン)
- 染色は、 一貫性と再現性を確保するため、高ス ル ープットの自動免疫組織化学/免疫蛍光装置 を用いて実施しております
3. スライドスキャン
- デジタルスライドスキャナーを用いて、全切片を超高空間分解能でデジタル化いたします
- 得られた画像は 可視化と定量解析の両方に 使用されます
4. 画像セグメンテーション、神経筋接合部(NMJ)の定量化および解析
- 当社のイメージング科学者は、シナプス前終末(SV2A)、運動終板(α-ブンガロトキシン)、および神経支配軸索(β-III-チューブリン)のための高度な完全自動セグメンテーション手法を開発しました
- 当社の神経筋接合部解析ツールにより 、高スループットかつ低バイアスな 神経筋接合 部の定量化が可能です
- 分割された画像から様々な定量指標を導出し 、 神経筋接合部の形態 および 機能状態を 特徴づけます
検体採取・調製・発送に関するガイドライン
サンプルの完全性とデータの信頼性を確保するため、包括的なサポートを提供いたします:
- サンプル採取:動物には冷たいPBSおよび/または10%中性緩衝ホルマリンを用いて灌流を行い、筋肉組織を慎重に採取してください。
- サンプル調製:筋 組織は10%中性緩衝ホルマリンで短時間固定後、急速凍結してください。
- サンプルの発送:サンプルは 断熱容器を使用し、ドライアイスで 発送してください 。凍結融解を繰り返さないようご注意ください。
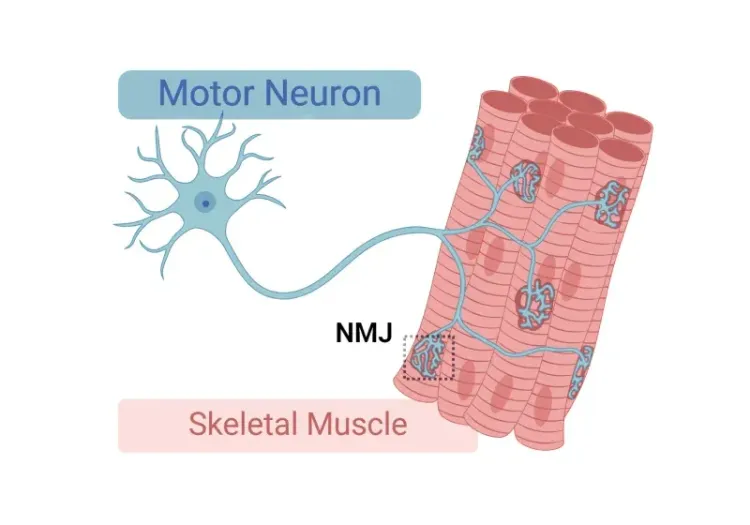
神経筋接合部 (NMJ)の主要構成要素を示す模式図 。これには、 前シナプス 運動ニューロン終末、後シナプス運動終板、終末 シュワン細胞、 クラノサイトが含まれます 。略語:神経筋接合部(NMJ)、アセチルコリン(ACh)、 アセチル コリン受容体(AChR)。
神経筋接合部(NMJ)とは何でしょうか?
神経筋接合部(NMJ)とは 、 運動ニューロンと骨格筋線維との間の通信を可能にし 、精密な筋肉収縮を実現する 特殊なシナプスです 。 前シナプスの運動ニューロン終末は 、電気信号に応答して アセチルコリン(ACh)を放出します 。このアセチルコリンは 、筋膜の 運動終板 にある受容体に結合し 、活動電位を誘発し、 それに続く 筋肉収縮 を引き起こします 。
なぜ神経筋接合部を分析するのか?
- 病変の早期発生部位:複数の神経変性疾患において、運動ニューロンの喪失に先立ってNMJが影響を受けます(「逆行性変性」プロセス)。
- 定量的な評価:前臨床モデルにおいて、神経脱落、リモデリング、治療反応のモニタリングを可能にします。
- 実験的にアクセスしやすい:末梢の体内に位置するため、強力なイメージングと分析が可能であり、シナプスの完全性を高解像度で評価することを容易にします。
本動画では、当社の神経筋接合部(NMJ)染色および解析技術の概要をご紹介いたします。また、筋萎縮性側索硬化症(ALS)マウスモデルにおけるNMJ脱神経の具体例を交えながら、当社のサービスが神経変性の測定、疾患進行のモニタリング、ならびに前臨床試験における治療法の評価にどのように活用できるかを実証しております。
リンクをコピーするにはクリックしてください
動物モデルにおける神経筋接合部(NMJ)解析の意義とは何でしょうか?
神経筋接合部(NMJ)は、複数の神経筋疾患において、神経支配の変化、形態学的変化、変性に非常に敏感です。動物モデルにおけるNMJ解析により、研究者は疾患の進行をモニタリングし、前臨床試験において実験的治療薬の有効性を評価することが可能となります。
当社では、検証済みのイメージングプラットフォーム、科学的専門知識、豊富な経験を活かし、多様なモデルや種において、堅牢で再現性の高いNMJ定量化を提供しております。ここでは、新規治療介入の試験に日常的に用いているALSマウスモデルにおけるNMJの変化について、特にご説明いたします。
筋萎縮性側索硬化症(ALS)モデルと ALS神経筋接合部病理
ALS(または運動ニューロン疾患[MND])の最適な動物モデルは、以下の主要な特徴を備えている必要があります:
- ヒトのALS/MNDと類似した症状(運動機能障害および神経筋接合部の脆弱性を含む)
- 進行性の病態経過(病理学的経時変化の研究を可能とする)
- 疾患修飾性(病態進行を変化させる介入を可能とする)
- 前臨床研究に適した年齢層の動物の利用可能性
- 個体間の変動性が低く、コホート間で再現性のある結果が得られること
TDP-43ΔNLS (rNLS8) モデル
TDP-43ΔNLS (rNLS8)モデルマウスは これらの基準を満たしており、 ALS治療薬開発において魅力的なシステムとなります。本モデルでは、 核局在シグナル(NLS)に欠陥を持つヒトTDP-43が発現され、これにより核内輸送が阻害され、 神経細胞内で TDP-43が細胞質に蓄積します 。 時間の経過とともに、 この局在異常を起こした タンパク質は リン酸化TDP-43凝集体を 形成し 、 ALS患者で観察される主要な病理学的特徴を再現します 。
バイオスペクティブ社では、TDP-43タンパク質病変のrNLS8 ALSマウスモデルについて、オリジナル版と改良版の両方を活用しております:
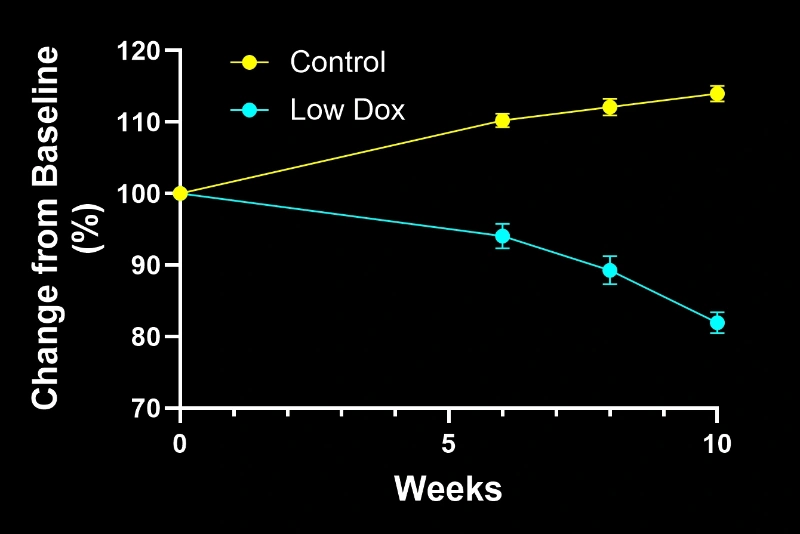
- オリジナルマウスモデル(「オフドキシル」):数週間で急速に進行する疾患
- バイオスペクティブマウスモデル(「低ドキシル」):数ヶ月にわたる緩やかな進行性疾患
いずれのモデルも、以下の進行性病理を呈します:
- 運動ニューロンの変性および局所的な脳萎縮
- 細胞質内TDP-43蓄積およびリン酸化TDP-43凝集体
- 運動機能障害
- 脳、脊髄、神経筋接合部(NMJ)の病理
詳細については、当社のリソースをご覧ください:
ALSのTDP-43ΔNLS(rNLS8)マウスモデルにおいて、神経筋接合部(NMJ)はどのように影響を受けるのでしょうか?
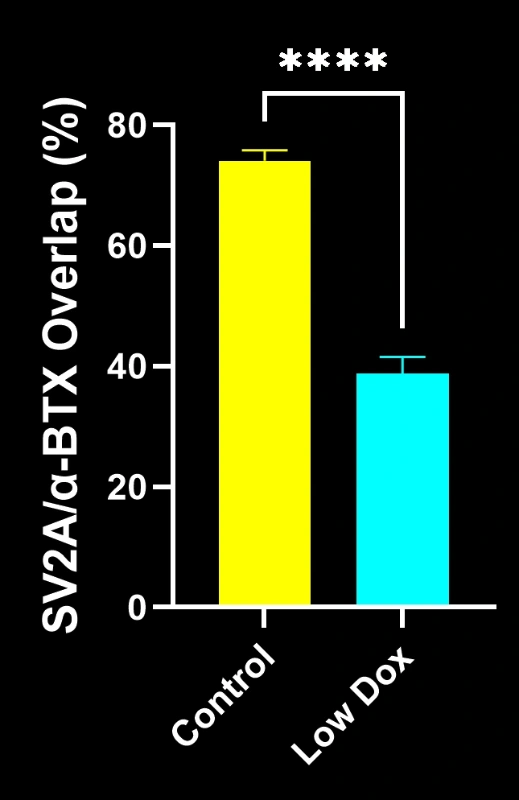
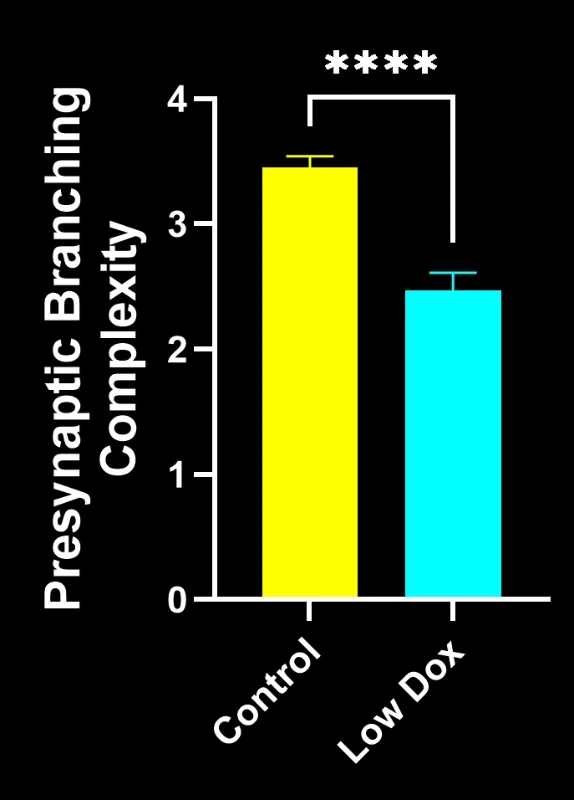
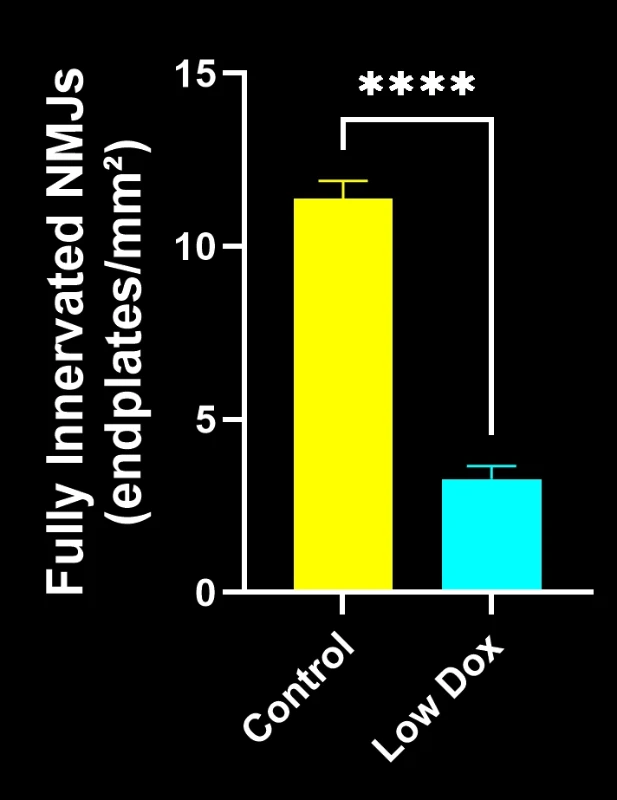
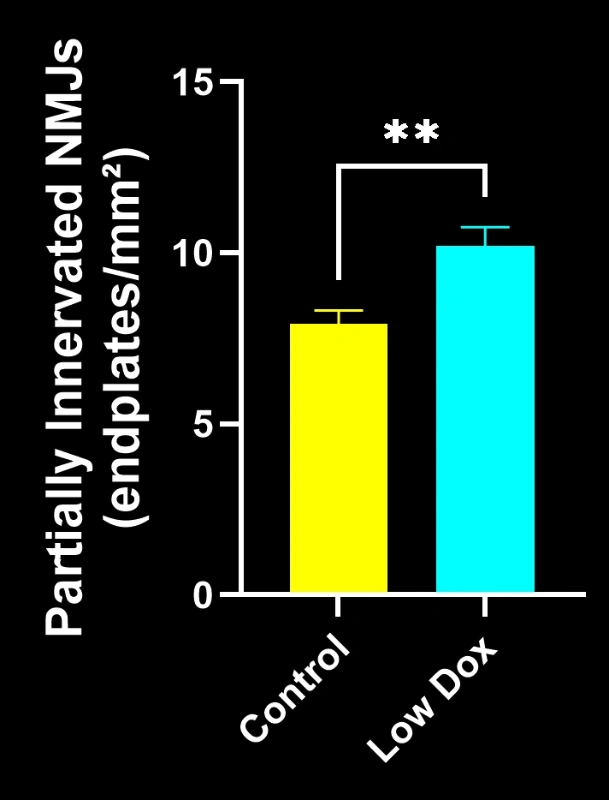
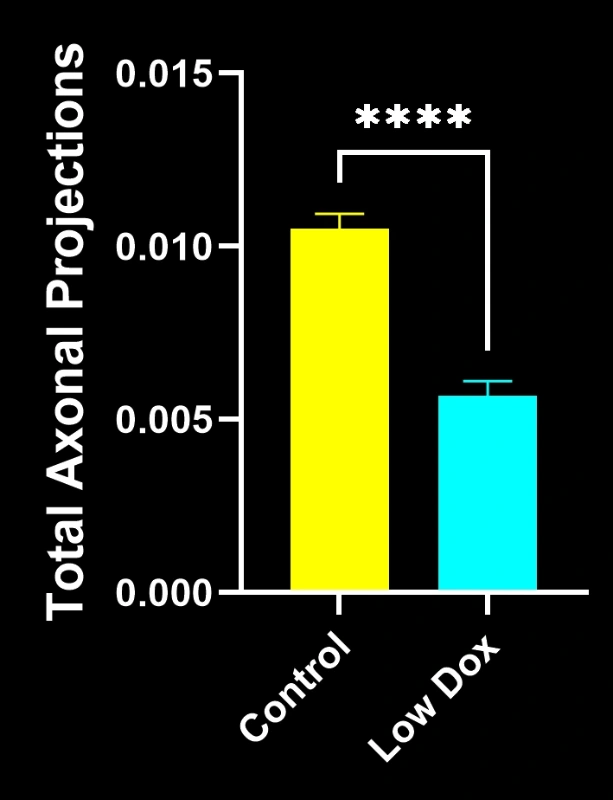
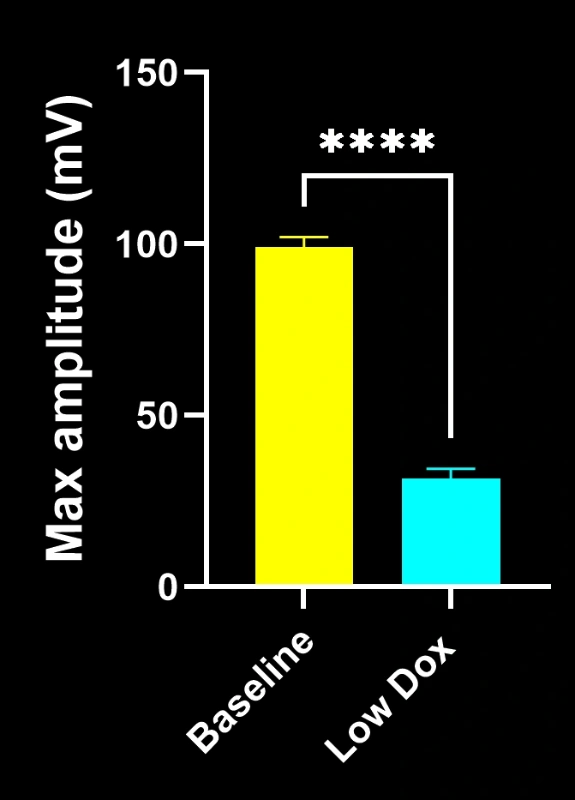
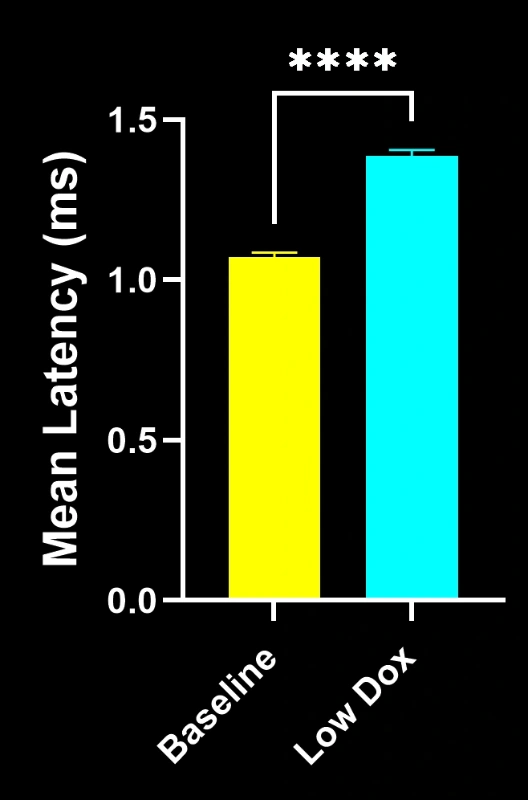
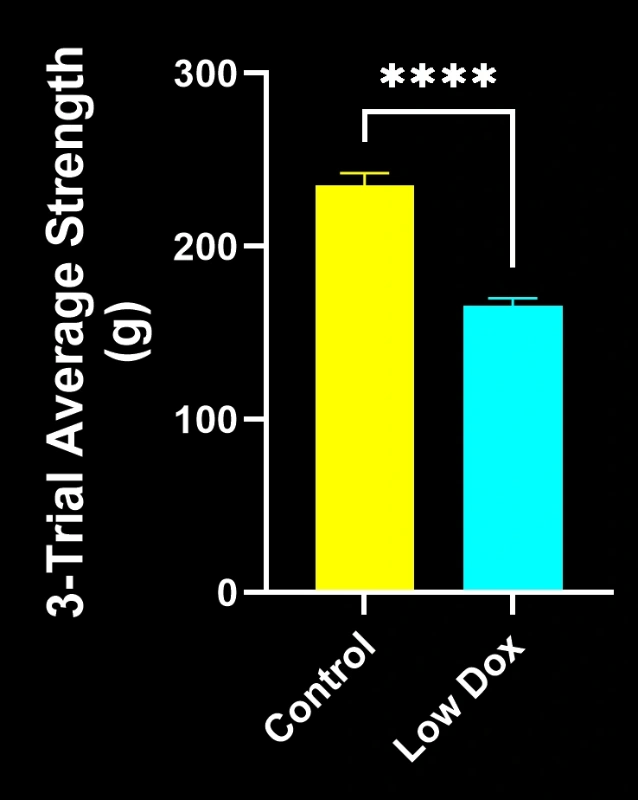
バイオスペクティブ社の研究科学者らは、TDP-43トランスジェニックマウスモデルにおいて、神経筋接合部(NMJ)の完全性と脱神経化について厳密な評価を実施いたしました。本研究では、モデル誘導後8週目の時点で、tTA対照マウスと「低ドキソルビシン」rNLS8マウスを比較いたしました。
本研究により以下のことが明らかになりました:
- SV2A/α-ブンガロトキシン共局在の顕著な減少が認められ、神経筋接合部(NMJ)の脱神経を示唆しています
- 軸索投射総量の減少
- 前シナプス構造の単純化(ALS様シナプス病変を反映)
これらの知見は、神経筋接合部における進行性のシナプス機能障害を浮き彫りにし、ALSにおける神経筋接合部保護を標的とした治療介入の臨床前評価に本マウスモデルが有用であることを支持するものです。
下記の「画像インタラクティブ」では、当社のNMJ解析結果をご覧いただけます。これには、 Biospective社の「Low Dox」TDP-43ΔNLS (rNLS8) マウスモデルおよび対照マウスの筋肉組織における高解像度多重免疫蛍光切片が含まれます 。
画像の移動はマウスの左ボタンで行えます。拡大・縮小は マウス/トラックパッド(上下)または左上隅の「+」「-」ボタンで操作 可能です。右上隅のコントロールパネルでは 、各チャンネルの表示切り替え(オン/オフ)、色変更、画像設定の調整が行えます。
最適なインタラクティブ体験 のため、フルスクリーンモード でのご利用をお勧めいたします。
画像インタラクティブによる神経筋接合部(NMJ)解析結果の表示。Biospective社の「Low Dox」TDP-43ΔNLS(rNLS8)マウスモデルから得られた高解像度多重免疫蛍光筋組織切片を、対照組織と共に提示。
Click to copy link
自動化はどのように結果を改善するのでしょうか?
当社は 、 高度な ハイスループットイメージングおよび定量プラットフォーム を用いた 自動神経筋接合部染色・解析技術を採用しております 。この手法により 、 複数のサンプルおよび実験条件にわたって、神経筋接合部の構造と完全性を正確 かつ再現性高く評価 することが可能となります 。
手動と自動による神経筋接合部(NMJ)の染色・解析の比較
|
特徴 |
手動 |
自動化 |
|
染色の一貫性 |
抗体インキュベーション時間のばらつきと試薬の分布ムラ |
厳密に制御されたタイミング、温度、試薬の塗布 |
|
処理能力と効率性 |
時間がかかり、分析できるスライド数が限られる |
高スループット染色、イメージング、およびデータ処理 |
|
再現性 |
染色および解析における操作者依存性の変動 |
標準化されたプロトコルとアルゴリズム駆動型NMJ定量化 |
|
データの正確性および |
主観的な神経筋接合部(NMJ)評価;定量的な精度が限定的 |
自動化されたセグメンテーション・局在化および形態学的解析 |
|
形態学的プロファイリング |
神経筋接合部(NMJ)のサイズ、形状、複雑性の手動測定 |
神経筋接合部(NMJ)の面積、周囲長、分岐、複雑性指標の自動抽出 |
|
空間マッピング |
選択された関心領域(ROI)に限定されます |
神経筋接合部(NMJ)の分布とシナプスカバレッジの全切片マッピング |
本表では、染色の一貫性、処理能力と効率性、再現性、データの正確性と分析の深さ、形態学的プロファイリング、空間マッピングといった主要な基準に基づき、神経筋接合部(NMJ)の染色および分析における手動と自動の比較を行っております。
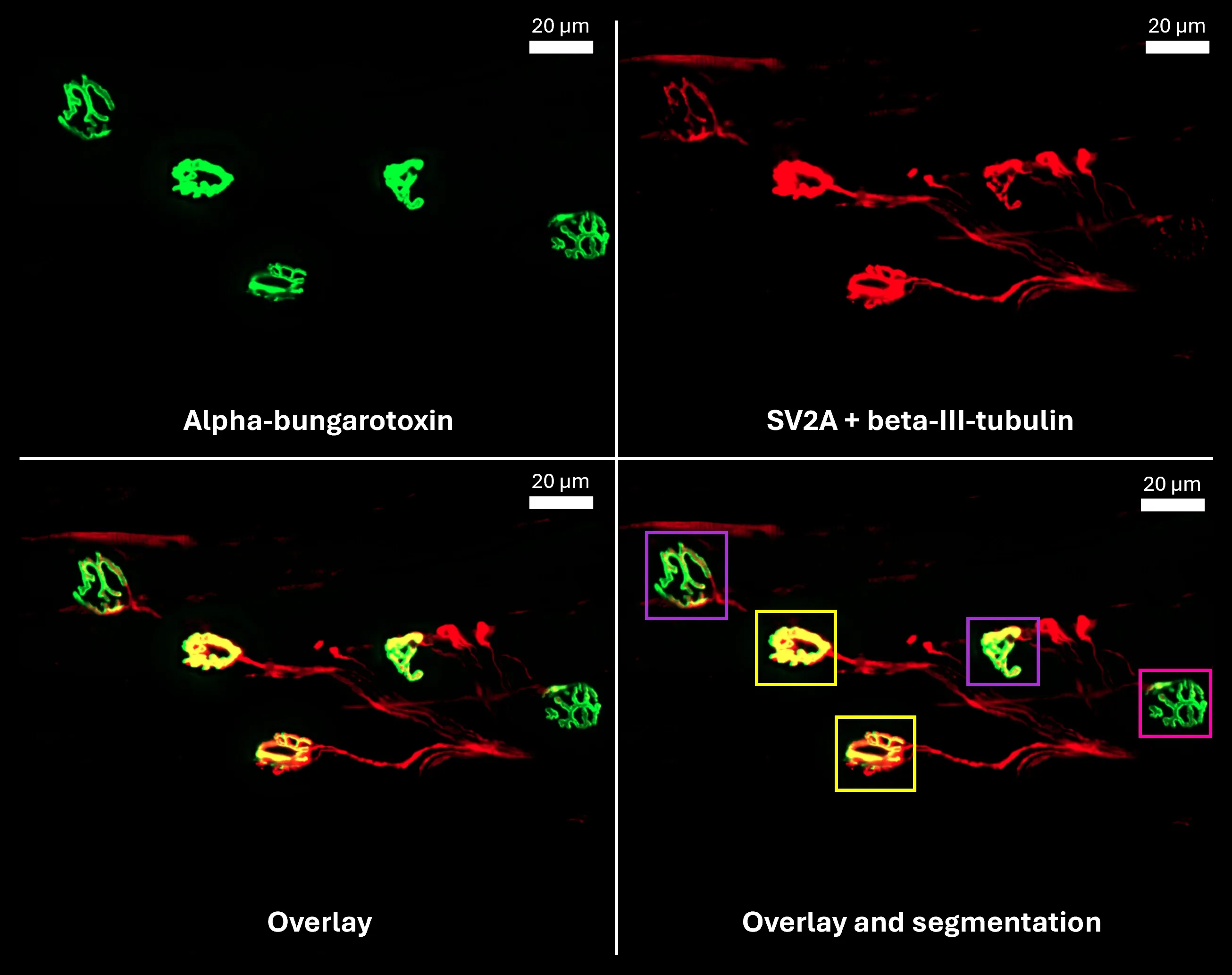
バイオスペクティブ社で開発されたプロセスを用いた自動染色および画像解析を施した、マウス筋の神経筋接合部(NMJ)の例示画像です。
神経筋接合部(NMJ)の染色および定量サービスに関するご要望や見積もりのお問い合わせにつきましては、お気軽にご相談ください。
関連コンテンツ
神経筋接合部(NMJ)の染色および解析サービスに関する最新情報。
神経筋接合部(NMJ)の形態と筋萎縮性側索硬化症(ALS)モデル
神経筋接合部(NMJ)の構造、筋萎縮性側索硬化症(ALS)におけるその役割、NMJの形態学的変化の研究に使用されるツールと方法についての洞察。
ALSマウスモデルを用いた創薬
治療薬の前臨床試験における筋萎縮性側索硬化症(ALS)の研究用動物モデル(マウスおよびラットモデル)の最も効果的な使用方法についてのガイド。
ALSマウスモデルと脊髄運動ニューロン
筋萎縮性側索硬化症(ALS)のマウスモデルにおける脊髄運動ニューロンと疾患進行の関わりについての概要。
TDP-43 ΔNLS (rNLS8) ALS 治療薬開発用マウス
このリソースは、ALSのΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43トランスジェニックマウスモデルの使用に関する情報を提供しており、前臨床治療研究に役立てることができます。