TDP-43 トランスジェニックモデル
細胞質TDP-43(TDP43;TARDBP)凝集体は、家族性および散発性筋萎縮性側索硬化症(ALS)の典型的な特徴です。弊社では、TDP-43タンパク質異常症のALSモデルである遺伝子導入型rNLS8(またはΔNLS;デルタNLS;dNLS)ALSモデル(「TDP-43モデル」)を用いた各種サービスを提供しています。これらのALSマウスを用いた当社の研究では、数週間で急速に進行する元のマウスモデル(「オフ・ドックス」)と、Biospective社が開発した進行がより緩やかな代替バージョン(「ロー・ドックス」)を使用しています。
Off DoxモデルとLow Doxモデルの両方において、TDP-43凝集体の細胞質への局在異常、進行性の運動障害、運動ニューロン変性および脳の局所的萎縮、神経炎症(活性化ミクログリアおよび反応性アストロサイト)、筋萎縮および変化したCMAP、ならびに脳、脊髄、神経筋接合部の病理が認められました。
ALSモデルのヒト疾患への応用可能性
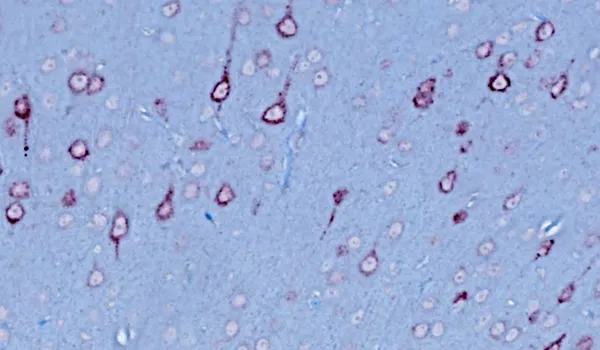
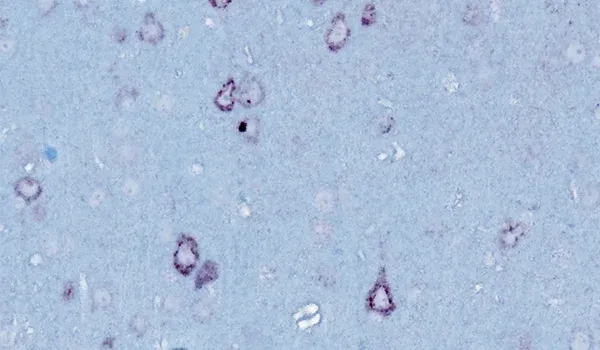
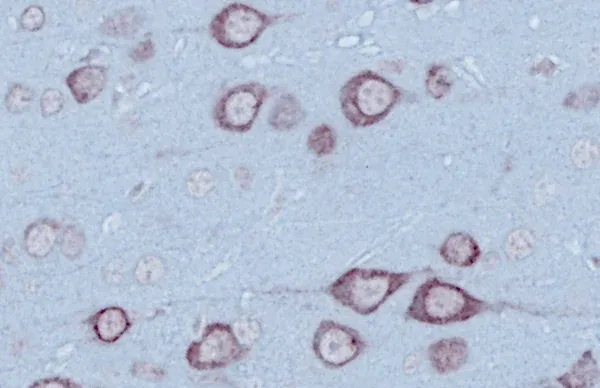
ミスフォールドタンパク質凝集体
TDP-43やSOD1などのミスフォールドタンパク質の凝集体は、孤発性および家族性のALSの神経病理学的特徴です。ALSの97%以上の症例で、TDP-43の凝集体が脳や脊髄のニューロンの細胞質に局在異常を起こしていることが確認されています(Arnold, 2023)。リン酸化凝集体もまた典型的に観察されます。これらの特徴は、当社のTDP-43ΔNLSマウスモデルでも容易に観察されます。
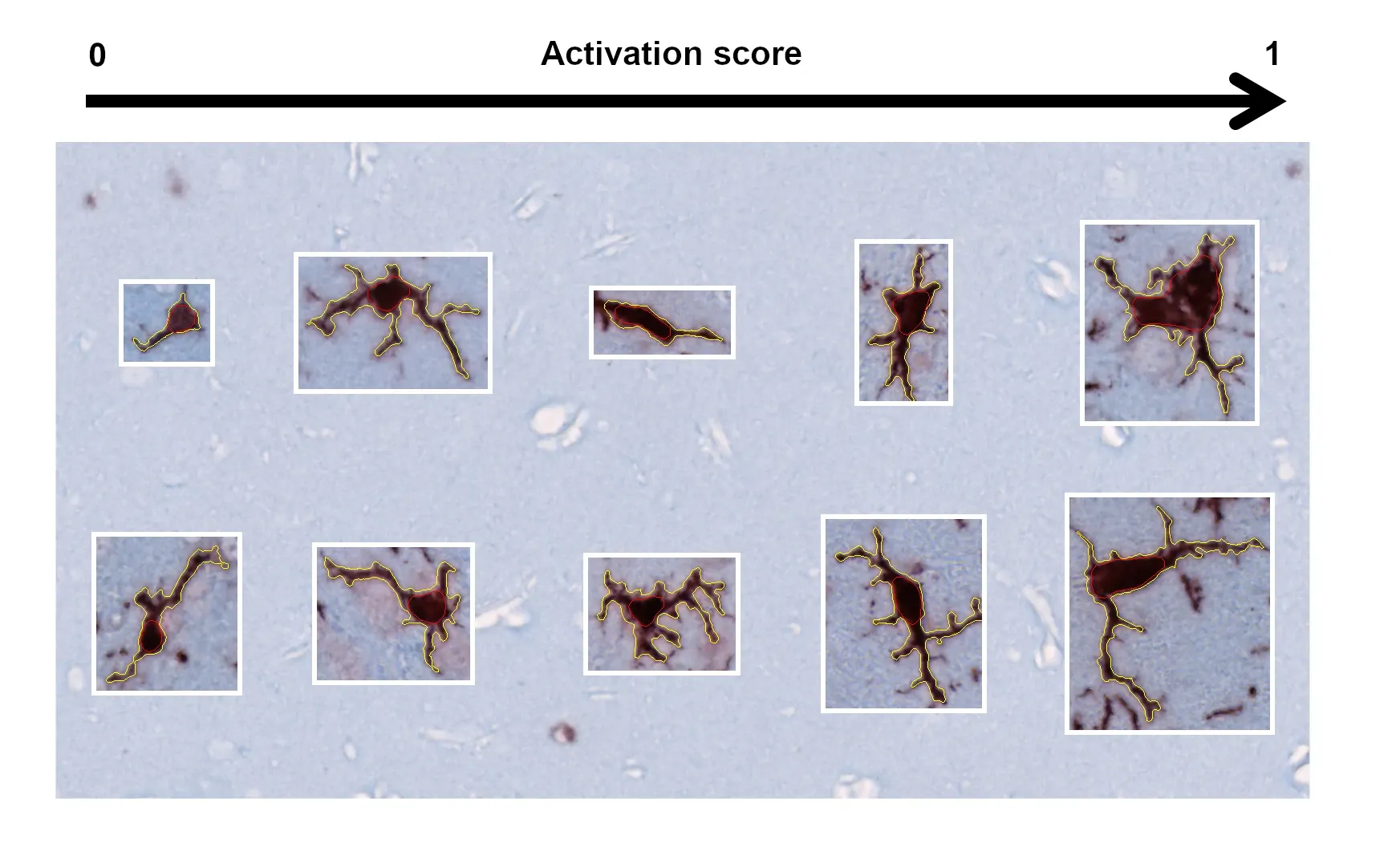
活性化ミクログリアおよび反応性アストロサイト
活性化ミクログリアと反応性アストロサイトは、ALS患者の脳と脊髄における顕著な神経炎症の特徴であり、病気の発症に重要な役割を果たしていると考えられています(ClarkeおよびPatani、2020年;Yang、2024年)。我々は、TDP-43マウスモデルにおいて、時間経過に伴う神経炎症の増大を観察しています。Iba-1およびGFAP免疫反応性の増加に加え、我々が開発したアルゴリズムを用いて、ミクログリアおよびアストロサイトの形態を測定したところ、活性化と運動表現型との間に強い関連性があることが分かりました。
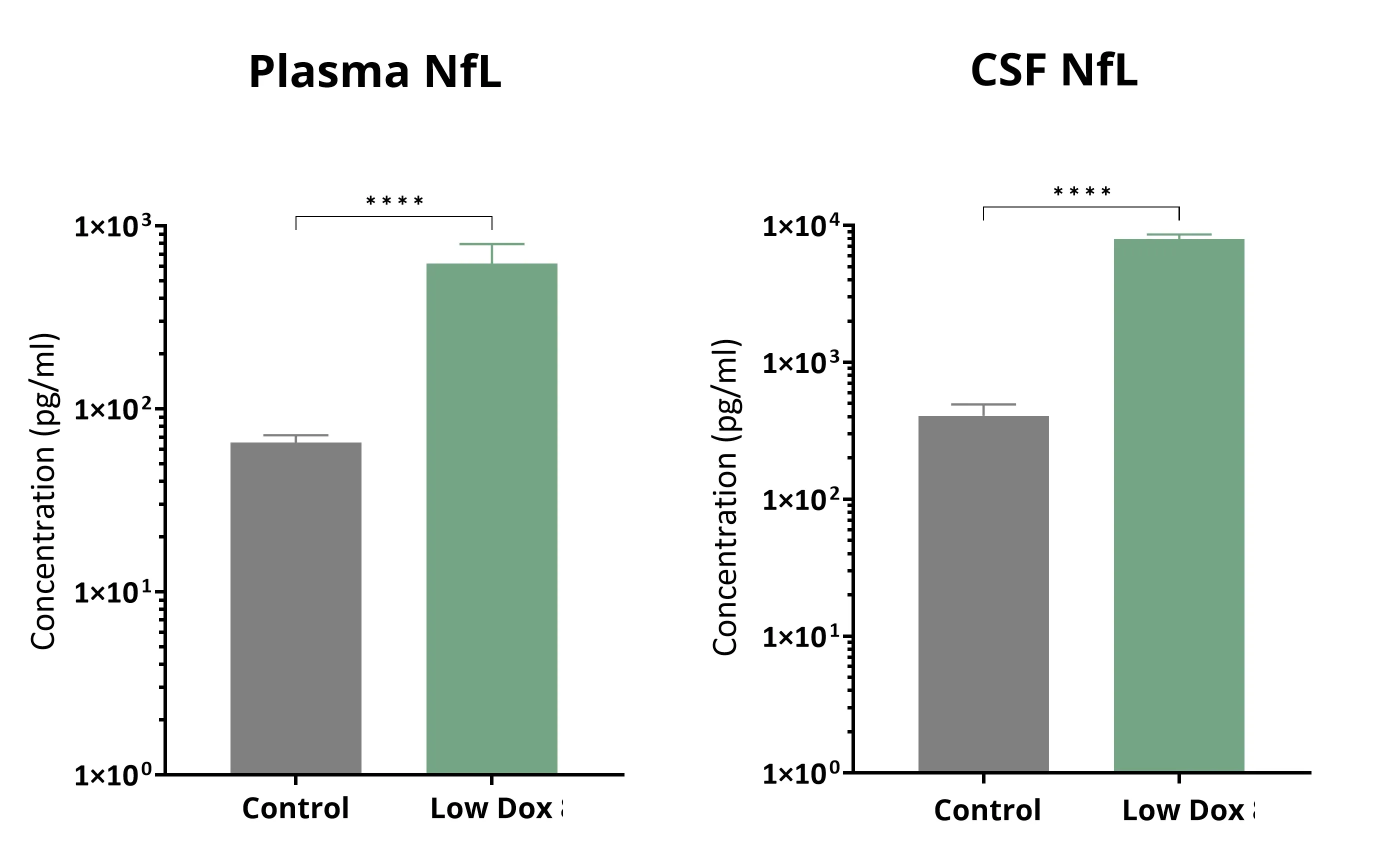
血漿および脳脊髄液中の軽度ニューロフィラメントの増加
ニューロフィラメント軽鎖は、ALS患者の血漿および脳脊髄液で増加します(Benatar, 2023)。ニューロフィラメント軽鎖の測定は、ALSの臨床試験で日常的に使用されています。ニューロフィラメント軽鎖レベルの低下を根拠としたトフェルセン(Qalsody)の早期承認は、この測定法が疾患バイオマーカーとしてFDAに認められたことを示しています。我々は、TDP-43マウスモデルにおいて、ニューロフィラメント軽鎖の血漿および脳脊髄液レベルの著しい増加を観察しています。 Young 氏らは 、低用量ドキソルビシン(Low Dox)TDP-43ΔNLS モデルにおいて、低分子 PIKfyve 阻害剤である AIT-101(INN:アピリモド、別名 LAM-002A)がニューロフィラメント軽鎖レベルを減少させる能力 を実証しました 。
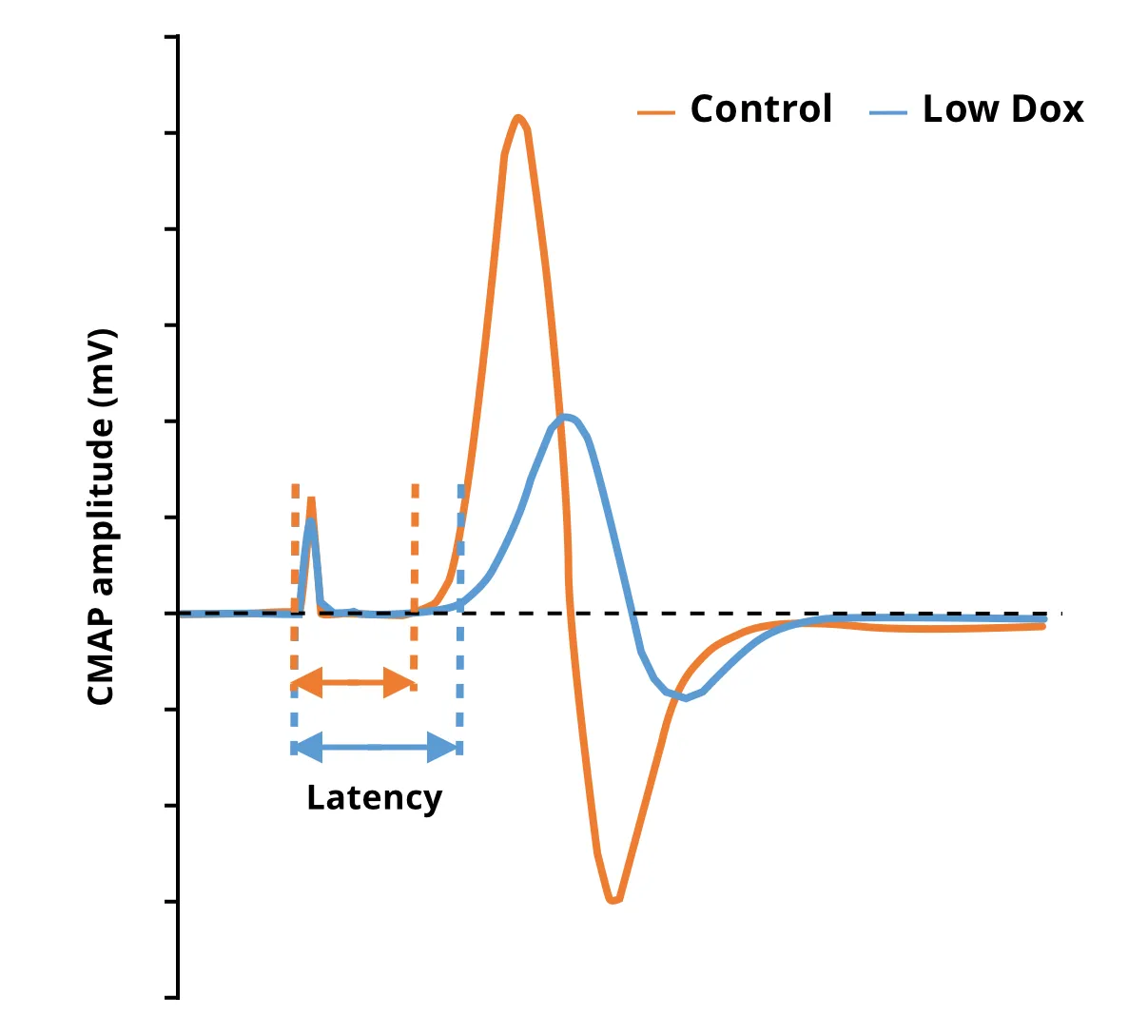
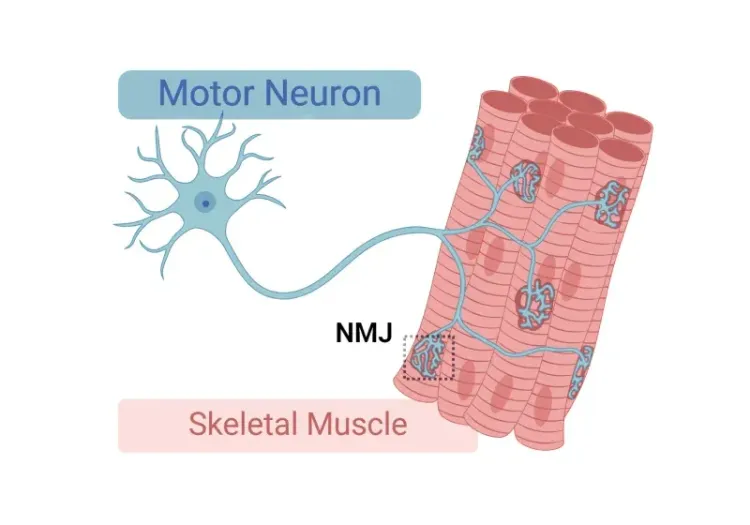
NMJ の脱神経および形態学的変化
電気生理学(例:筋電図検査[EMG])は、ALS患者の診断および病状のモニタリングに用いられる標準的な検査です。複合筋活動電位(CMAP)などのEMG測定値の低下は、脊髄運動ニューロン(Sleutjes, 2021)の損失による神経筋の脱神経を反映しています。また、筋萎縮性側索硬化症(ALS)患者の筋肉では、神経筋接合部(NMJ)の脱神経および形態学的変化も確認されています(Bruneteau, 2015)。当社の「低Dox」TDP-43ΔNLSモデルでは、コントロールマウスと比較してCMAP振幅の大幅な減少と遅延時間の増加が確認されています。多重免疫蛍光法を使用して、脱神経と一致するNMJの変化も確認されています。
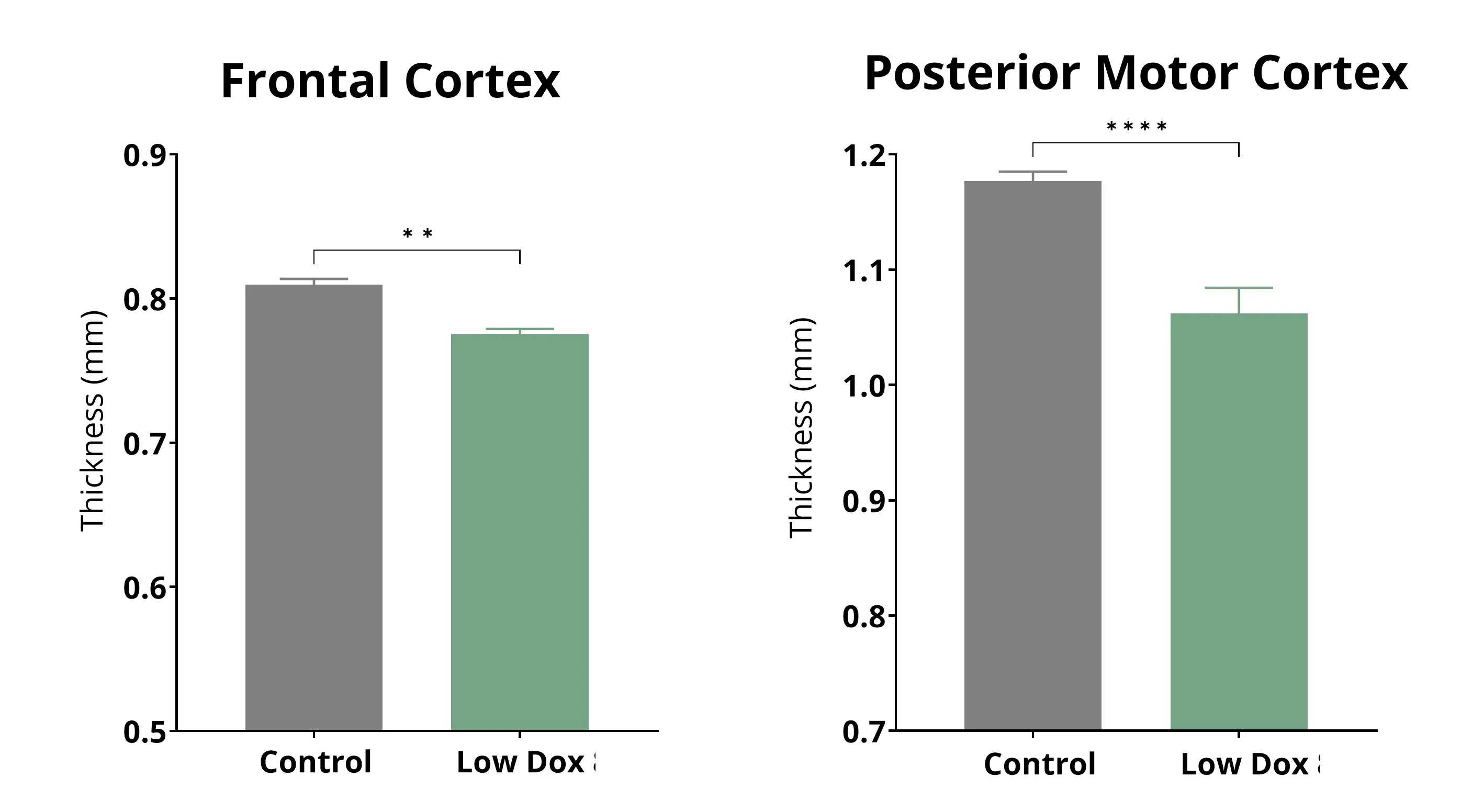
地域別脳萎縮
神経画像バイオマーカーは、ALSを含む神経変性疾患の臨床試験で広く使用されています。MRIから得られた局所容積および皮質厚の測定値は、脳萎縮に対して非常に感度が高く、長期にわたる疾患の進行をモニタリングすることができます。ALSでは、運動および非運動の脳領域において皮質の薄化が認められています(Yang, 2025)。高解像度の全脳MRI画像取得と完全自動の画像処理および分析により、私たちは、低用量ドキソルビシンTDP-43ΔNLSマウスモデルにおいて再現性のある脳萎縮(特に運動皮質と前頭前皮質)を示しました。これにより、流動性に基づくニューロフィラメント軽鎖測定などの他の測定値を補完する、神経変性の強固な生体内測定値として役立ちます。
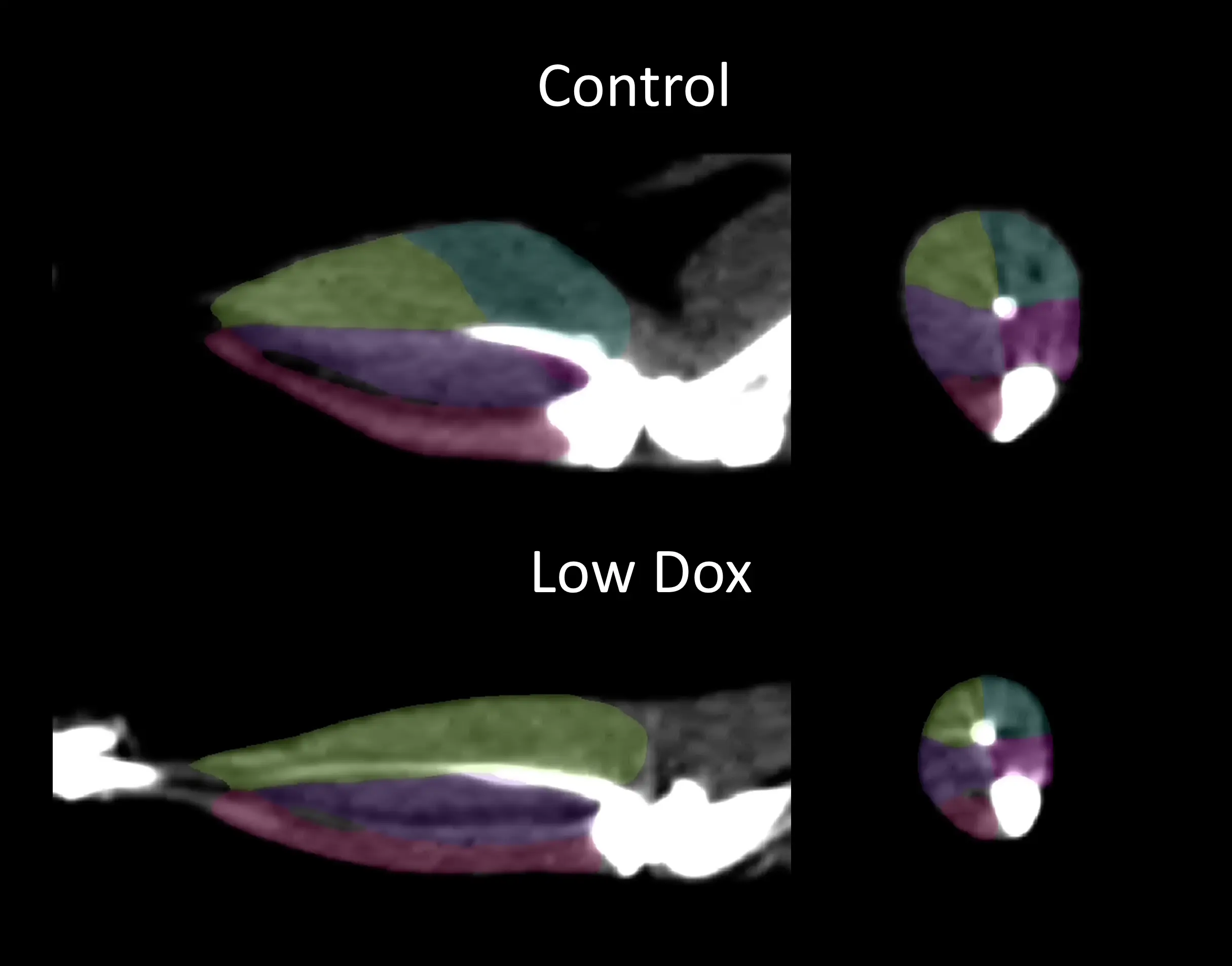
筋肉の消耗と衰弱
骨格筋の萎縮と筋力低下は、ALSの中心的な臨床的特徴です(Shefner, 2023)。 非侵襲的な画像化技術は、ALS患者の筋萎縮を定量化するために使用されてきました(Jenkins, 2013;Jenkins, 2018;Wilcox, 2021;Klickovic, 2024)。私たちは、マイクロCTを使用して、私たちのLow Dox TDP-43ΔNLSマウスモデルにおける後肢の筋肉減少の長期的な測定を行い 、コントロールマウスと比較して非常に有意な差異を見出しました。この筋肉の消耗は、握力計を使用して測定した筋力の低下を伴います。
これらのALSマウスモデルの特性評価、検証済みの測定方法、および前臨床神経科学CROサービスについて、さらに詳しく知ることができます。
関連コンテンツ
ALSに関する最新情報およびALS動物モデルにおける治療薬の評価に関するベストプラクティス。
神経筋接合部(NMJ)の形態と筋萎縮性側索硬化症(ALS)モデル
神経筋接合部(NMJ)の構造、筋萎縮性側索硬化症(ALS)におけるその役割、NMJの形態学的変化の研究に使用されるツールと方法についての洞察。
ALSマウスモデルと脊髄運動ニューロン
筋萎縮性側索硬化症(ALS)のマウスモデルにおける脊髄運動ニューロンと疾患進行の関わりについての概要。
ALSマウスモデルを用いた創薬
治療薬の前臨床試験における筋萎縮性側索硬化症(ALS)の研究用動物モデル(マウスおよびラットモデル)の最も効果的な使用方法についてのガイド。
TDP-43 ΔNLS (rNLS8) ALS 治療薬開発用マウス
このリソースは、ALSのΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43トランスジェニックマウスモデルの使用に関する情報を提供しており、前臨床治療研究に役立てることができます。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。