このリソースでは、以下について説明しています。
炎症小体とは何ですか?
炎症小体は、病原体や細胞ストレスシグナルを検出することで先天性免疫応答に重要な役割を果たす細胞質内の多タンパク質複合体です。これらの複合体は、病原体関連分子パターン(PAMPs)や損傷関連分子パターン(DAMPs)に応答して形成され、炎症の中心的調節因子として機能します。
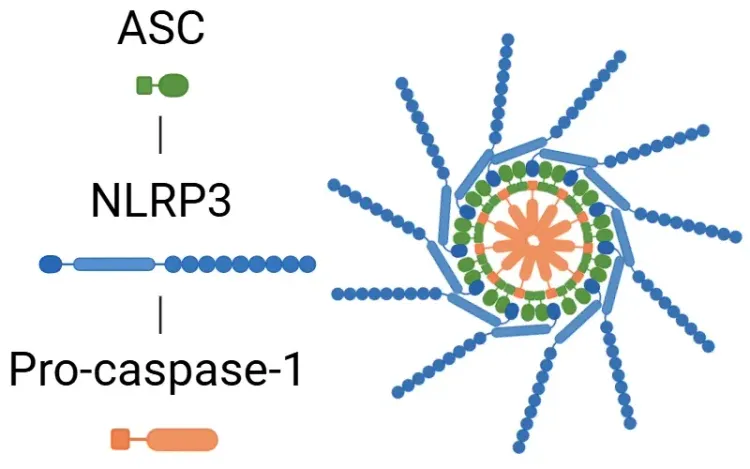
構造的には、炎症小体はセンサータンパク質(例えば、NLR(NOD様受容体)のようなNLRP1、NLRP3、NLRC4、またはメラノーマ欠損2(AIM2)受容体)から構成されています。活性化されると、これらのセンサーはアダプタータンパク質ASC(アポトーシス関連スペック様タンパク質でCARDドメインを含む)と効果酵素プロカスパゼ-1を募集し、活性型炎症小体複合体を形成します。ただし、すべての炎症小体が同じ組み立てプロセスをたどるわけではありません。例えば、NLRP1のCARDドメインはプロカスパゼ-1と直接相互作用し、ASCの必要性を bypass します(Lu, 2023)。
炎症小体活性化は一般的に、プライミングと活性化という2段階のプロセスを伴います。
- プライミングは通常、NF-κB経路などのシグナル伝達経路を介して、プロ-IL-1βやプロ-IL-18を含む炎症小体成分の発現を上昇させます(Lu, 2023;Liao, 2025)。
- 活性化は二次シグナルに応答して起こり、炎症小体複合体の組み立てとカスパーゼ-1の活性化を促します(Liu, 2018)。
既知の炎症小体の中で、NLRP3は、ATP、アミロイド-β(Aβ)凝集体、尿酸などの結晶性物質を含む広範な活性化トリガーを有するため、最も広く研究されています。追加のトリガーには、イオン流、リソソーム損傷、ミトコンドリア機能障害が含まれます。
参照:NLRP3とは何ですか?
他の炎症小体複合体は、より特異的なトリガーによって活性化されます:
- AIM2は細胞質DNAに反応します
- NLRC4は細菌のフラジェリンによって活性化されます
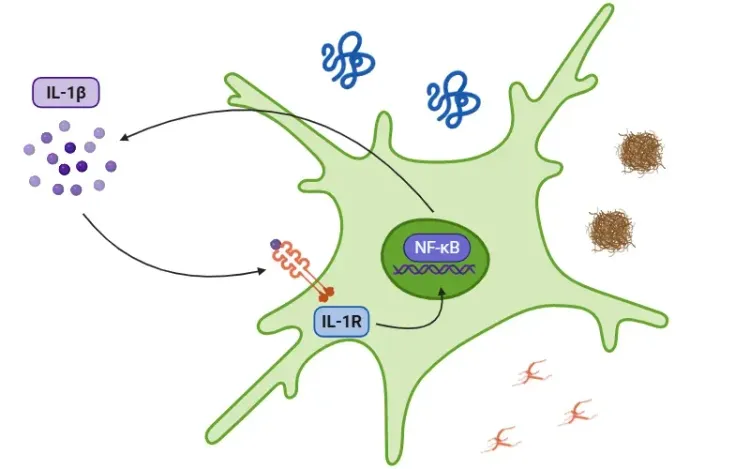
活性化されると、カスパーゼ-1は前駆体サイトカインであるプロ-IL-1βとプロ-IL-18を成熟型であるIL-1βとIL-18に切断し、これらは分泌されて炎症を拡大させます。カスパーゼ-1はまた、プログラムされた炎症性細胞死の一種であるピロプトシスを引き起こします。
IL-1βの役割について詳しく知りたい方は、「IL-1βとは何ですか?」をご参照ください。
炎症小体は宿主防御に不可欠ですが、慢性的なまたは調節不全の活性化は、自己免疫疾患、神経変性疾患、代謝症候群など、多様な疾患と関連しています(Guo, 2015)。
要約すると、炎症小体は先天性免疫の重要な調節因子です。しかし、病理的な炎症を防止するためには、その活性が厳密に制御される必要があります。
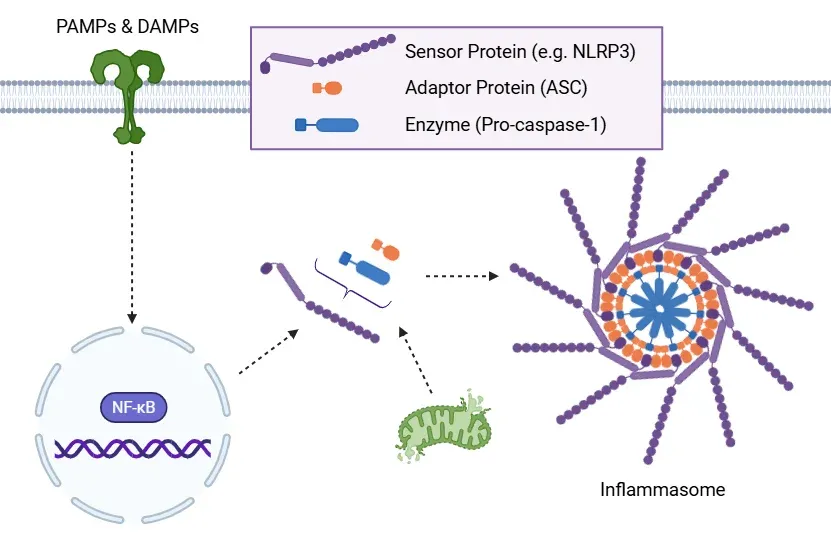
標準的な炎症小体活性化経路。
炎症小体活性化の概略図。プライミング中に、PAMP および DAMP が NF-κB シグナル伝達を活性化し、炎症小体成分の発現を増加させます。その後、ミトコンドリア不安定化などの要因によって活性化が引き起こされ、ASC およびプロカスパゼ-1 の動員により炎症小体が組み立てられます。
炎症小体(インフラマソーム)は疾患においてどのような役割を果たしていますか?
炎症小体は宿主防御に不可欠ですが、炎症小体の活動が過剰、持続的、または不十分な状態に乱れると、組織損傷、慢性炎症、免疫異常を促進し、数多くの急性および慢性疾患の発症に寄与する可能性があります。
疾患の病態における主要な役割
- 自己炎症性疾患と自己免疫疾患
- NLRP3の変異は、家族性寒冷自己炎症症候群(FCAS)やMuckle-Wells症候群(MWS)などの遺伝性自己炎症症候群と関連しています(Kuemmerle-Deschner, 2011;Chen, 2022)。
- NLRP1、NLRP3、およびAIM2の調節異常は、全身性エリテマトーデス(SLE)や関節リウマチ(Yi, 2018)などの自己免疫疾患と関連しています。
- がん
- AIM2炎症小体(インフlammasome)は、がんにおいて腫瘍抑制因子と腫瘍促進因子の両方の役割を果たし、文脈に応じて機能します。これらの役割は、大腸がん、肝がん、胃がんなどのがんにおいて観察されています(Alanazi, 2024)。
- 心血管疾患
- 動脈硬化において、コレステロール結晶はマクロファージ内のNLRP3を活性化し、プラークの炎症を促進します(Yalcinkaya, 2025)。
- NLRP3、NLRC4、およびAIM2は、心不全の進行に関与していることが示されています(Wu, 2021)。
- 代謝障害
- 2型糖尿病では、脂肪組織と膵島におけるNLRP3の活性化がインスリン抵抗性とβ細胞機能障害に寄与しています(Lu, 2023)。
- 肥満は、脂肪酸とミトコンドリア由来の活性酸素種(ROS)によるNLRP3の活性化により、慢性的な低グレード炎症を引き起こします(Ahechu, 2018)。
- 痛風は、NLRP3炎症小体(NLRP3 inflammasome)の強力な活性化因子であるモノナトリウム尿酸結晶によって引き起こされます(Kim, 2022)。
- 神経変性疾患
- 慢性的なNLRP3活性化は、アミロイドβ病理、タウの過リン酸化、および神経細胞損傷に寄与することで、アルツハイマー病(AD)の発症に関与しています(Li, 2025)。
- 最近の研究では、炎症小体(inflammasome)がパーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、多発性硬化症(MS)にも関与していることが示唆されています。
詳細な議論については、「NLRP3炎症小体と神経変性疾患」を参照してください。
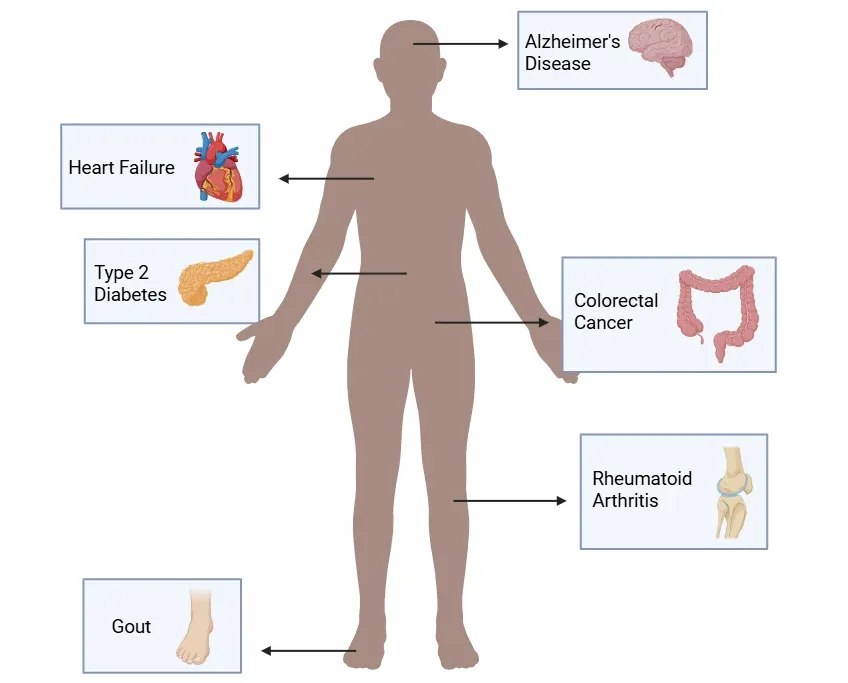
炎症小体活性化に関連する代表的な疾患。
炎症小体の調節異常は、神経変性疾患、心血管疾患、自己免疫疾患、代謝疾患など、幅広い疾患と関連しています。この図では、その主な例を紹介していますが、他にも多くの疾患が炎症小体経路に関与しています。
炎症小体(インフラマソーム)を標的とする療法はどのように作用するのでしょうか?
炎症小体(インフlammasome)を標的とする治療法は、炎症小体のシグナル伝達経路の重要なポイントを阻害することで、病的な炎症を抑制することを目的としています。現在のほとんどの戦略は、多くの炎症性疾患において中心的な役割を果たすNLRP3に焦点を当てています。
NLRP3の直接的阻害
- MCC950は、NLRP3の活性化を阻害し、IL-18とIL-1βの 放出を防止する選択的な小分子阻害剤です。複数の前臨床疾患モデルで有効性が示されています(Dempsey, 2017;Gordon, 2018;Gao, 2019)。
- ダパンストリル(OLT1177®)などの他の薬剤も研究中で、複数の早期臨床試験が進行中です(NCT06047262;NCT05658575)。
カスパーゼ-1阻害
- カスパーゼ-1阻害剤であるVX-765は、in vitroおよびin vivoにおいてサイトカイン産生とピロプトーシスの減少に有効性を示しています(McKenzie, 2018;Flores, 2020)。
IL-1β経路の阻害
炎症小体活性化下流のIL-1βシグナル伝達を阻害することは、確立された治療アプローチです:
- アナキンラ(IL-1受容体拮抗薬)
- カナキヌマブ(IL-1βを標的とするモノクローナル抗体)
- リロナセプト(可溶性デコイ受容体)
これらの薬剤は、さまざまな自己炎症性疾患に対して承認されており、心血管疾患や神経変性疾患を含むより広範な適応症に対する試験が行われています(Wu, 2021;Melchiorri, 2023)。
ピロプトシスとガスダーミンDを標的とするアプローチ
新興の研究では、ピロプトシスの主要な実行因子であるガスダーミンDが注目されています。ガスダーミンDを阻害することで、サイトカインシグナル伝達を維持しつつ炎症性細胞死を阻害する可能性があり、標的指向的で安全性の高い治療戦略となる可能性があります(Dai, 2023)。
要約すると、炎症小体標的療法は、多様な炎症性疾患および自己免疫疾患の治療に大きな可能性を秘めています。しかし、免疫防御におけるその不可欠な役割のため、これらの療法は、宿主の免疫機能を損なわないよう慎重に調整する必要があります。
当社のチームは、インフラマソームに関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて詳しく見る
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
NLRP3とは何ですか?
NLRP3およびNLRP3炎症小体活性化トリガー、疾患関連、および治療的標的戦略の概要。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。
インターロイキン-1ベータ(IL-1β)と神経変性疾患
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患におけるIL-1βの役割。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。