TDP-43 モデルの概要
細胞質TDP-43(またはTDP43)凝集体は、家族性および散発性ALSの顕著な特徴です。TDP-43凝集体を伴う筋萎縮性側索硬化症(ALS、運動ニューロン疾患[MND]とも呼ばれる)のトランスジェニック(Tg)マウスモデルはいくつか存在しますが、それぞれに長所と短所があります。ALSの動物モデルについては、リソース -創薬のためのALSマウスモデルで詳しく説明しています。
Biospectiveでは、TDP-43タンパク質異常症(「TDP-43モデル」)のALSマウスモデルであるrNLS8(またはΔNLS、delta NLS、dNLS)のオリジナル版と修正版の両方を使用しています。
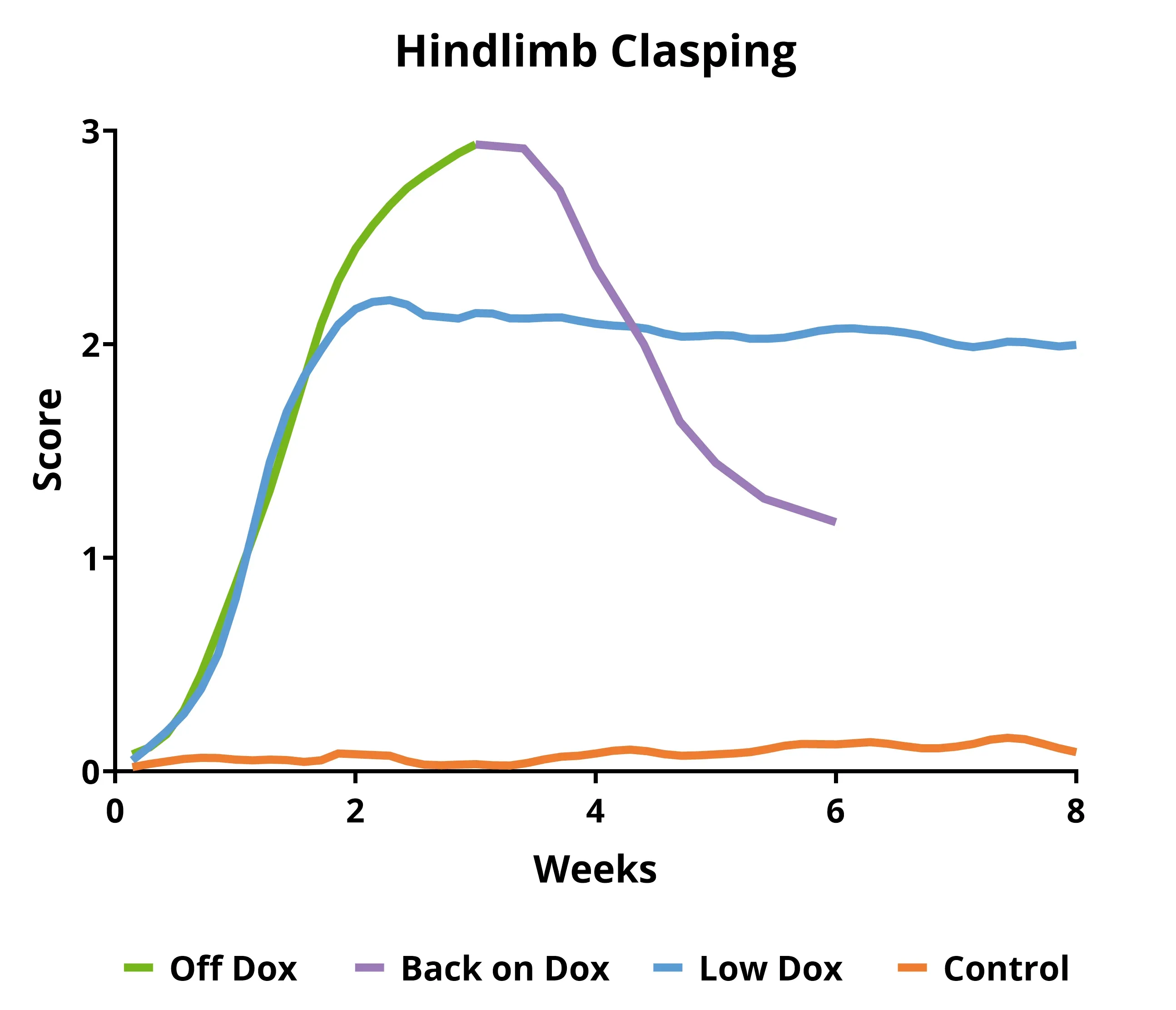
- オリジナルマウスモデル(「オフ・ドックス」):急速に進行する(数週間)
- バイオスプクティブマウスモデル(「Low Dox」):進行が遅い(数ヶ月
ALS研究者にとって、これらのTDP-43モデルには次のような大きな利点があります。
- TDP-43の細胞質への局在異常
- 進行性の運動障害
- 筋力低下、脱神経、萎縮
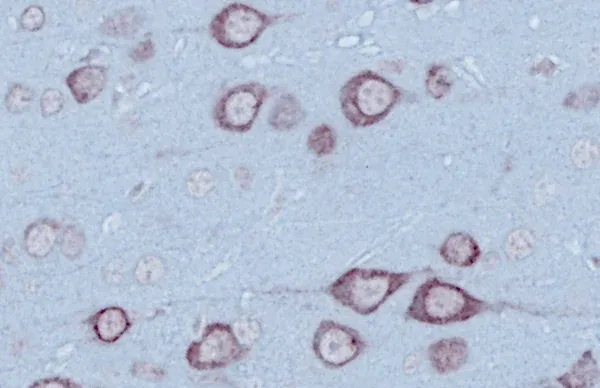
- 運動ニューロン変性および局所脳萎縮
- 神経炎症
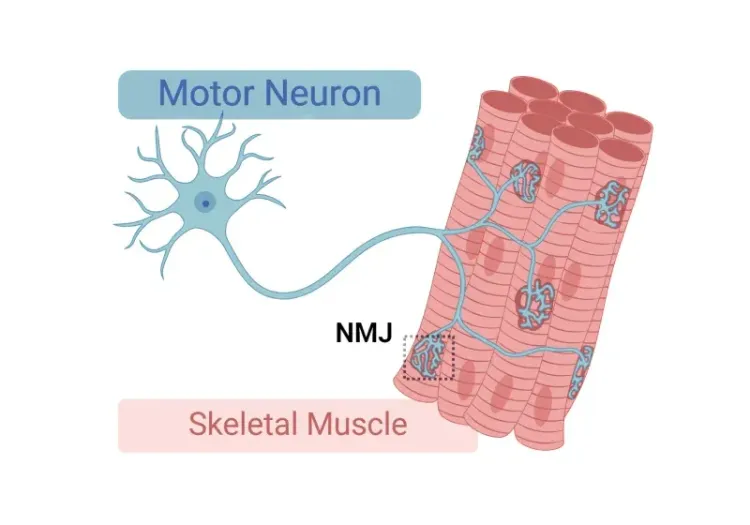
- 脳、脊髄、神経筋接合部(NMJ)の病理
このモデルの経過は予測可能であり、疾患の進行の測定値は高い再現性を示すため、前臨床研究における治療薬の評価に優れたモデルとなります。詳しくは、リソース -TDP-43 ΔNLS (rNLS8) マウスを用いた薬剤開発をご覧ください。
TDP-43 マウス 世代
rNLS8 (NEFH-hTDP-43-ΔNLS) 二重トランスジェニック ALS マウス(「TDP43 マウスモデル」)は、tetO-hTDP-43-ΔNLS 導入遺伝子を持つマウスと、NEFH-tTA 導入遺伝子を持つマウスを交配させることで作製されます。 この TARDBP モデルは、Walker らにより開発および報告されたものです(Acta.。これは、筋萎縮性側索硬化症(ALS)または運動ニューロン疾患(MND)のモデルです。また、前頭側頭型認知症(FTD)または前頭側頭葉変性症(FTLD)のTDP-43病理モデルとしても使用できます。
これらのTDP-43トランスジェニックマウスは、繁殖中および初期の老化期間(通常5~12週齢)にDox食で飼育されます。その後、マウスはDox食から標準食(「Doxオフ」モデル)またはBiospective社が開発した代替プロトコル(「低Dox」モデル)に変更され、ヒトTDP-43の発現が可能になります。このモデルの興味深い特徴は、マウスをDox食に戻すことで病理学的および機能的な回復が達成できることです。
当社のバリデートTDP-43トランスジェニックマウスは、
- 体重
- 運動スコアリング(後肢の拘縮、振戦、グリル敏捷性、麻痺)
- 握力テスト
- 生体内筋電気生理学(複合筋活動電位(CMAP)を含む)(ALSマウスモデルおよび脊髄運動ニューロンを参照)
- 経時的な 生体コンピュータ断層撮影(CT)による筋萎縮の測定(ALS治療薬開発のためのTDP-43 ΔNLS(rNLS8)マウスを参照)
- 血漿および脳脊髄液中のニューロフィラメント軽鎖の測定
- 神経変性を測定するための脳萎縮のMRI(神経変性マウスモデルにおける脳萎縮の分析を参照)
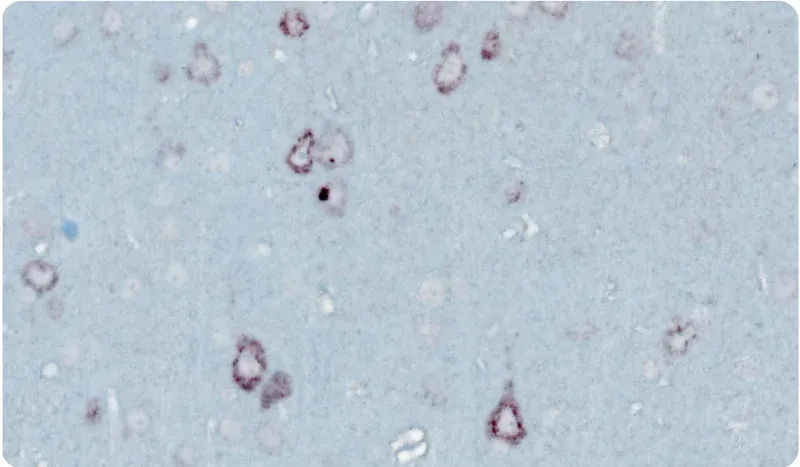
- 免疫組織化学および多重免疫蛍光法
顕微鏡画像
顕微鏡画像
下のインタラクティブイメージビューアーでは、TDP-43トランスジェニックマウスモデルのMultiplex Immunofluorescence組織切片全体をご覧いただけます。
マウスの左ボタンを使用して画像を移動することができます。マウスまたはトラックパッド(上下)または左上隅の「+」および「-」ボタンを使用して、拡大・縮小することができます 。右上隅のコントロールパネルで 、切り替え(オン/オフ)、色の変更、および画像設定の調整を行うことができます。
最高のインタラクティブ体験 をお楽しみいただくには、フルスクリーンモード でのご利用をお勧めします。
このモデルの特性評価、検証済みの測定、前臨床神経科学 CRO サービスについて、さらに詳しく知ることができます。
関連コンテンツ
ALSに関する最新情報およびALS動物モデルにおける治療薬の評価に関するベストプラクティス。
神経筋接合部(NMJ)の形態と筋萎縮性側索硬化症(ALS)モデル
神経筋接合部(NMJ)の構造、筋萎縮性側索硬化症(ALS)におけるその役割、NMJの形態学的変化の研究に使用されるツールと方法についての洞察。
ALSマウスモデルと脊髄運動ニューロン
筋萎縮性側索硬化症(ALS)のマウスモデルにおける脊髄運動ニューロンと疾患進行の関わりについての概要。
ALSマウスモデルを用いた創薬
治療薬の前臨床試験における筋萎縮性側索硬化症(ALS)の研究用動物モデル(マウスおよびラットモデル)の最も効果的な使用方法についてのガイド。
TDP-43 ΔNLS (rNLS8) ALS 治療薬開発用マウス
このリソースは、ALSのΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43トランスジェニックマウスモデルの使用に関する情報を提供しており、前臨床治療研究に役立てることができます。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。
オートファジーと神経変性疾患
細胞性オートファジーが脳の健康と神経変性において果たす役割についての概要。
オートファジーと転写因子EB(TFEB)
転写因子TFEB(Transcription Factor EB)の概要と、オートファジーおよび神経変性疾患における役割について。