この資料では以下の内容について説明しております:
ピロプトーシスとは何でしょうか?
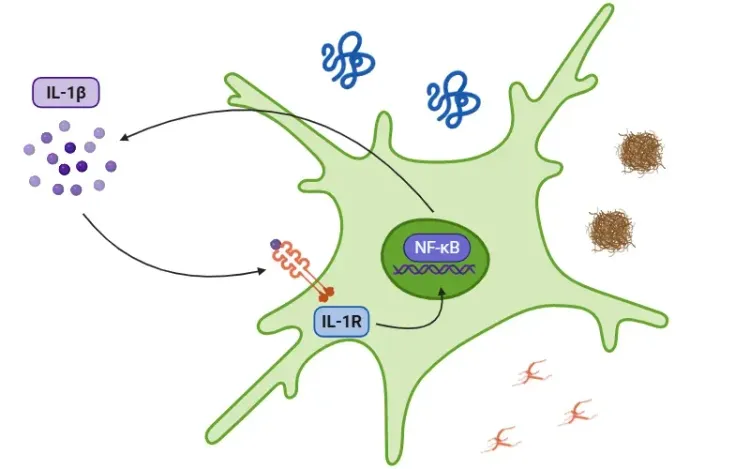
ピロプトーシスは、細胞の腫脹、原形質膜に孔が形成されること、膜の破裂、そしてそれに続くIL-1βやIL-18などの炎症促進性細胞内内容物の放出を特徴とする、炎症促進型のプログラム細胞死です(Vande Walle, 2016;Fang, 2020;Tan, 2021;Rao, 2022)。
参照:IL-1β(インターロイキン-1β)とは何ですか?&インターロイキン-1β(IL-1β)と神経変性疾患
このプロセスは自然免疫システムの一部であり、病原体を細胞外空間へ排出することで、免疫応答の標的となり得る状態に置くという、病原体に対する主要な防御機構として機能します(Vande Walle, 2016)。しかしながら、過剰に活性化された場合、ピロプトーシスは広範な細胞死、組織損傷、および炎症反応を引き起こす可能性があり、様々な炎症性疾患や自己免疫疾患の一因となり得ます(Shi, 2017;Rao, 2022;Song, 2022)。
「パイロプトーシス」という用語は2001年に初めて提唱され、ギリシャ語の「pyro」(火または熱を意味する)と「ptosis」(落下を意味する)に由来します。この用語は、この細胞死経路の炎症促進的な性質を反映しています。特に、ピロプトーシスはアポトーシスやネクロプトーシスなどの他の細胞死形態とは異なります(Fang, 2020;Y. Liu, 2024):
- アポトーシスは主に組織の発達や恒常性の維持に関与し、老化細胞や軽度損傷細胞の除去にも寄与します。アポトーシス小体を除去することで清潔なプロセスを確保し、炎症反応の誘発を防ぎます(Bertheloot, 2021)。
- ネクロプトーシスはピロプトーシスと同様に炎症反応を誘発しますが、異なる分子(具体的にはRIPK1、RIPK3、MLKL)によって実行され、アポトーシスを阻害した病原体に対するバックアップ機構として機能します(Bertheloot, 2021)。
ピロプトーシスは一般的に、ガスダーミン(GSDM:A、B、C、D、E、およびDFNB59またはPVJK)を切断する酵素である様々なカスパーゼの活性化によって引き起こされます。このうちガスダーミンDは、多様な免疫細胞・臓器・組織に存在することから、特に多くの研究対象となってまいりました。ガスダーミンDが切断されると、N末端断片とC末端断片に分離します。N末端断片はその後、細胞膜に移動し、オリゴマー化して大きな孔を形成します。これらの孔は水の流入とイオンの不均衡を引き起こし、最終的に細胞の膨潤と浸透圧による溶解をもたらします(Bergsbaken, 2009;Fang, 2020;Yu, 2021)。
ピロプトーシスの過程には、主に4つのシグナル伝達経路が関与しています(Yu, 2021年):
- カノニカル・インフラマソーム経路
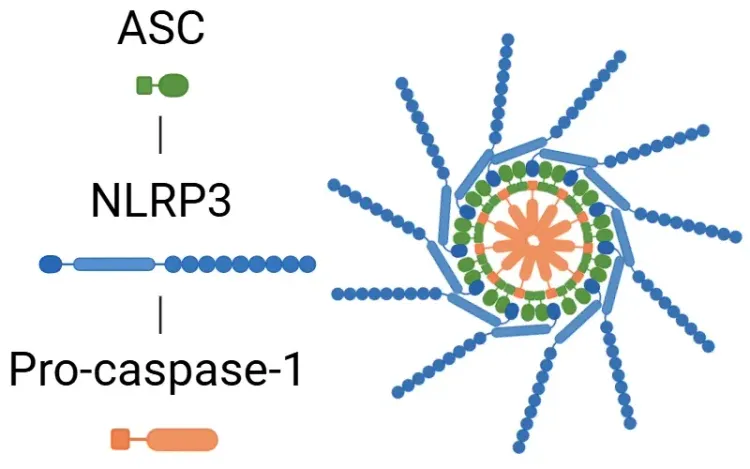
- 活性化:この経路は病原体関連分子パターン(PAMPs)および損傷関連分子パターン(DAMPs)によって誘発され、NLRP1、NLRP3、NLRC4、AIM2などのインフラマソーム構成要素の活性化につながります。
- 活性化後、インフラマソームはカスパーゼ-1を活性化します。
- カスパーゼ-1はGSDMDを切断し、ピロプトーシスを開始すると同時に、プロ-IL-1βおよびプロ-IL-18を活性型に切断します(Bertheloot, 2021;Tan, 2021;Song, 2022)。
- 非典型経路
- 活性化:この経路は主に、細菌由来の細胞質リポ多糖(LPS)によって開始されます。LPSは特定の巨分子シグナル複合体(ヒトではカスパーゼ4/5、マウスではカスパーゼ11)を活性化します。
- カスパーゼ4/5/11はGSDMDを切断し、カスパーゼ-1とは独立してピロプトーシスを引き起こします。
- 細胞膜の多孔は、GSDMDおよびP2X7によって形成されます。
- カリウムイオンの流出は、NLRP3炎症小体の組み立てをさらに促進します(Fang, 2020;Yu, 2021;Song, 2022)。
- カスパーゼ3/8経路
- この経路には、アポトーシスと伝統的に関連付けられているカスパーゼ、具体的にはカスパーゼ3およびカスパーゼ8が関与します。
- カスパーゼ3:その活性化は化学療法や免疫療法(例:CAR T細胞)によって引き起こされ、最終的にGSDMEを切断します。
- カスパーゼ8:イエルシニア菌やアスペルギルス菌など特定の感染に反応して活性化し、GSDMDの切断を引き起こします。また、がん細胞の低酸素状態下ではTNF-αによって活性化される代替経路も存在し、GSDMCを活性化する可能性があります(Yu, 2021;Chai, 2023)。
- この経路には、アポトーシスと伝統的に関連付けられているカスパーゼ、具体的にはカスパーゼ3およびカスパーゼ8が関与します。
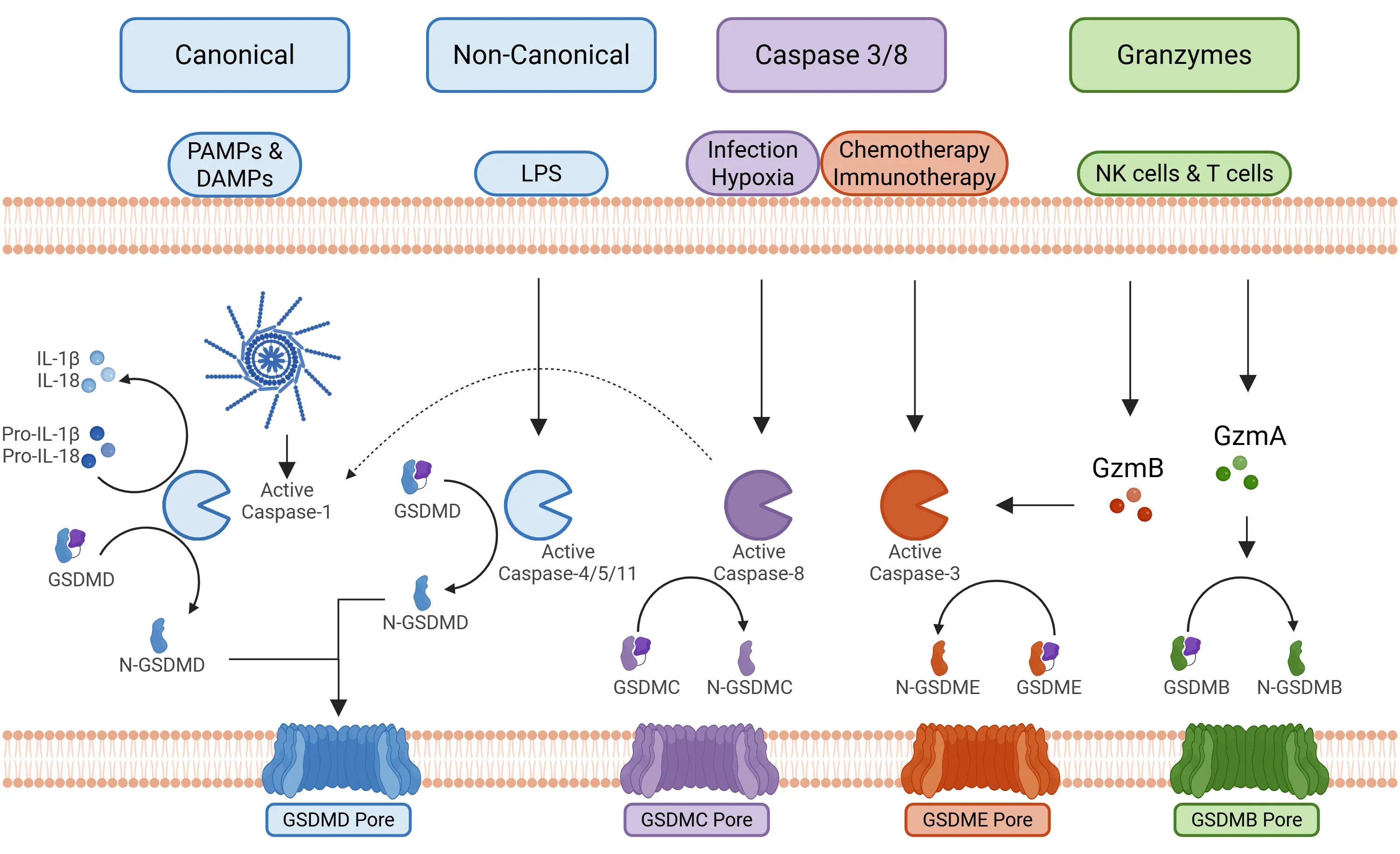
ピロプトーシスを促進する主要なシグナル伝達経路。
ピロプトーシスは疾患に関与しているのでしょうか?
ピロプトーシスは細胞を破裂させ、炎症促進分子を放出させることで神経炎症と神経細胞損傷に寄与し、中枢神経系(CNS)内に有害な環境を作り出します。このプロセスは脳内の様々な細胞タイプに影響を及ぼし、それぞれが異なる方法で疾患病態に関与します:
- ミクログリアは中枢神経系の主要な免疫細胞であり、神経炎症において重要な役割を果たします。ミクログリアがピロプトーシスを起こすと、炎症性メディエーターを放出する炎症促進状態に入り、これにより神経細胞が損傷を受け、疾患進行に寄与する異常なタンパク質などの有害物質を除去する能力が損なわれます(Wu, 2022;Oladapo, 2024)。
- 星状細胞のピロプトーシスは細胞腫脹、膜孔形成、神経毒素の放出を引き起こします。この過程は星状細胞の支持的役割を阻害し、ミトコンドリア機能障害や小胞体ストレスを招き、結果として神経炎症環境を悪化させます(Oladapo, 2024)。
- 神経細胞もまたピロプトーシスを起こす可能性があり、神経変性疾患、脳卒中、感染症において観察される神経細胞の喪失に直接寄与します(Wu, 2022)。
神経疾患
神経疾患におけるピロプトーシスの具体的な関与:
- アルツハイマー病(AD):
- ADでは、アミロイドβの凝集と神経原線維変化がミクログリアを活性化させ、NLRP3炎症小体を活性化します。これによりGSDMDを介したピロプトーシスが開始されます。この過程で放出される炎症性サイトカインは神経炎症を促進し、ミクログリアのアミロイドβ斑塊除去能力を低下させるため、病態の悪循環が持続します(Wu, 2022;Y. Liu, 2024;Oladapo, 2024)。
- アルツハイマー病における神経炎症の詳細については、リソース「神経変性疾患におけるミクログリア、アストロサイト、およびタウ」をご参照ください。
- パーキンソン病(PD):
- 異常折り畳みα-シヌクレインタンパク質は、ミクログリアとニューロンの両方でNLRP3炎症小体を活性化させます。この活性化によりGSDMDが切断され、細胞膜に孔を形成してピロプトーシスを引き起こします。その結果、炎症性サイトカインが放出され、神経炎症とドーパミン作動性ニューロンの進行性喪失が持続します(Wu, 2022;Liang, 2024;Oladapo, 2024)。
- パーキンソン病における神経炎症の詳細については、リソース「パーキンソン病におけるミクログリア、アストロサイト、α-シヌクレイン」をご参照ください。
- 多発性硬化症(MS):
- 証拠によれば、MS病変内ではミクログリアとオリゴデンドロサイトの両方で、カスパーゼ-1およびGSDMDを介したピロプトーシスが生じます。これは炎症と脱髄に寄与します(Y. Liu, 2024)。
- 虚血性脳卒中:
- 中枢神経系におけるピロプトーシスは、脳卒中後の二次的損傷の主要な要因です。メチルトランスフェラーゼ様14(METTL14)はNLRP3炎症小体を活性化し、ピロプトーシスを促進します。その結果生じる神経炎症は初期損傷を悪化させ、回復の遅延と関連していることが示されています(Wu, 2022;Y. Liu, 2024)。
がん
ピロプトーシスは、特定のがん種や分子環境に応じて腫瘍促進因子および抑制因子の両方の役割を果たす複雑な二重の役割を担っています。例えば:
- メラノーマでは、NLRP1およびNLRP3炎症小体が腫瘍増殖を促進し、骨髄由来抑制細胞(MDSC)を活性化することで免疫抑制環境を形成します。一方、化学療法によるGSDME依存性ピロプトーシスの誘導は、腫瘍増殖と転移を抑制することが示されています(Huang, 2022;Z. Liu, 2024)。
- 乳癌においては、GSDMBおよびGSDMCの過剰発現が腫瘍増殖、転移、予後不良と関連しています。しかしながら、GSDMDによって調節されるピロプトーシスの減少は疾患進行と関連しています(Huang, 2022;Z. Liu, 2024)。
- 大腸癌においては、AIM2およびカスパーゼ-1の欠損は予後不良と関連しており、腫瘍抑制的役割を示唆しています。しかしながら、NLRP3の活性化は転移を促進する可能性があり、GSDMDの高発現は予後不良と相関しています(Huang, 2022;Z. Liu, 2024)。
炎症性疾患
ピロプトーシスが過剰なサイトカイン放出と炎症を促進する役割を担うため、以下の炎症性疾患に関与しています:
- 自己炎症性疾患(Vande Walle, 2016;Song, 2022;Chai, 2023):
- クリオピリン関連周期性症候群(CAPS)
- 家族性地中海熱(FMF)
- 好中球性皮膚症を伴うピリン関連自己炎症症(PAAND)
- 乳児性腸炎を伴う自己炎症症(AIFEC)
- 無菌性炎症性疾患(Wu, 2022;Y. Liu, 2024):
- 心血管疾患:動脈硬化症、心筋梗塞
- 肝臓疾患:非アルコール性脂肪性肝臓病、非アルコール性脂肪性肝炎(NASH)、肝線維症
- 肺疾患:喘息および珪肺症
ピロプトーシスを標的とした治療法の応用可能性はございますでしょうか?
ピロプトーシスを標的とする治療戦略は、がん、炎症性疾患、神経疾患など幅広い疾患に対して有望な治療法となり得ます。治療アプローチは疾患の文脈によって異なります。がん治療においてはピロプトーシスの誘導が有益である一方、炎症性疾患や自己免疫疾患ではその抑制が目標となります。
ガスダーミン関連療法:
- 阻害:
- これらの薬剤は、GSDMD-N末端のオリゴマー化と細孔形成を阻害することで病的な炎症を軽減します(Y. Liu, 2024;Oladapo, 2024;Zhu, 2024):
- フマル酸ジメチル:多発性硬化症(MS)の治療薬として承認されています。複数の動物モデルにおいて、実験的自己免疫性脳脊髄炎(EAE)および家族性地中海熱(FMF)の重症度を軽減するために使用されています。
- C202-2729:この化合物は、動物モデルにおいてEAEおよびエンドトキシンショックにおける炎症を抑制するために使用されてきました。
- ジスルフィラムおよびネクロスルホンアミド:これらの薬剤は、アルツハイマー病、敗血症、COVID-19、アテローム性動脈硬化症など、様々な炎症性疾患の治療に様々な動物モデルで用いられてきました。
- これらの薬剤は、GSDMD-N末端のオリゴマー化と細孔形成を阻害することで病的な炎症を軽減します(Y. Liu, 2024;Oladapo, 2024;Zhu, 2024):
-
- カスパーゼ-1阻害剤は、GSDMDの切断およびそれに続くピロプトーシスの発生を防止することが可能です(Wu, 2022;Oladapo, 2024):
- VX-765は、EAEの動物モデルにおいて神経炎症を軽減することが示されています。
- Ac-YVAD-CMKも前臨床研究で使用されています。
- カスパーゼ-1阻害剤は、GSDMDの切断およびそれに続くピロプトーシスの発生を防止することが可能です(Wu, 2022;Oladapo, 2024):
-
- LDC7559による治療は、神経細胞のアポトーシスと神経炎症を軽減し、最終的に研究モデルにおけるくも膜下出血後の行動および機能回復を改善することが示されています(Cai, 2023)。
- 活性化:抗腫瘍免疫を促進するため(具体的な例は下記の表をご参照ください):
- GSDMEアゴニスト:シスプラチン、ドキソルビシン、パクリタキセルなどの化学療法薬は、カスパゼ-3を活性化し、GSDMEを切断し、乳がんや肺がんを含む様々な種類のがん細胞においてピロプトーシスを引き起こす可能性があります(Fu, 2020;Liao, 2022;Magnani, 2022;Privitera, 2023;Y. Liu, 2024)。
-
- GSDMDアゴニスト:ソラフェニブやシスプラチンなどの薬剤は、カスパゼ-1を活性化し、GSDMDを切断することで、肝細胞癌やトリプルネガティブ乳癌などの特定のがんにおいてピロプトーシスを誘発します(Liao, 2022;Y. Liu, 2024)。
-
- ナノ粒子に結合したGSDMA3は、細胞傷害性T細胞およびヘルパーT細胞の存在下で抗腫瘍効果を発揮します(Yu, 2021)。
インフラマソーム阻害剤:NLRP3インフラマソームはピロプトーシスの上流活性化因子であり、薬物開発のもう一つの焦点です:
- 例えば、MCC950誘導体は動物モデルにおける神経変性疾患の治療に用いられています(Wu, 2022;Y. Liu, 2024)。インフラマソームの治療標的に関する詳細は、当社のリソース「NLRP3インフラマソームと神経変性疾患」および「インフラマソームとは何か?」をご参照ください。
これらの治療法は神経変性疾患を含む様々な炎症性疾患に対して有望である一方、ガスデルミン関連治療には課題も存在します。前述の通り、ガスダーミンの機能は状況依存性であり、マクロファージでは炎症を促進する一方、腸管粘膜細胞では恒常性維持に寄与します。したがって、ガスダーミン関連療法の使用は、過剰なピロプトーシスを介した正常細胞への毒性リスクを伴い、特異性の欠如により全身的な影響を及ぼす可能性があります。
| 標的 | 薬剤または化合物 | 癌の種類 |
| GSDME/カスパーゼ-3 | パクリタキセルおよびシスプラチン |
肺癌 |
| ロボプラチン |
子宮頸癌 | |
| ドキソルビシン |
乳癌 | |
| ジヒドロアルテミシニン(DHA) |
乳癌 | |
| ポロ様キナーゼ1(PLK1)阻害剤 |
食道扁平上皮癌 | |
| 四ヒ酸ヘキソキシド |
トリプルネガティブ乳癌 | |
GSDMD/カスパーゼ-1 | ソラフェニブ |
肝細胞癌 |
| シスプラチン |
トリプルネガティブ乳癌 | |
| FL118 |
大腸癌 | |
| アルパインパインフラボン(AIF) |
肝細胞癌 | |
| メトホルミン |
肝細胞癌 | |
| VB12-セリシン-PBLG-IR780 ナノ粒子 |
胃癌 | |
| カルシウムキレート剤を含むナノ粒子 |
乳癌、黒色腫、卵巣癌 |
当チームは、ピロプトーシスに関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報について、喜んでご回答いたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。
インターロイキン-1ベータ(IL-1β)と神経変性疾患
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患におけるIL-1βの役割。
インフラマソームとは何ですか?
炎症小体(インフlammasome)の概要:その作用機序、疾患における役割、および薬物開発における標的化について。
NLRP3とは何ですか?
NLRP3およびNLRP3炎症小体活性化トリガー、疾患関連、および治療的標的戦略の概要。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。