Qu'est-ce que la pyroptose ?
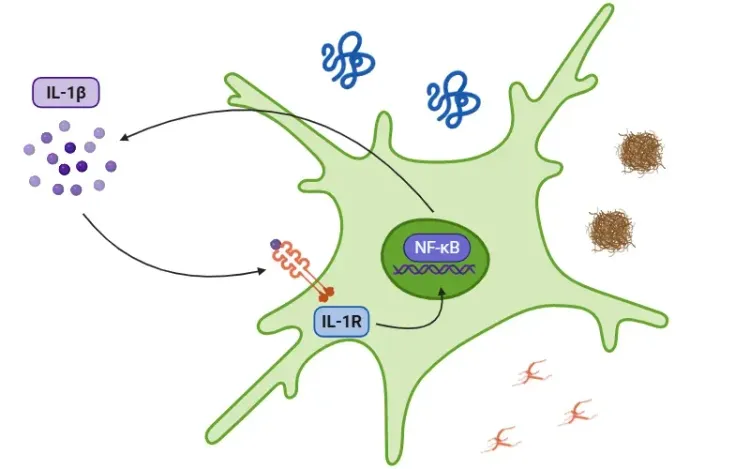
La pyroptose est une forme pro-inflammatoire de mort cellulaire programmée caractérisée par un gonflement des cellules, la formation de pores dans la membrane plasmique, la rupture de la membrane et la libération consécutive de contenus intracellulaires pro-inflammatoires tels que l'IL-1β et l'IL-18 (Vande Walle, 2016; Fang, 2020; Tan, 2021; Rao, 2022).
Voir : Qu'est-ce que l'IL-1β (interleukine-1 bêta) ? & Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
Ce processus fait partie du système immunitaire inné et sert de mécanisme de défense primaire contre les agents pathogènes en les expulsant dans l'espace extracellulaire, où ils peuvent être ciblés par la réponse immunitaire (Vande Walle, 2016). Cependant, lorsqu'elle est activée de manière excessive, la pyroptose peut entraîner une mort cellulaire généralisée, des lésions tissulaires et une réponse inflammatoire pouvant contribuer à diverses maladies inflammatoires et auto-immunes (Shi, 2017; Rao, 2022; Song, 2022).
Le terme « pyroptose » a été introduit pour la première fois en 2001 et provient des mots grecs « pyro », qui signifie feu ou fièvre, et « ptosis », qui signifie chute. Cette terminologie reflète la nature pro-inflammatoire de cette voie de mort cellulaire. Il convient de noter que la pyroptose diffère des autres formes de mort cellulaire, telles que l'apoptose et la nécroptose (Fang, 2020; Y. Liu, 2024) :
- L'apoptose intervient principalement dans le développement des tissus et le maintien de l'homéostasie, tout en contribuant à l'élimination des cellules vieillissantes ou légèrement endommagées. Elle garantit un processus propre en éliminant les corps apoptotiques, empêchant ainsi le déclenchement d'une réponse inflammatoire (Bertheloot, 2021).
- La nécroptose, similaire à la pyroptose, déclenche également une réponse inflammatoire, mais elle est exécutée par différentes molécules (plus précisément RIPK1, RIPK3 et MLKL) et sert de mécanisme de secours contre les agents pathogènes qui ont réussi à inhiber l'apoptose (Bertheloot, 2021).
La pyroptose est généralement déclenchée par l'activation de diverses caspases, qui sont des enzymes qui clivent les gasdermines (GSDM : A, B, C, D, E et DFNB59 ou PVJK). Parmi celles-ci, la gasdermine D a fait l'objet de nombreuses recherches en raison de sa présence dans un large éventail de cellules immunitaires, d'organes et de tissus. Lorsque la GSDM est clivée, elle se divise en un fragment N-terminal et un fragment C-terminal. Le fragment N-terminal se déplace ensuite vers la membrane plasmique, où il s'oligomérise pour créer de grands pores. Ces pores entraînent un afflux d'eau et un déséquilibre ionique, provoquant finalement un gonflement cellulaire et une lyse osmotique (Bergsbaken, 2009; Fang, 2020; Yu, 2021).
Quatre voies de signalisation principales sont impliquées dans le processus de pyroptose (Yu, 2021) :
- Voie canonique de l'inflammasome
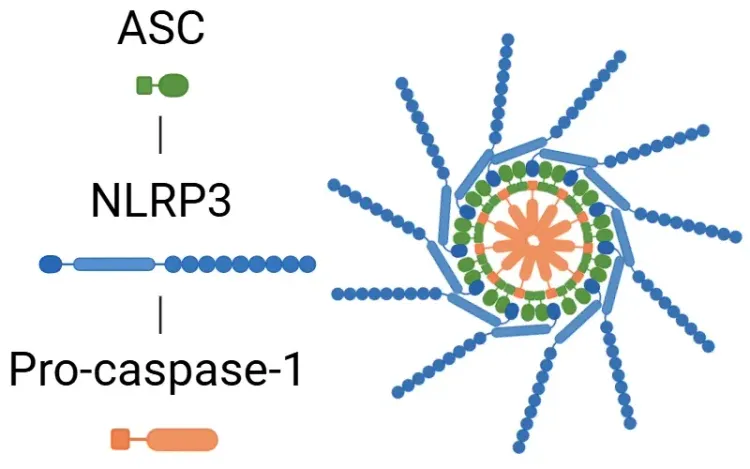
- Activation : cette voie est déclenchée par les motifs moléculaires associés aux pathogènes (PAMP) et les motifs moléculaires associés aux dommages (DAMP), ce qui entraîne l'activation des composants de l'inflammasome, notamment NLRP1, NLRP3, NLRC4 et AIM2.
- Après son activation, l'inflammasome active la caspase-1.
- La caspase-1 clive ensuite le GSDMD, déclenchant la pyroptose, et clivela pro-IL-1β et la pro-IL-18 en leurs formes actives (Bertheloot, 2021; Tan, 2021; Song, 2022).
- Voie non canonique
- Activation : cette voie est principalement initiée par les lipopolysaccharides cytoplasmiques (LPS) provenant de bactéries, qui activent des complexes de signalisation macromoléculaires spécifiques (caspases 4/5 chez l'homme et caspase 11 chez la souris).
- Les caspases 4/5/11 clivent le GSDMD, entraînant une pyroptose indépendante de la caspase-1.
- Des pores membranaires cellulaires sont formés par la GSDMD et la P2X7.
- L'efflux d'ions potassium contribue également à l'assemblage de l'inflammasome NLRP3 (Fang, 2020; Yu, 2021; Song, 2022).
- Voie des caspases 3/8
- Cette voie implique des caspases traditionnellement liées à l'apoptose, en particulier la caspase-3 et la caspase-8
- Caspase 3 : son activation peut résulter d'une chimiothérapie et d'une immunothérapie (par exemple, les cellules CAR T), ce qui finit par cliver le GSDME.
- Caspase 8 : son activation se produit en réponse à des infections spécifiques, telles que celles causées par Yersinia ou Aspergillus, entraînant le clivage du GSDMD. Il existe également une voie alternative, activée par le TNF-α dans des conditions hypoxiques dans les cellules cancéreuses, qui peut activer le GSDMC (Yu, 2021; Chai, 2023).
- Cette voie implique des caspases traditionnellement liées à l'apoptose, en particulier la caspase-3 et la caspase-8
- Voie médiée par les granzymes
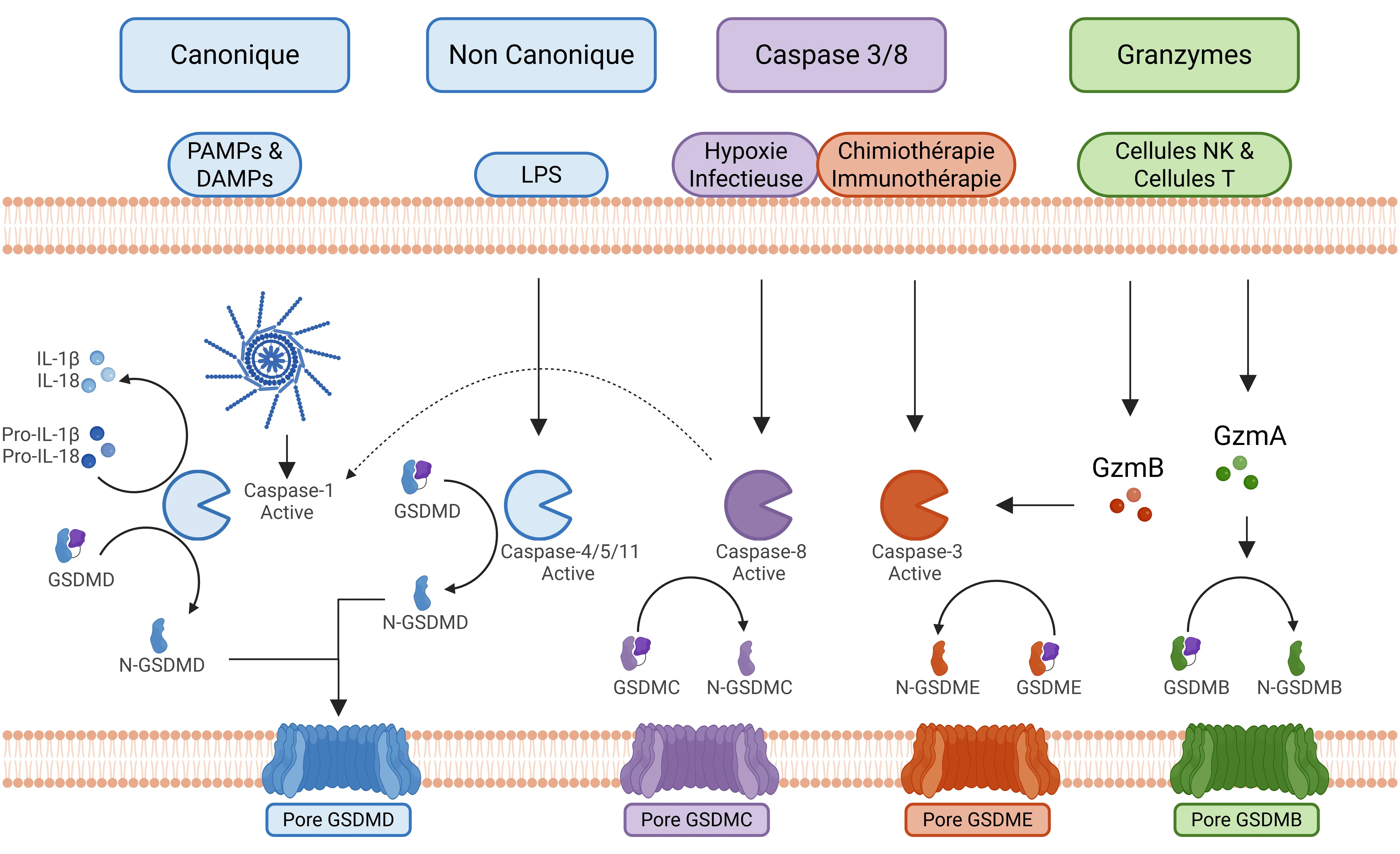
Principales voies de signalisation favorisant la pyroptose.
La pyroptose est-elle associée à des maladies ?
La pyroptose contribue à la neuroinflammation et aux lésions neuronales en provoquant la rupture des cellules et la libération de molécules pro-inflammatoires, créant ainsi un environnement néfaste au sein du système nerveux central (SNC). Ce processus affecte divers types de cellules dans le cerveau, chacune contribuant à la pathologie de la maladie de manière distincte :
- Les microglies sont les cellules immunitaires centrales du SNC et jouent un rôle clé dans la neuroinflammation. Lorsqu'elles subissent une pyroptose, elles entrent dans un état pro-inflammatoire qui libère des médiateurs inflammatoires, lesquels peuvent endommager les neurones et altérer leur capacité à éliminer les substances nocives, telles que les protéines mal repliées qui contribuent à la progression de la maladie (Wu, 2022; Oladapo, 2024).
- La pyroptose astrocytaire entraîne un gonflement des cellules, la formation de pores membranaires et la libération de neurotoxines. Ce processus perturbe les fonctions de soutien des astrocytes, entraînant un dysfonctionnement mitochondrial et un stress du réticulum endoplasmique, qui à leur tour exacerbent l'environnement neuroinflammatoire (Oladapo, 2024).
- Les neurones peuvent également subir une pyroptose, contribuant directement à la perte neuronale observée dans les maladies neurodégénératives, les accidents vasculaires cérébraux et les infections (Wu, 2022).
Maladies neurologiques
Implication spécifique de la pyroptose dans les maladies neurologiques :
- Maladie d'Alzheimer (MA)
- Dans la MA, les agrégats de bêta-amyloïde et les enchevêtrements neurofibrillaires déclenchent l'activation de l'inflammasome NLRP3 par les microglies, initiant la pyroptose via GSDMD. Ce processus libère des cytokines inflammatoires qui favorisent la neuroinflammation et réduisent la capacité des microglies à éliminer les plaques A&beta, perpétuant ainsi un cercle vicieux pathologique (Wu, 2022; Y. Liu, 2024; Oladapo, 2024).
- Pour plus d'informations sur la neuroinflammation dans la MA, veuillez vous référer à notre ressource : Microglia, astrocytes et tau dans les maladies neurodégénératives.
- Maladie de Parkinson (MP)
- La protéine alpha-synucléine mal repliée peut activer l'inflammasome NLRP3 dans les microglies et les neurones. Cette activation entraîne le clivage de la GSDMD, qui forme des pores dans les membranes cellulaires, conduisant à la pyroptose. En conséquence, des cytokines pro-inflammatoires sont libérées, perpétuant la neuroinflammation et la perte progressive des neurones dopaminergiques (Wu, 2022; Liang, 2024; Oladapo, 2024).
- Pour plus d'informations sur la neuroinflammation dans la maladie de Parkinson, veuillez consulter notre ressource : Microglies, astrocytes et alpha-synucléine dans la maladie de Parkinson.
- Sclérose en plaques (SEP)
- Des preuves indiquent que la pyroptose se produit à la fois dans les microglies et les oligodendrocytes au sein des lésions de la SEP, facilitée par la caspase-1 et le GSDMD. Cela contribue à l'inflammation et à la démyélinisation (Y. Liu, 2024).
- Accident vasculaire cérébral ischémique
- La pyroptose dans le SNC est un facteur majeur de lésions secondaires après un accident vasculaire cérébral. La méthyltransférase-like 14 (METTL14) active l'inflammasome NLRP3, favorisant la pyroptose. La neuroinflammation qui en résulte peut aggraver les lésions initiales et a été associée à un retard de récupération (Wu, 2022; Y. Liu, 2024).
Cancer
La pyroptose joue un rôle double et complexe dans le cancer, agissant à la fois comme promoteur et suppresseur de tumeurs selon le type de cancer et le contexte moléculaire spécifiques. Par exemple :
- Dans le mélanome, les inflammasomes NLRP1 et NLRP3 peuvent favoriser la croissance tumorale et créer un environnement immunosuppresseur en activant les cellules suppressives dérivées des myéloïdes (MDSC). À l'inverse, l'induction de la pyroptose dépendante du GSDME par chimiothérapie peut inhiber la croissance tumorale et les métastases (Huang, 2022; Z. Liu, 2024).
- Dans le cancer du sein, la surexpression de GSDMB et GSDMC est liée à la croissance tumorale, aux métastases et à un mauvais pronostic. Cependant, une réduction de la pyroptose régulée par GSDMD est associée à la progression de la maladie (Huang, 2022; Z. Liu, 2024).
- Dans le cancer colorectal, les déficiences en AIM2 et en caspase-1 sont associées à un mauvais pronostic, ce qui indique un rôle suppressif de la tumeur. Cependant, l'activation de NLRP3 pourrait favoriser les métastases, et des niveaux élevés de GSDMD sont corrélés à un mauvais pronostic (Huang, 2022; Z. Liu, 2024).
Maladies inflammatoires
En raison de son rôle dans la libération excessive de cytokines et l'inflammation, la pyroptose est impliquée dans les maladies inflammatoires, notamment :
- Les maladies auto-inflammatoires (Vande Walle, 2016; Song, 2022; Chai, 2023)
- Syndrome périodique associé à la cryopyrine (CAPS)
- La fièvre méditerranéenne familiale (FMF)
- Auto-inflammation associée à la pyrine avec dermatose neutrophilique (PAAND)
- Auto-inflammation avec entérocolite infantile (AIFEC)
- Maladies inflammatoires stériles (Wu, 2022; Y. Liu, 2024)
- Maladies cardiovasculaires : athérosclérose, infarctus du myocarde
- Maladies hépatiques : stéatose hépatique non alcoolique, stéatohépatite non alcoolique (NASH) et fibrose hépatique
- Maladies pulmonaires : asthme et silicose
Existe-t-il des applications thérapeutiques possibles qui ciblent la pyroptose ?
Cibler la pyroptose représente une stratégie thérapeutique prometteuse pour un large éventail de maladies, notamment les cancers, les troubles inflammatoires et les affections neurologiques. L'approche thérapeutique dépend du contexte de la maladie ; induire la pyroptose est bénéfique pour traiter le cancer, tandis que l'inhiber est l'objectif pour les maladies inflammatoires et auto-immunes.
Thérapies liées à la gasdermine :
- Inhibition
- Ces médicaments peuvent réduire l'inflammation pathologique en empêchant l'oligomérisation de l'extrémité N-terminale de la GSDMD et la formation de pores (Y. Liu, 2024; Oladapo, 2024; Zhu, 2024)
- Fumarate de diméthyle : approuvé comme agent thérapeutique pour la sclérose en plaques. Il a été utilisé dans plusieurs modèles animaux pour réduire la gravité de l'encéphalomyélite auto-immune expérimentale (EAE) et de la FMF.
- C202-2729 : ce composé a été utilisé dans des modèles animaux pour inhiber l'inflammation dans l'EAE et le choc endotoxique.
- Disulfiram et nécrosulfonamide : ces médicaments ont été utilisés dans divers modèles animaux pour traiter diverses maladies inflammatoires, telles que la maladie d'Alzheimer, la septicémie, la COVID-19 et l'athérosclérose, entre autres.
- Ces médicaments peuvent réduire l'inflammation pathologique en empêchant l'oligomérisation de l'extrémité N-terminale de la GSDMD et la formation de pores (Y. Liu, 2024; Oladapo, 2024; Zhu, 2024)
-
- Les inhibiteurs de la caspase-1 peuvent empêcher le clivage du GSDMD et la pyroptose qui s'ensuit (Wu, 2022; Oladapo, 2024)
- Il a été démontré que le VX-765 réduit la neuroinflammation dans les modèles animaux d'EAE.
- L'Ac-YVAD-CMK a également été utilisé dans des études précliniques.
- Il a été démontré que le traitement par LDC7559 réduit l'apoptose neuronale et la neuroinflammation, améliorant ainsi la récupération comportementale et fonctionnelle après une hémorragie sous-arachnoïdienne dans les modèles de recherche (Cai, 2023).
- Les inhibiteurs de la caspase-1 peuvent empêcher le clivage du GSDMD et la pyroptose qui s'ensuit (Wu, 2022; Oladapo, 2024)
- Activation : pour favoriser l'immunité antitumorale (voir le tableau ci-dessous pour des exemples spécifiques)
- Agonistes GSDME : Les médicaments de chimiothérapie tels que le cisplatine, la doxorubicine et le paclitaxel peuvent activer la caspase-3, cliver le GSDME et déclencher la pyroptose dans différents types de cellules cancéreuses, notamment celles du cancer du sein et du poumon (Fu, 2020; Liao, 2022; Magnani, 2022; Privitera, 2023; Y. Liu, 2024).
- Agonistes GSDMD : des médicaments tels que le sorafénib et le cisplatine peuvent activer la caspase-1 et cliver la GSDMD afin de déclencher la pyroptose dans certains cancers spécifiques, notamment le carcinome hépatocellulaire et le cancer du sein triple négatif (Liao, 2022; Y. Liu, 2024).
- Le GSDMA3 conjugué à des nanoparticules crée un effet antitumoral en présence de lymphocytes T cytotoxiques et de lymphocytes T auxiliaires (Yu, 2021).
Inhibiteurs de l'inflammasome: L'inflammasome NLRP3 est un activateur en amont de la pyroptose et constitue un autre axe de développement de médicaments:
- Les dérivés du MCC950, par exemple, sont utilisés pour les maladies neurodégénératives dans des modèles animaux (Wu, 2022; Y. Liu, 2024). Pour plus d'informations sur les cibles thérapeutiques de l'inflammasome, veuillez consulter nos ressources : NLRP3 Inflammasome et maladies neurodégénératives & Qu'est-ce qu'un inflammasome ?
Bien que ces thérapies soient prometteuses pour diverses maladies inflammatoires, y compris les maladies neurodégénératives, les thérapies liées à la gasdermine présentent certains défis. Comme indiqué précédemment, les fonctions des gasdermines dépendent du contexte ; elles peuvent favoriser l'inflammation dans les macrophages tout en soutenant l'homéostasie dans les cellules muqueuses intestinales. Par conséquent, l'utilisation de thérapies liées à la gasdermine comporte un risque de toxicité pour les cellules saines par hyperpyroptose, pouvant entraîner des conséquences systémiques en raison d'un manque de spécificité.
| Cible | Médicament ou composé | Type de cancer |
| GSDME/Caspase-3 | Paclitaxel et cisplatine |
Cancer du poumon |
| Loboplatine |
Cancer du col de l'utérus | |
| Doxorubicine |
Cancer du sein | |
| Dihydroartémisinine (DHA) |
Cancer du sein | |
| Inhibiteur de la polo-like kinase 1 (PLK1) |
Carcinome épidermoïde de l'œsophage | |
| Hexoxyde de tétraarsenic |
Cancer du sein triple négatif | |
GSDMD/Caspase-1 | Sorafénib |
Carcinome hépatocellulaire |
| Cisplatine |
Cancer du sein triple négatif | |
| FL118 |
Cancer colorectal | |
| Flavones de pin alpin (AIF) |
Carcinome hépatocellulaire | |
| Metformine |
Carcinome hépatocellulaire | |
| Nanoparticule VB12-séricine-PBLG-IR780 |
Cancer gastrique | |
| Nanoparticule avec un chélateur de calcium |
Cancer du sein, mélanome, cancer de l'ovaire |
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant la pyroptose ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Qu'est-ce que l'IL-1β?
Présentation générale de l'IL-1β, de son rôle pro-inflammatoire dans les maladies systémiques et neurologiques, et des stratégies thérapeutiques impliquant l'antagonisme de l'IL-1β.
Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
Le rôle de l'IL-1bêta dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA), la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA).
Qu'est-ce qu'un inflammasome?
Présentation générale des inflammasomes, notamment leurs mécanismes d'action, leur rôle dans les maladies et leur ciblage pour le développement de médicaments.
Qu'est-ce que le NLRP3?
Présentation générale du NLRP3 et des déclencheurs de l'activation de l'inflammasome NLRP3, des associations avec des maladies et des stratégies thérapeutiques ciblées.
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.