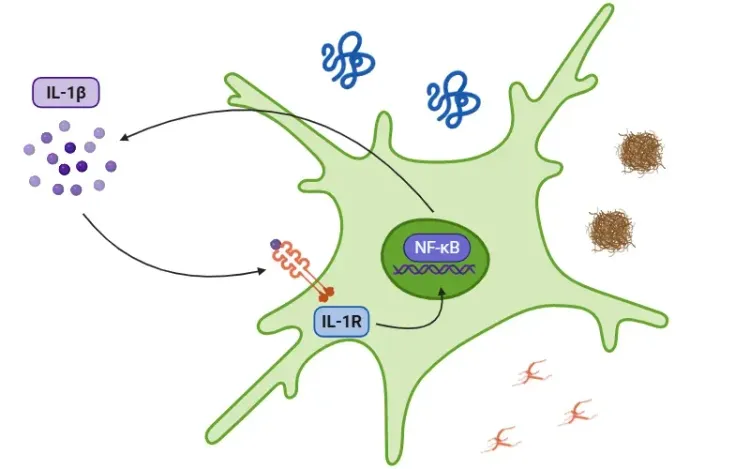
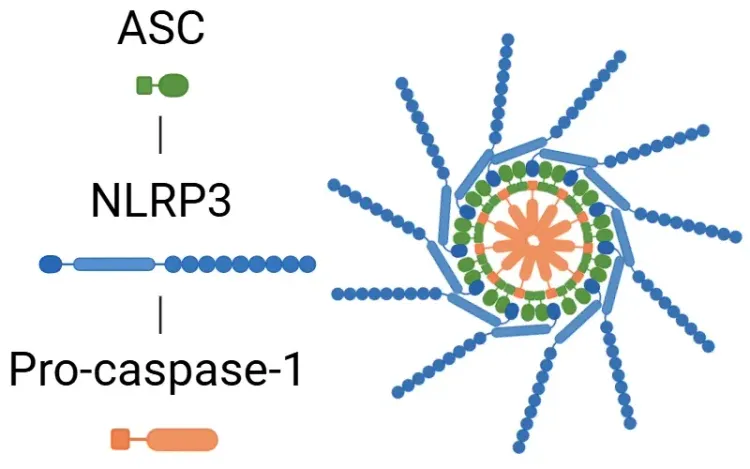
IL-1β란 무엇인가요?
인터루킨-1 베타(IL-1β)는 염증 유발 사이토킨으로 분류되는 단일 사슬 단백질입니다. 이 단백질은 분자량 약 17-18 kDa의 다양한 사이토킨을 포함하는 IL-1 초가족에 속하며, IL-1α, IL-1Ra, IL-18, IL-33, IL-38 등이 포함됩니다. IL-1β의 주요 생성원은 단핵구, 대식세포, 및 중성구입니다. 뇌에서는 미세아교세포와 아스트로사이트에 의해 분비됩니다. IL-1β는 신체 전반에 걸쳐 널리 발현되지만, 골수, 요로계, 뇌, 소화관, 결합 조직 및 연부 조직, 간, 담낭 등에서 특히 높은 농도로 발견됩니다(Kaneko, 2019; Boraschi, 2022).
IL-1β는 신체에서 다양한 역할을 수행하며, 항상성 면역 반응에 기여하고 수면, 통증, 신경 가소성과 같은 필수적인 생리적 과정에 관여합니다(Ren & Torres, 2009). 그 주요 기능은 병리적 조건에서 염증을 촉진하는 것입니다. IL-1β는 선천적 면역과 적응 면역 모두에 관여하며, 시상하부에서 COX-2와 PGE2의 수준을 증가시켜 발열을 유발할 수 있습니다(Boraschi, 2022).
신호 전달 경로는 손상 관련 분자 패턴(DAMPs)과 병원체 관련 분자 패턴(PAMPs)에 의해 인식되는 톨 유사 수용체(TLRs)에 의해 활성화됩니다. IL-1β 분비는 염증체에 의존적 또는 독립적인 경로를 통해 발생합니다. 인플라마좀 경로에서 PAMPs 또는 DAMPs에 의해 NF-κB 전사 인자가 활성화되면 pro-IL-1β, pro-IL-18, 및 NLRP3가 분비됩니다. NLRP3는 ASC와 pro-caspase-1을 모집하여 인플라마좀을 형성하며, 이는 caspase-1을 활성화합니다. 이 효소는 IL-1β와 IL-18을 활성 형태로 분해하여 염증을 촉진합니다(Lopez-Castejon & Brough, 2011; Martin-Sanchez, 2016; Swanson, 2019). NLRP3 염증체에 대한 자세한 내용은 우리 자료 "NLRP3란 무엇인가?"에서 확인할 수 있습니다. 반면, 프로-IL-1β는 중성구 내의 마이엘로블라스틴에 의해 IL-1β로 분해될 수 있습니다. 경로에 관계없이 IL-1β 분비는 TAK1과 MAPK를 포함한 키나제 연쇄 반응을 유발하며, 이는 NF-κB와 AP-1과 같은 프로-염증성 전사 인자를 활성화합니다. 이 과정은 결국 추가적인 IL-1β, IL-18, 및 NLRP3와 같은 염증성 신호 분비의 증가로 이어집니다(Weber, 2010; Kaneko, 2019; Ford, 2025).
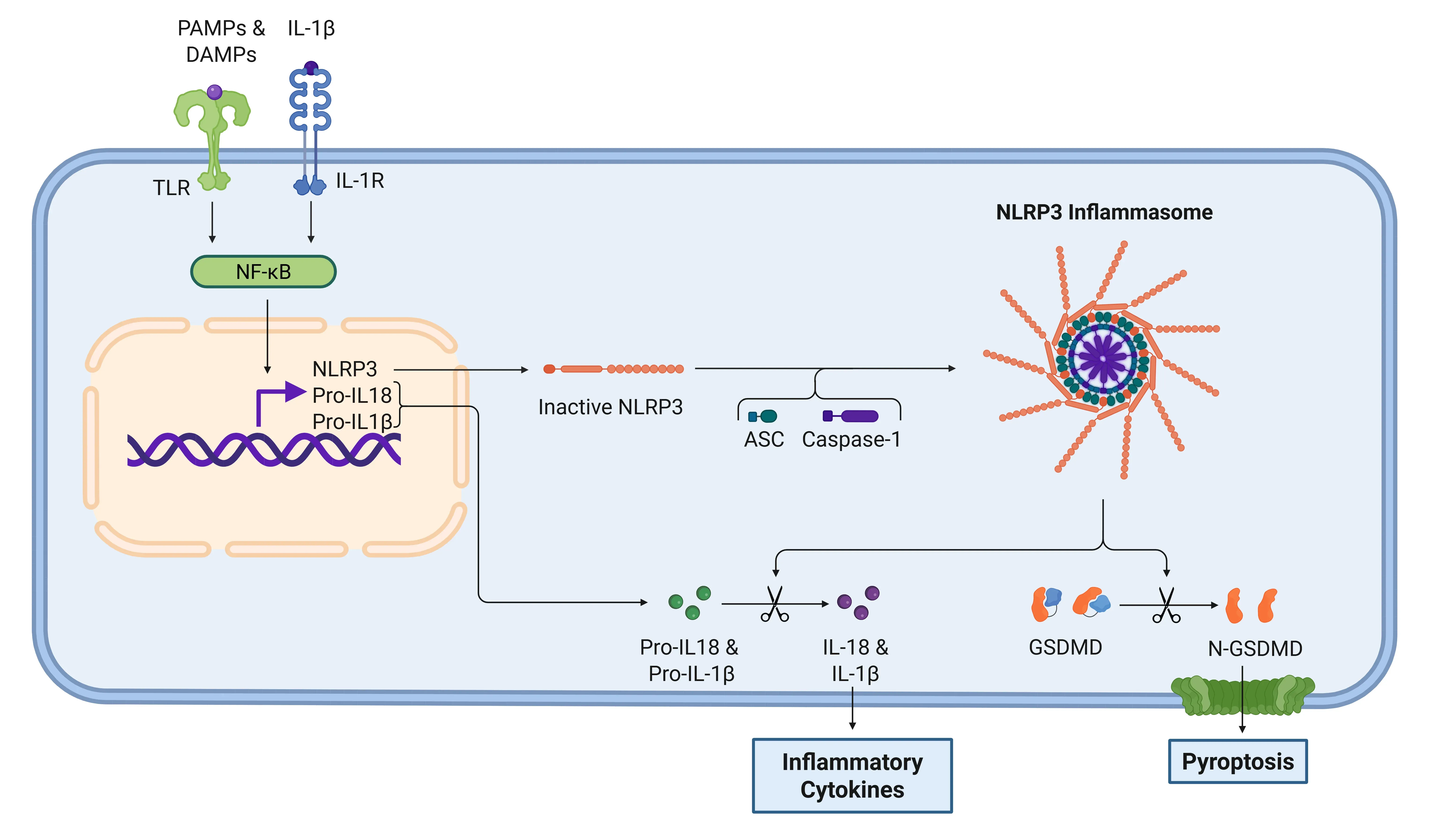
IL-1β 신호전달 경로 via NLRP3 염증체.
염증체는 PAMPs와 DAMPs가 TLR을 통해 감지될 때 활성화됩니다. 활성화된 후, 전사 인자 NF-κB는 NLRP3와 염증성 사이토카인의 비활성 형태의 발현을 촉진합니다. 염증체는 가스데르민 D(GSDMD)를 처리하여 피로토시스를 유발하고, 사이토카인을 기능적 형태인 IL-1β와 IL-18로 활성화합니다. 이 단계 이후, IL-1R은 IL-1β를 인식하여 염증 반응을 더욱 촉진합니다.
IL-1β 분비로 인해 염증 반응이 전반적으로 증가합니다. IL-1α, IL-17, COX2, PGE2, RANKL, MKP1, 추가적인 IL-1β 등 여러 표적 유전자가 전사됩니다. 또한 염증 캐스케이드는 모세혈관 투과성을 증가시켜 면역 세포가 영향을 받은 조직으로 침투하도록 허용하며, 이는 염증을 더욱 촉진합니다. IL-1β와 IL-8의 생산은 다른 면역 세포에게 신호를 전달하는 동시에 중성구, 비만세포, Th17 세포, 골용해세포의 활동을 조절합니다(Sakurai, 2012; Ford, 2025).
IL-1β는 전신성 및 신경퇴행성 질환에서 어떤 역할을 하나요?
IL-1β는 급성 염증을 촉진하는 데 중요한 역할을 하지만, 수준이 높아지면 과도한 염증 반응을 유발해 다양한 질환에 기여할 수 있습니다. 통풍과 소아 특발성 관절염은 IL-1β에 의해 매개되며, 골관절염에서도 수준이 증가한 것이 관찰되었습니다(Dinarello, 2019). 또한 IL-1β는 면역 억제성 골수유래 억제 세포(MDSCs)와 종양 연관 대식세포(TAMs)의 발달을 자극하며, 이는 종양 염증을 촉진할 뿐만 아니라 면역 회피에도 기여합니다(Bent, 2018; Kaneko, 2019). 이 TAMs는 췌장암과 대장암을 포함한 다양한 인간 암에서 발견되었으며, 환자의 예후가 악화되는 것과 연관되어 있습니다(Caronni, 2025).
IL-1β는 면역 반응을 지속시켜 신경퇴행성 질환과도 연관되어 있습니다. 이는 NLRP3 염증체 경로를 통해 신경염증에 크게 기여합니다(Mendiola & Cardona, 2018). 자세한 내용은 리소스 'NLRP3 염증체와 신경퇴행성 질환'을 참고하시기 바랍니다. 흥미롭게도 일부 연구에서는 IL-1β가 IL-1R1+IL-1R3b 수용체와의 상호작용을 통해 신경 보호 효과를 발휘할 수 있으며, IL-1R9 수용체에 대한 작용을 통해 기억과 학습에 관여한다는 제안이 있습니다(Boraschi, 2023).
알츠하이머 병 (AD):
IL-1 슈퍼패밀리에 속하는 사이토카인은 알츠하이머 병(AD)에서의 염증 반응에 깊이 관여하며, 특히 IL-1β와 IL-18이 주요 역할을 합니다. IL-1β의 농도는 뇌척수액(CSF)에서 증가된 수준으로 관찰되며, 이는 아밀로이드-베타(Aβ)에 의해 활성화되는 NLRP3 염증체에 의해 유발될 가능성이 있습니다(Mendiola & Cardona, 2018; Xu, 2025). IL-1β의 분비는 아밀로이드-베타의 생산을 촉진할 뿐만 아니라 신경섬유 엉킴의 형성과 추가적인 염증체 활성화를 유발하는 악순환을 시작합니다. 반면, IL-1β의 다른 사이토킨인 IL-1Ra는 중요한 보호 인자로 작용합니다. 연구 결과, 마우스 모델에서 IL-1Ra의 결핍은 질병 병리를 악화시키는 것으로 나타났습니다(Boraschi, 2023).
파킨슨병(PD):
PD는 α-synuclein의 변형과 도파민 신경세포의 퇴화로 특징지어지며, 이는 NLRP3 염증체 활성화 (Dzamko, 2023; Xu, 2025)를 유발합니다. NLRP3 염증체는 IL-1β라는 주요 염증 매개체를 생성함으로써 PD의 발병에 중요한 역할을 합니다(Boraschi, 2023). PD 환자의 뇌척수액(CSF)에서는 IL-1β, TNFα, IL-6와 같은 사이토카인의 수치가 상승하여 질병과 관련된 신경염증 과정에 기여합니다. 흑질에서의 IL-1β 과발현은 도파민 신경세포의 추가 손실과 신경염증을 유발하지만, 해마에서의 과발현은 인지 장애를 초래합니다 (Dzamko, 2023). 그럼에도 불구하고 PD 맥락에서 IL-1β의 정확한 역할은 아직 완전히 이해되지 않았습니다(Boraschi, 2023).
파킨슨병에서의 α-synuclein에 대한 추가 정보는 '미세아교세포, 아스트로사이트 및 α-Synuclein in Parkinson’s disease' 및 'AAV α-Synuclein Models for Parkinson’s Disease Drug Development'를 참조하세요.
다발성 경화증(MS):
MS 환자는 caspase-1, IL-1β, 및 IL-18의 수치가 상승합니다. NLRP3 염증체는 CD4(+) T 세포의 이동을 촉진함으로써 MS의 발병에 중요한 역할을 합니다. 원발성 진행성 MS의 경우, 단핵구에서 NLRP3 염증체 과다 생산이 발생하며, 이는 다시 IL-1β 생산을 촉진합니다(Mendiola & Cardona, 2018; Xu, 2025). 실험적 자가면역 뇌척수염(EAE)에서 IL-1β는 IL-17A에 의해 모집된 골수세포에서 염증체와 무관한 경로를 통해 분비됩니다(McGinley, 2020). 이 IL-1β는 혈액-뇌 장벽의 투과성을 증가시킬 뿐만 아니라, 주로 아스트로사이트와 내피 세포에 영향을 미쳐 백혈구의 모집을 촉진합니다(Boraschi, 2023).
MS 연구에 사용된 동물 모델의 요약은 Multiple Sclerosis Models를 참조하십시오 .
근위축성 측삭경화증(ALS):
ALS는 ALS와 전두측두엽 치매 모두에서 주요 병리학적 지표인 TDP-43의 존재로 특징지어집니다. TDP-43 침전물은 원시 미세아교세포 배양에서 NLRP3 염증체 활성화를 유발하여 IL-1β 생산을 증가시킵니다(Bright, 2021). ALS 및 TDP-43의 역할에 대한 추가 정보는 ALS 마우스 모델 및 척수 운동 신경세포와 ALS 마우스 모델을 위한 약물 개발을 참조하세요.
IL-1β는 ALS와 관련된 두 가지 가장 흔한 돌연변이 중 하나인 돌연변이 슈퍼옥사이드 디스뮤타제(SOD1)와 관련된 염증에도 관여합니다. SOD1은 염증체(inflammasome)를 활성화시켜 신경염증을 유발할 수 있습니다. 흥미롭게도 IL-1β는 ALS의 바이오마커로 작용할 수 있으며, 특히 특정 유전적 변이인 C9orf72HRE를 가진 환자에서 생존율과 음의 상관관계가 발견되었습니다(Dutta, 2020; Boraschi, 2023).
IL-1β가 신경퇴행성 질환에서扮演하는 역할에 대한 종합적인 검토는 다음과 같습니다: 인터루킨-1 베타 (IL-1β)와 신경퇴행성 질환
IL-1β는 치료 표적으로 활용될 수 있을까요?
IL-1β는 염증에서 중요한 역할을 하기 때문에 다양한 질환에서 유망한 치료 표적으로 인정받고 있습니다. IL-1 수용체 억제제(IL-1Ra)는 자가면역 질환에서 질환의 중증도를 감소시키고 치료 결과를 개선하는 데 유망한 결과를 보여주었으며, 신경퇴행성 질환에 대한 잠재력을 가지고 있습니다.
대표적인 IL-1Ra 중 하나는 인간 내인성 IL-1Ra인 아나킨라입니다. 이 치료제는 IL-1α와 IL-1β의 활성을 억제하며, 류마티스 관절염, 신생아 발병 다계통 염증 질환(NOMID), 인터루킨-1 수용체 억제제 결핍증(DIRA) 등 자가염증성 질환에 대한 사용 승인을 받았습니다(Ford, 2025). 아나킨라는 가장 광범위하게 연구된 IL-1Ra 약물로, 신경퇴행성 질환에서 혜택을 제공할 수 있지만 이 분야의 연구는 여전히 제한적입니다.
알츠하이머 병(AD) 동물 모델에서 아나킨라는 IL-1β 수치를 감소시키고 아밀로이드-베타 및 타우 침착을 줄여 인지 장애를 개선하는 것으로 나타났습니다(Xu, 2025). 반면, ALS 동물 모델에서 IL-1Ra를 차단하는 것은 생존 기간을 연장시켰지만, 질병 발병에는 영향을 미치지 않았습니다. 인간에서 ALS 치료를 위한 안전성과 내약성 연구가 진행되었지만, 이 치료법의 효능을 평가하기 위해 추가 임상 시험이 필요합니다(Maier, 2015).
또 다른 IL-1Ra인 Rilonacept는 인간 IL-1R1과 IL-1R3의 세포외 부위와 인간 IgG1의 Fc 부위가 융합된 구조입니다. 이 설계는 IL-1α와 IL-1β를 장기적으로 억제하며, Rilonacept는 cryopyrin 관련 주기성 증후군(CAPS) 치료에 승인되었습니다.
마지막으로, Canakinumab은 IL-1β를 특이적으로 표적화하며 IL-1α 또는 IL-1R1에 영향을 미치지 않는 인간 단일클론 IgG1 항체입니다. 이 약물은 Still’s 질환, 주기성 발열 증후군, 및 통풍 발작의 치료에 승인되었습니다(Dinarello, 2019).
이 치료법들은 IL-1β를 표적화하는 것이 염증성 질환 관리에 잠재력을 보여주며, 다양한 신경퇴행성 질환 치료를 위한 새로운 대안을 제시합니다.
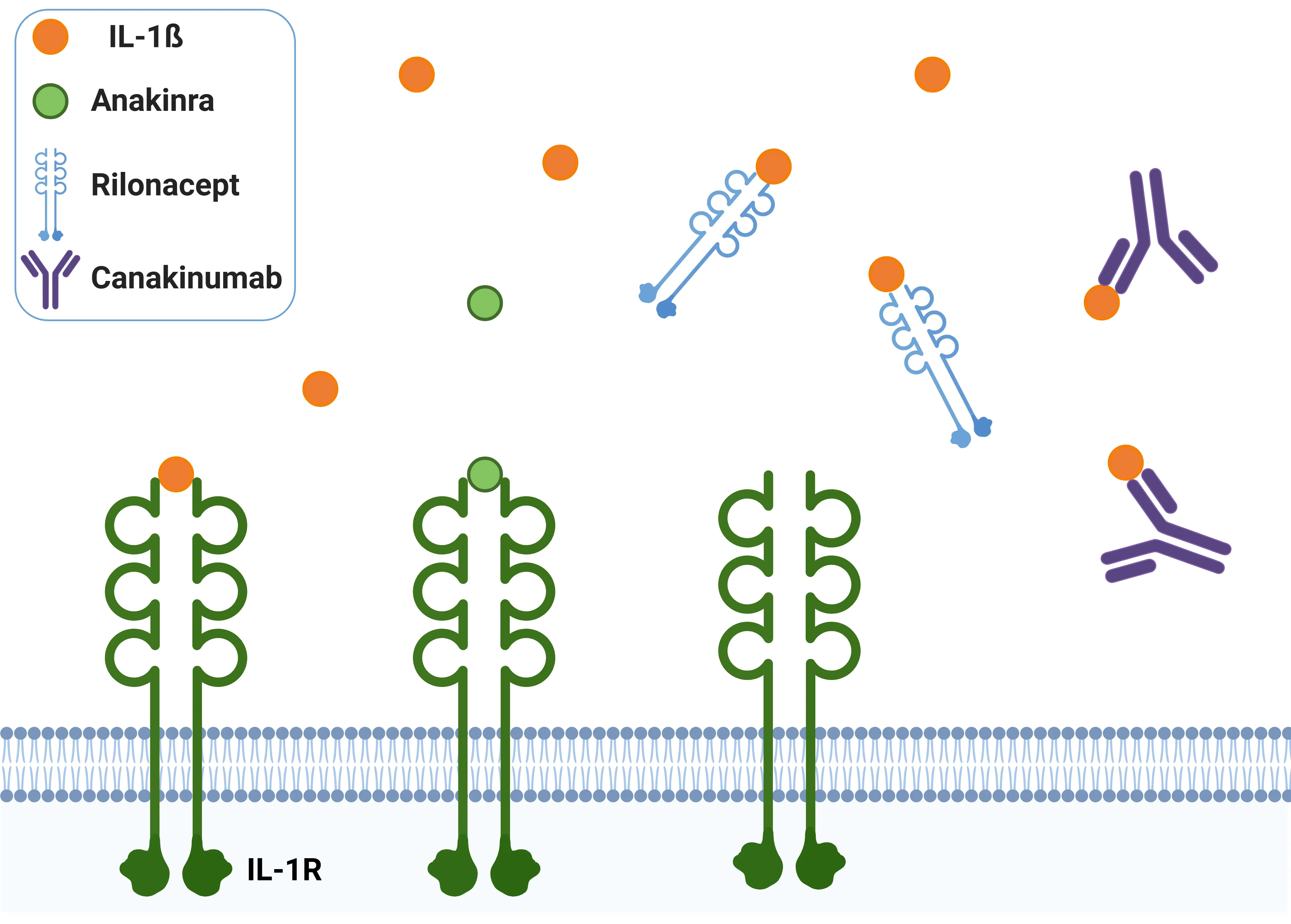
IL-1β 억제제.
아나킨라는 경쟁적 길항제로 작용하여 IL-1R에 결합하여 IL-1β의 작용을 효과적으로 차단합니다. 리로나셉트는 IL-1R의 세포외 도메인으로 구성되어 있으며, 가짜 수용체 역할을 하여 IL-1β가 수용체에 결합하는 것을 방지합니다. 카나키누맙은 단일클론 항체로, IL-1β를 특이적으로 표적화하여 IL-1β가 IL-1R에 결합하는 것을 억제함으로써 그 활성을 감소시킵니다.
저희 팀은 IL-1β에 대한 질문이나 치료 효과 연구에 사용되는 신경퇴행성 질환 모델에 대한 구체적인 정보를 제공해 드릴 수 있습니다.
신경퇴행성 질환 모델에 대해 더 알아보세요
관련 콘텐츠
신경염증에 대한 최신 정보 및 신경퇴행성 질환 동물 모델에서 치료제 평가와 관련된 최선의 실천 방법.
인터루킨-1 베타 (IL-1β)와 신경퇴행성 질환
IL-1베타가 알츠하이머 병(AD), 파킨슨 병(PD), 및 근위축성 측삭경화증(ALS)을 포함한 신경퇴행성 질환에서의 역할.
염증체(Inflammasome)란 무엇인가요?
염증체(inflammasome)의 개요: 작용 메커니즘, 질병에서의 역할, 및 약물 개발을 위한 표적화.
NLRP3란 무엇인가요?
NLRP3 및 NLRP3 염증체 활성화 유발 요인, 질환 연관성, 및 치료 표적 전략에 대한 개요.
NLRP3 인플라마좀과 신경퇴행성 질환
NLRP3 인플라마솜과 알츠하이머병, 파킨슨병, ALS를 포함한 신경 퇴행성 질환에서의 그 역할에 대한 개요.
미세아교세포와 성상교세포의 리소좀 기능 장애
미세아교세포와 성상교세포의 리소좀 기능 장애와 신경퇴행성 질환에서의 그 역할에 대한 개요.
미토콘드리아 기능 장애와 미세아교세포 및 별아교세포
미토콘드리아 기능 장애가 알츠하이머 병, 파킨슨 병, ALS를 포함한 신경퇴행성 질환에서 미세아교세포와 별아교세포에 미치는 역할.