Qu'est-ce que l'IL-1β?
L'interleukine-1 bêta (IL-1β) est une protéine à chaîne unique considérée comme une cytokine pro-inflammatoire. Elle appartient à la superfamille des IL-1, qui comprend diverses cytokines d'un poids moléculaire d'environ 17-18 kDa, notamment l'IL-1α, l'IL-1Ra, l'IL-18, l'IL-33 et l'IL-38. Les principales sources de production d'IL-1β sont les monocytes, les macrophages et les neutrophiles. Dans le cerveau, elle est sécrétée par les microglies et les astrocytes. Bien que l'IL-1β soit largement exprimée dans tout l'organisme, elle est présente en concentrations particulièrement élevées dans la moelle osseuse, les voies urinaires, le cerveau, le tractus gastro-intestinal, les tissus conjonctifs et mous, le foie et la vésicule biliaire (Kaneko, 2019; Boraschi, 2022).
L'IL-1β joue divers rôles dans l'organisme, contribuant aux réponses immunitaires homéostatiques et participant à des processus physiologiques essentiels tels que le sommeil, la douleur et la neuroplasticité (Ren & Torres, 2009). Sa fonction principale consiste à favoriser l'inflammation dans des conditions pathologiques. L'IL-1β intervient dans l'immunité innée et adaptative et peut stimuler la fièvre en augmentant les niveaux de COX-2 et de PGE2 dans l'hypothalamus (Boraschi, 2022).
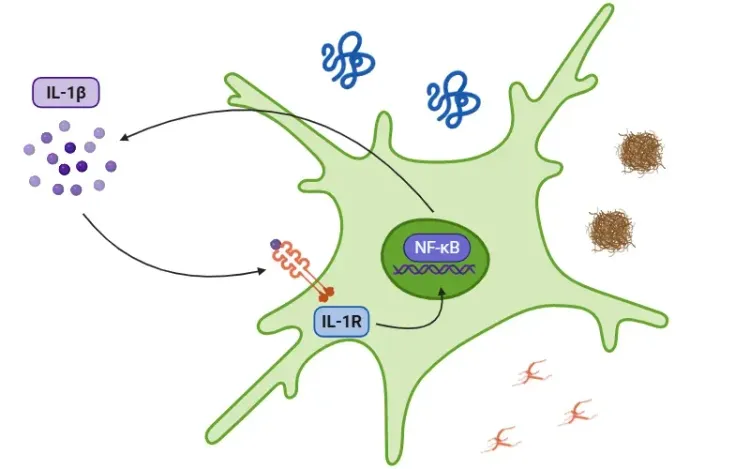
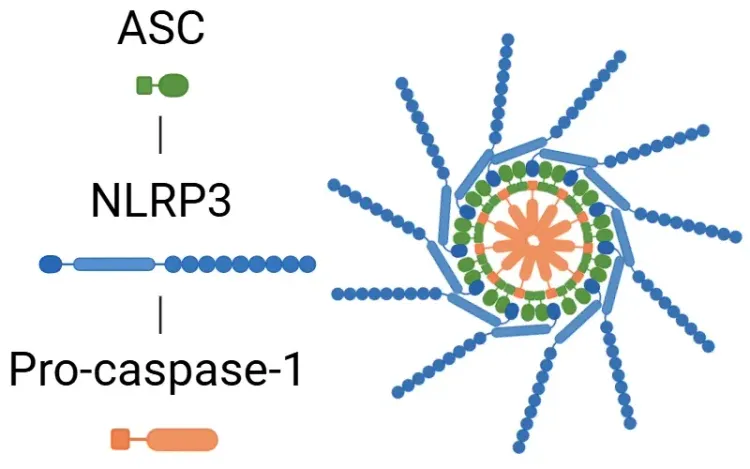
La cascade de signalisation est déclenchée en réponse à des motifs moléculaires associés à des dommages (DAMP) et à des motifs moléculaires associés à des pathogènes (PAMP), détectés par les récepteurs Toll (TLR). La sécrétion d'IL-1β se produit par des voies qui sont soit dépendantes, soit indépendantes de l'inflammasome. Dans la voie de l'inflammasome, l'activation du facteur de transcription NF-κB par les PAMP ou les DAMPs entraîne la libération de pro-IL-1β, de pro-IL-18 et de NLRP3. Le NLRP3 recrute ensuite l'ASC et la pro-caspase-1 pour former l'inflammasome, qui active la caspase-1. Cette enzyme clive l'IL-1β et l'IL-18 en leurs formes actives, favorisant ainsi l'inflammation (Lopez-Castejon & Brough, 2011; Martin-Sanchez, 2016; Swanson, 2019). Vous trouverez plus de détails sur l'inflammasome NLRP3 dans notre ressource « Qu'est-ce que le NLRP3 ? ». D'autre part, la pro-IL-1β peut être clivée en IL-1β par la myéloblastine dans les neutrophiles. Quelle que soit la voie empruntée, la sécrétion d'IL-1β déclenche une cascade de kinases, notamment TAK1 et MAPK, qui activent des facteurs de transcription pro-inflammatoires, tels que NF-κB et AP-1. Ce processus conduit finalement à une libération accrue de signaux pro-inflammatoires, notamment de l'IL-1β, de l'IL-18 et du NLRP3 (Weber, 2010; Kaneko, 2019; Ford, 2025).
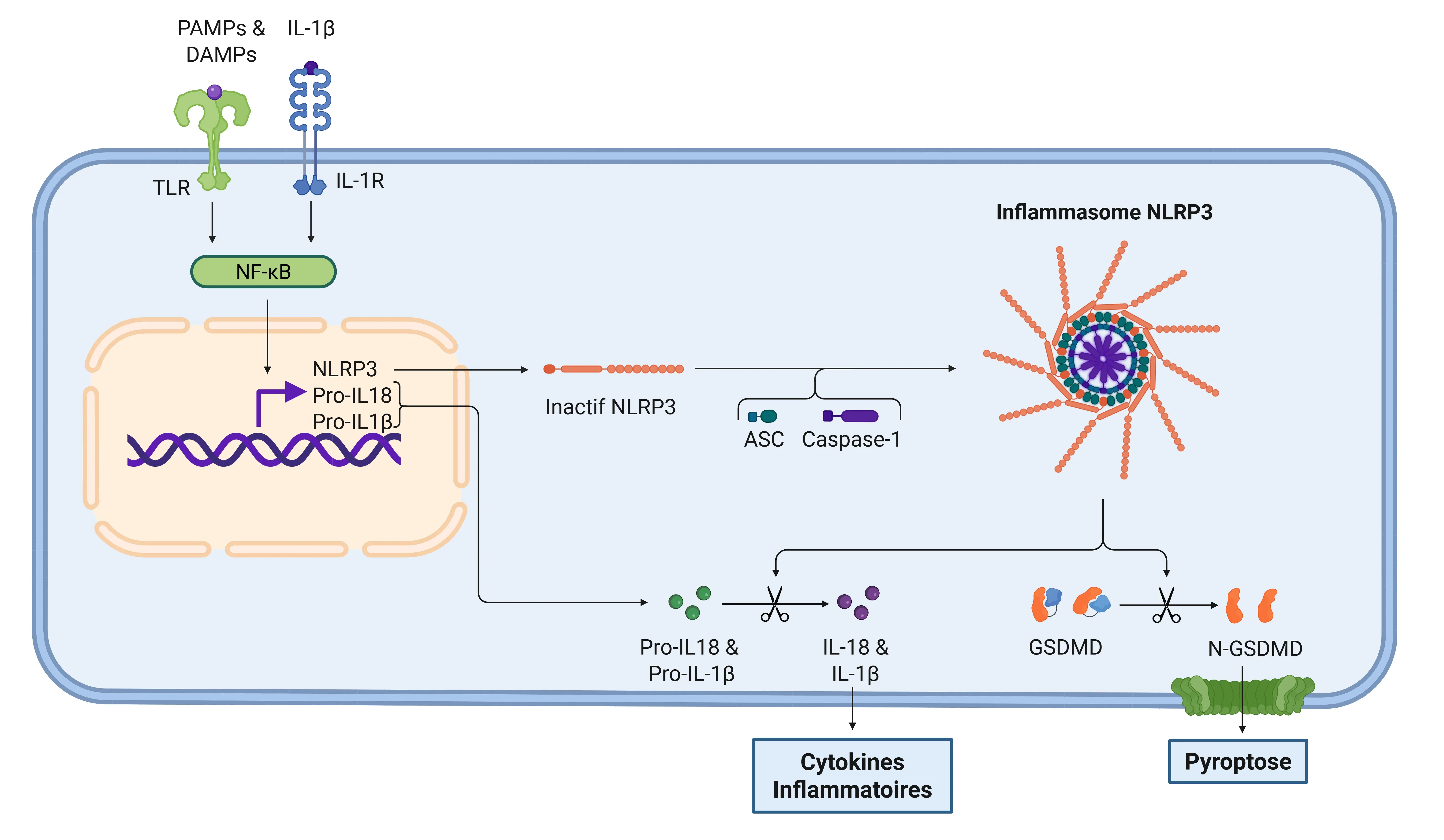
Cascade de signalisation IL-1β via l'inflammasome NLRP3.
L'inflammasome est activé lorsque des PAMP et des DAMP sont détectés par les TLR. Une fois activé, le facteur de transcription NF-κB déclenche l'expression de NLRP3 et des formes inactives des cytokines inflammatoires. L'inflammasome traite ensuite la gasdermine D (GSDMD), entraînant la pyroptose, et active les cytokines sous leurs formes fonctionnelles, IL-1β et IL-18. À la suite de cette étape, l'IL-1R reconnaît l'IL-1β, ce qui stimule davantage la réponse inflammatoire.
En raison de la sécrétion d'IL-1β, on observe une augmentation globale de la réponse inflammatoire. Plusieurs gènes cibles sont transcrits, notamment IL-1α, IL-17, COX2, PGE2, RANKL, MKP1, davantage d'IL-1β, entre autres. De plus, la cascade inflammatoire entraîne une augmentation de la perméabilité capillaire, permettant aux cellules immunitaires de s'extravasquer dans les tissus affectés, ce qui favorise davantage l'inflammation. La production d'IL-1β et d'IL-8 sert également à alerter d'autres cellules immunitaires, tout en modulant simultanément les activités des neutrophiles, des mastocytes, des cellules Th17 et des ostéoclastes (Sakurai, 2012; Ford, 2025).
Quel est le rôle de l'IL-1β dans les maladies systémiques et neurodégénératives ?
Si l'IL-1β joue un rôle crucial dans la promotion de l'inflammation aiguë, des taux élevés peuvent entraîner des réponses inflammatoires excessives, contribuant à diverses maladies. Des affections telles que la goutte et l'arthrite juvénile idiopathique sont médiées par l'IL-1β, et des taux élevés ont également été observés dans l'arthrose (Dinarello, 2019). De plus, l'IL-1β peut stimuler le développement de cellules suppressives dérivées de la moelle osseuse (MDSC) et de macrophages associés aux tumeurs (TAM), qui non seulement favorisent l'inflammation tumorale, mais contribuent également à l'évasion immunitaire (Bent, 2018; Kaneko, 2019). Ces TAM ont été identifiées dans plusieurs cancers humains, notamment les cancers du pancréas et du côlon, et sont associées à un pronostic plus sombre pour les patients (Caronni, 2025).
L'IL-1β est également impliquée dans les maladies neurodégénératives en perpétuant la réponse immunitaire. Elle intervient dans la voie inflammatoire NLRP3, contribuant de manière significative à la neuroinflammation (Mendiola & Cardona, 2018). Pour plus d'informations, vous pouvez vous référer à la ressource NLRP3 Inflammasome et maladies neurodégénératives. Il est intéressant de noter que certaines études suggèrent que l'IL-1β pourrait également exercer des effets neuroprotecteurs par son interaction avec le récepteur IL-1R1+IL-1R3b, et qu'elle serait impliquée dans la mémoire et l'apprentissage par ses actions sur le récepteur IL-1R9 (Boraschi, 2023).
Maladie d'Alzheimer (MA):
Les cytokines de la superfamille IL-1 sont fortement impliquées dans l'inflammation dans la MA, en particulier l'IL-1β et l'IL-18. Des taux élevés d'IL-1β peuvent être observés dans le liquide céphalo-rachidien (LCR), probablement en raison de l'activation de l'inflammasome NLRP3, qui est déclenché par l'amyloïde bêta (Aβ) (Mendiola & Cardona, 2018; Xu, 2025). La libération d'IL-1β déclenche un cycle néfaste qui non seulement augmente la production d'amyloïde bêta, mais favorise également la formation d'enchevêtrements neurofibrillaires et une activation supplémentaire de l'inflammasome. À l'inverse, l'IL-1Ra, une autre cytokine de la superfamille IL-1, agit comme un facteur protecteur essentiel. Des recherches indiquent que l'absence d'IL-1Ra dans des modèles murins aggrave la pathologie de la maladie (Boraschi, 2023).
Maladie de Parkinson (MP):
La MP se caractérise par le mauvais repliement de l'alpha-synucléine et la dégénérescence des neurones dopaminergiques, qui déclenchent l'activation de l'inflammasome NLRP3 (Dzamko, 2023; Xu, 2025). L'inflammasome NLRP3 joue un rôle important dans le développement de la MP en produisant l'IL-1β, un médiateur inflammatoire clé (Boraschi, 2023). Chez les patients atteints de MP, les taux de cytokines, telles que l'IL-1β, le TNFα et l'IL-6, sont élevés dans le LCR, ce qui contribue aux processus neuroinflammatoires associés à la maladie. La surexpression de l'IL-1β dans la substance noire entraîne une perte supplémentaire de neurones dopaminergiques et une augmentation de la neuroinflammation, tandis que la surexpression dans l'hippocampe entraîne des troubles cognitifs (Dzamko, 2023). Néanmoins, le rôle précis de l'IL-1β dans le contexte de la MP n'est pas encore entièrement compris (Boraschi, 2023).
Pour plus d'informations sur l'alpha-synucléine dans la MP, consultez les articles Microglia, Astrocytes & Alpha-Synuclein in Parkinson's Disease (Microglia, astrocytes et alpha-synucléine dans la maladie de Parkinson ) et AAV Alpha-Synuclein Models for Parkinson's Disease Drug Development (Modèles AAV alpha-synucléine pour le développement de médicaments contre la maladie de Parkinson).
Sclérose en plaques (SP):
Les patients atteints de SP présentent des taux élevés de caspase-1, d'IL-1β et d'IL-18. L'inflammasome NLRP3 joue un rôle important dans le développement de la SEP en favorisant la migration des lymphocytes T CD4(+). Dans les cas de SEP primaire progressive, il existe une surproduction de l'inflammasome NLRP3 par les monocytes, qui à son tour stimule la production d'IL-1β (Mendiola & Cardona, 2018; Xu, 2025). Dans le contexte de l'encéphalomyélite auto-immune expérimentale (EAE), l'IL-1β est sécrétée par les cellules myéloïdes qui ont été recrutées par l'IL-17A via une voie qui n'implique pas l'inflammasome (McGinley, 2020). cette IL-1β augmente non seulement la perméabilité de la barrière hémato-encéphalique, mais facilite également le recrutement des leucocytes, principalement en affectant les astrocytes et les cellules endothéliales (Boraschi, 2023).
Pour un résumé des modèles animaux utilisés pour étudier la SEP, veuillez consulter la section Modèles de sclérose en plaques.
Sclérose latérale amyotrophique (SLA) :
La SLA se caractérise par la présence de TDP-43, un marqueur pathologique clé de la SLA et de la démence frontotemporale. Les inclusions de TDP-43 sont connues pour activer l'inflammasome NLRP3 dans les cultures primaires de microglies, entraînant une augmentation de la production d'IL-1β (Bright, 2021). pour plus d'informations sur la SLA et le rôle de la TDP-43, veuillez vous reporter aux sections Modèles murins de SLA et motoneurones spinaux et Modèles murins de SLA pour le développement de médicaments.
L'IL-1β est également impliquée dans l'inflammation associée à la superoxyde dismutase mutante (SOD1), l'une des deux mutations les plus courantes associées à la SLA. La SOD1 peut également activer l'inflammasome, déclenchant une neuroinflammation. Il est intéressant de noter que l'IL-1β peut servir de biomarqueur pour la SLA et qu'il a été découvert qu'elle présente une corrélation négative avec la survie des patients, en particulier ceux présentant la variante génétique spécifique C9orf72HRE (Dutta, 2020; Boraschi, 2023).
Pour une revue complète du rôle de l'IL-1β dans les maladies neurodégénératives, veuillez consulter: Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
L'IL-1β pourrait-elle constituer une cible thérapeutique ?
L'IL-1β est reconnue comme une cible thérapeutique prometteuse dans diverses maladies, principalement en raison de son rôle important dans l'inflammation. Les antagonistes des récepteurs de l'IL-1 (IL-1Ra) ont donné des résultats prometteurs dans la réduction de la gravité des maladies et l'amélioration des résultats dans les maladies auto-immunes et présentent un potentiel pour les troubles neurodégénératifs.
L'anakinra, qui est l'IL-1Ra intrinsèque de l'être humain, est un IL-1Ra notable. Ce traitement inhibe l'activité de l'IL-1α et de l'IL-1β et a été approuvé pour le traitement de maladies auto-inflammatoires telles que la polyarthrite rhumatoïde, la maladie inflammatoire multisystémique néonatale (NOMID) et le déficit en antagoniste du récepteur de l'interleukine-1 (DIRA) (Ford, 2025). L'anakinra est le médicament IL-1Ra le plus étudié et pourrait présenter des avantages dans le traitement des maladies neurodégénératives, bien que les recherches dans ce domaine restent limitées.
Dans des modèles animaux de la MA, l'anakinra a montré qu'il améliorait les troubles cognitifs en réduisant les taux d'IL-1β et en diminuant les dépôts d'amyloïde bêta et de tau (Xu, 2025). À l'inverse, bien que le blocage de l'IL-1Ra dans des modèles murins de SLA ait prolongé la survie, il n'a pas eu d'impact sur l'apparition de la maladie. Bien que des études de sécurité et de tolérance pour le traitement de la SLA aient été menées chez l'homme, des essais cliniques supplémentaires sont nécessaires pour évaluer l'efficacité de ce traitement (Maier, 2015).
Un autre IL-1Ra, le rilonacept, est constitué de la partie extracellulaire des récepteurs IL-1R1 et IL-1R3 humains fusionnés avec la partie Fc de l'IgG1 humaine. Cette conception permet une inhibition à long terme de l'IL-1α et de l'IL-1β, et le rilonacept a été approuvé pour le traitement des syndromes périodiques associés à la cryopyrine (CAPS).
Enfin, le canakinumab est un anticorps monoclonal IgG1 humain qui cible spécifiquement l'IL-1β, sans affecter l'IL-1α ou l'IL-1R1. Il a été approuvé pour le traitement de la maladie de Still, des syndromes de fièvre périodique et des crises de goutte (Dinarello, 2019).
Ensemble, ces traitements soulignent le potentiel du ciblage de l'IL-1β dans la prise en charge des affections inflammatoires, offrant ainsi de nouvelles alternatives pour le traitement d'un large éventail de maladies neurodégénératives.
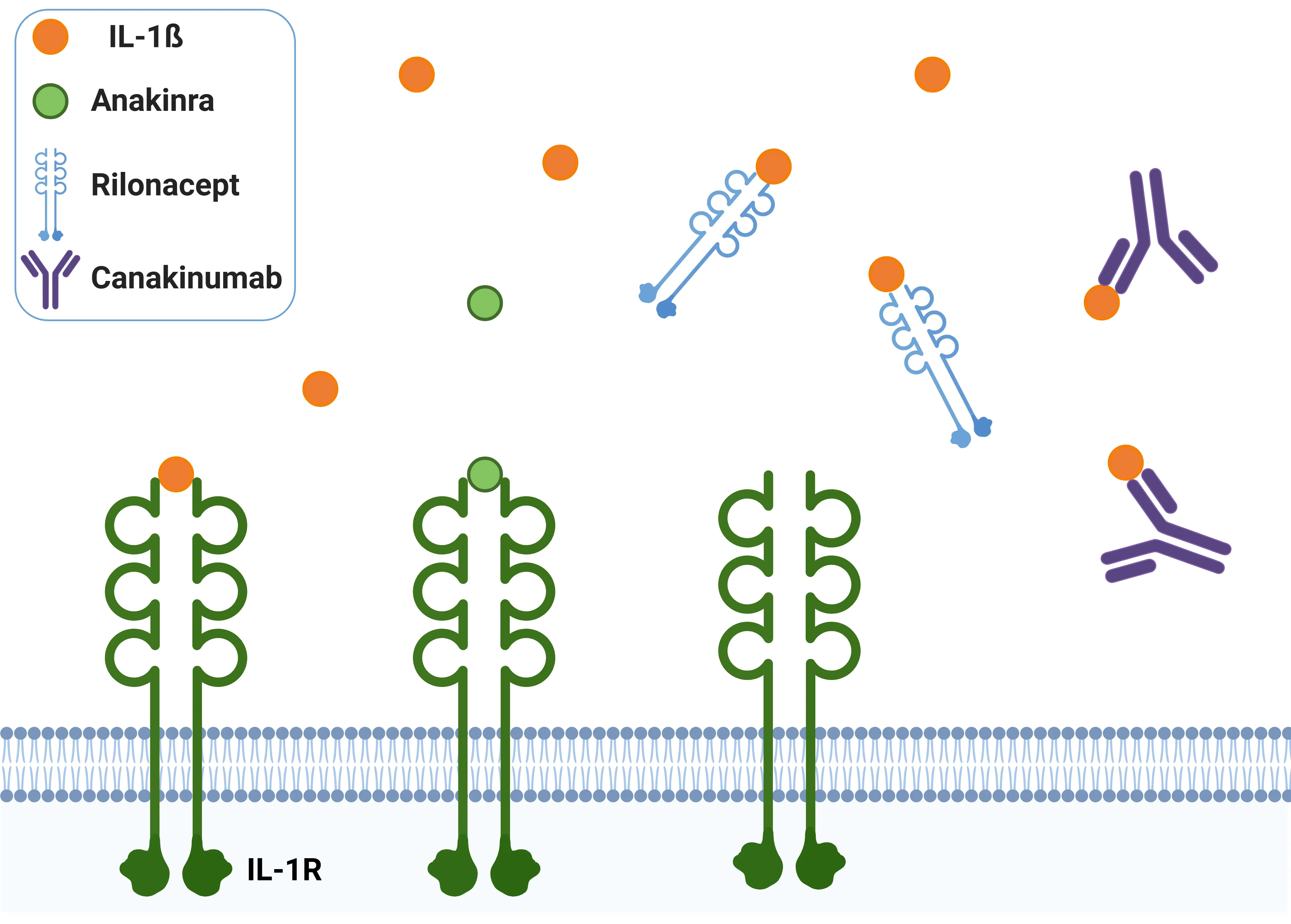
Antagonistes de l'IL-1β.
L'anakinra agit comme un antagoniste compétitif, se liant à l'IL-1R et bloquant efficacement l'action de l'IL-1β. Le rilonacept, qui se compose du domaine extracellulaire de l'IL-1R, sert de récepteur leurre, empêchant l'IL-1β de se fixer à son récepteur. Le canakinumab, un anticorps monoclonal, cible spécifiquement l'IL-1β, inhibant sa capacité à se lier à l'IL-1R et atténuant ainsi son activité.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant l'IL-1β ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour nos études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques en matière d'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
Le rôle de l'IL-1bêta dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA), la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA).
Qu'est-ce qu'un inflammasome?
Présentation générale des inflammasomes, notamment leurs mécanismes d'action, leur rôle dans les maladies et leur ciblage pour le développement de médicaments.
Qu'est-ce que le NLRP3?
Présentation générale du NLRP3 et des déclencheurs de l'activation de l'inflammasome NLRP3, des associations avec des maladies et des stratégies thérapeutiques ciblées.
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
Dysfonctionnement lysosomal dans les microglies et les astrocytes
Un aperçu du dysfonctionnement lysosomal dans la microglie et les astrocytes, et de son rôle dans les maladies neurodégénératives.
Dysfonctionnement mitochondrial dans les microglies et les astrocytes
Le rôle du dysfonctionnement mitochondrial dans les microglies et les astrocytes dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.