NLRP3とは何ですか?
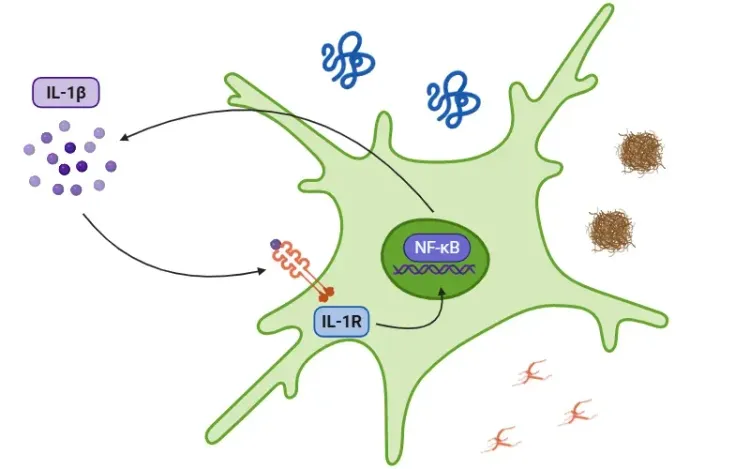
NLRP3(NOD様受容体ピリンドメイン含有タンパク質3)は、クリオピリンとも呼ばれる細胞質タンパク質で、先天性免疫系において有害な信号やストレス関連信号のセンサーとして機能します。細胞損傷やストレスなどの多様な危険信号を検知し、“炎症小体”と呼ばれるより大きなタンパク質複合体の形成を誘発します。
このプロセスは、NLRP3がASC(アダプター分子)とプロカスパゼ-1を募集することで始まります。これら3つが炎症小体(inflammasome)を形成し、その組み立てにより炎症反応の鍵となる酵素であるカスパゼ-1が活性化されます。カスパゼ-1は、IL-1βやIL-18などのプロ炎症性サイトカインを活性型に切断し、細胞から放出されます。これにより炎症が促進されます。NLRP3の活性化は、カスパーゼ-1によるガスダーミンD(GSDMD)の切断を引き起こし、炎症をさらに増幅するプログラム細胞死の一種であるピロプトーシスを誘発します。
NLRP3は、微生物や損傷を受けた細胞から発せられるシグナルであるPAMPs(病原体関連分子パターン)とDAMPs(損傷関連分子パターン)によって活性化されます。
NLRP3を活性化させる刺激の例:
- 細菌毒素やウイルスRNA(PAMPs)
- 細胞外ATP、尿酸結晶、またはアミロイドベータ(Aβ)のようなタンパク質凝集体(DAMPs)
NLRP3炎症小体は宿主防御に不可欠ですが、その持続的な活性化は慢性炎症を引き起こし、組織損傷に寄与する可能性があります。
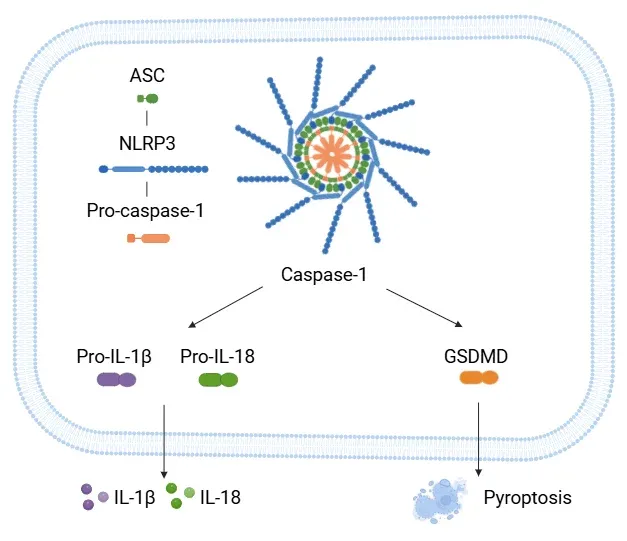
NLPR3活性化経路。
NLRP3炎症小体(NLRP3 inflammasome)は、NLRP3、ASC、およびプロカスパゼ-1から構成されています。活性化されると、この複合体はプロカスパゼ-1を活性型カスパゼ-1に切断し、これがさらにプロIL-1βとプロIL-18を活性型サイトカイン形態に処理します。カスパーゼ-1はGSDMDも切断し、ピロプトーシスを引き起こします。
NLRP3は炎症小体ファミリーで最もよく研究されているメンバーですが、NLRP1、AIM2、NLRC4などの他の炎症小体形成センサーを含むより大きなネットワークの一部です。これらの受容体はそれぞれ、異なる種類の細胞ストレスに反応します。NLRP1は自己免疫疾患や皮膚炎症と関連しており、AIM2は細胞質DNAを検出するセンサーで炎症性疾患に関与し、NLRC4は細菌のフラジェリンに反応し、消化管炎症に関与しています。これらの炎症小体間の相互作用を理解することは、多くの疾患が複数の経路を関与するため、不可欠です。
NLRP3およびその他の炎症小体(インフlammasome)は、神経疾患および全身性疾患においてどのような役割を果たしていますか?
炎症小体は、中枢神経系(CNS)と末梢臓器・組織の両方に影響を与える多様な疾患に関与しています。CNSにおいては、その慢性的な活性化が神経変性の主要な要因としてますます認識されています。
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)では、Aβ、タウ、α-シヌクレイン、TDP-43などの異常タンパク質がDAMPとして機能し、NLRP3を活性化します(Holbrook, 2021;Singh, 2023;Wang, 2024)。この活性化は持続的な炎症と神経細胞の損傷を引き起こします。NLRP3の構成成分を欠損させたマウスでのノックアウト研究では、病理の軽減と病気の進行遅延が観察され、NLRP3阻害が神経変性疾患の治療介入としての有用性を支持しています(Heneka, 2013;Qiao, 2017;Ising, 2019;Lee, 2019)。
神経変性疾患におけるNLRP3炎症小体(AD、PD、ALSを含む)の役割を詳細に解説した包括的なレビューは、当社のリソース「NLRP3炎症小体と神経変性疾患」 をご参照ください。
中枢神経系疾患に関与する他の炎症小体:
- AIM2:ADとPDで発現が上昇(Yang, 2024)
- NLRP1:アルツハイマー病モデルにおけるピロプトティック神経細胞死と関連(Singh, 2023)
中枢神経系以外では、NLRP3は複数の慢性炎症性疾患および代謝性疾患に関与しています。2型糖尿病では、NLRP3の活性化は特に脂肪組織におけるインスリン抵抗性と関連しています(Nițulescu, 2023)。心血管疾患では、NLRP3の活性化は動脈硬化におけるプラーク形成を促進します(Tanase, 2023)。痛風では、尿酸がトリガーとなります(Kim, 2022)。NLRP3は、COVID-19やインフルエンザを含む感染症に対する炎症反応にも役割を果たしています(Li, 2024)。
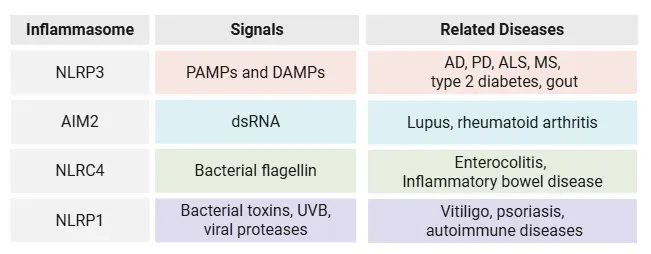
炎症小体センサーの多様性、それらを活性化する外部刺激の種類、および炎症、神経変性、自己免疫、代謝疾患などのさまざまな疾患における役割をまとめた表。
NLRP3炎症小体および関連経路を標的として疾患の治療に活用できるでしょうか?
多くの疾患に関与する役割から、NLRP3炎症小体(NLRP3 inflammasome)は重要な治療標的となっています。研究者たちは、免疫防御機能を損なうことなくNLRP3の活性を安全に抑制できる薬剤の開発を積極的に進めています(Blevins, 2022)。
治療戦略には以下のものが含まれます:
- 直接阻害剤:MCC950は、神経変性疾患の動物モデルにおいて炎症を軽減する選択的NLRP3阻害剤です(Gordon, 2018;Blevins, 2022;Grotemeyer, 2023)。経口剤であるDapansutrile(OLT117)とUsnoflast(ZYIL1)は臨床開発中です。
- 下流阻害剤:VX-765はカスパーゼ-1を選択的に阻害し、ディスルフィラムはガスデミンDを阻害して炎症と細胞死を軽減します。ASC阻害剤のIC100は、炎症小体(inflammasome)の組み立てを防止することを目的としています(Wang, 2024)。
一部の疾患では、複数の炎症小体(inflammasome)が並行して機能しています。この状況から、特にALSのような複雑な疾患に対して、二重または広域スペクトル阻害剤への関心が高まっています(Clénet, 2023)。
進展はあるものの、重要な課題が残っています。神経疾患において、治療薬を血液脳関門を通過させることは大きな障害です。さらに、長期的な免疫抑制は感染リスクを増加させる可能性があり、炎症小体経路の冗長性により、NLRP3を阻害してもすべての疾患において有効でない可能性があります。
弊社チームでは、NLRP3 に関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて詳しく見る
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
インフラマソームとは何ですか?
炎症小体(インフlammasome)の概要:その作用機序、疾患における役割、および薬物開発における標的化について。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。
インターロイキン-1ベータ(IL-1β)と神経変性疾患
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患におけるIL-1βの役割。
ミクログリアとアストロサイトのライソゾーム機能不全
ミクログリアとアストロサイトのライソゾーム機能不全の概要と、神経変性疾患におけるその役割。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。