Qu'est-ce que l'IL-1β?
L'interleukine-1 bêta (IL-1β ou IL-1beta) est une cytokine pro-inflammatoire de la superfamille des IL-1, principalement produite par les monocytes, les macrophages et les neutrophiles, et présente en concentrations élevées dans divers tissus. Elle joue un rôle essentiel dans la défense de l'organisme, l'inflammation, l'induction de la fièvre, l'activation des cellules immunitaires et le fonctionnement du cerveau. Dans des conditions physiologiques normales au sein du système nerveux central (SNC), l'IL-1β favorise la prolifération, la différenciation et l'apoptose des neurones, ainsi que la potentialisation à long terme. L'IL-1β est sécrétée en réponse à des motifs moléculaires associés aux dommages (DAMP) et à des motifs moléculaires associés aux pathogènes (PAMP), activant des voies de signalisation qui favorisent l'inflammation par des mécanismes impliquant l'inflammasome NLRP3 et diverses kinases, notamment le TNF-alpha et l'IL-18 (Lopez-Castejon, 2011; Kaneko, 2019).
Des taux élevés d'IL-1β peuvent entraîner une inflammation excessive, contribuant à des maladies telles que la goutte, l'arthrose et le cancer en favorisant l'inflammation et en aidant les cellules tumorales à échapper au système immunitaire. Dans les maladies neurodégénératives, l'IL-1β est impliquée dans la neuroinflammation, en particulier par l'intermédiaire de l'inflammasome NLRP3, avec des implications pour les maladies neurodégénératives telles que la MA et la MP.
Pour un résumé plus détaillé sur l'IL-1β, veuillez consulter notre ressource "Qu'est-ce que l'IL-1beta?".
Quel est le rôle de l'IL-1β dans la MA, la MP et la SLA?
Les microglies et les astrocytes sont deux types de cellules gliales importantes qui contribuent au maintien de l'homéostasie dans le SNC. Ces deux cellules jouent un rôle essentiel dans la réponse immunitaire du cerveau et contribuent de manière significative à la neuroinflammation, souvent présente dans les maladies neurodégénératives :
- Les microglies peuvent sécréter de l'IL-1β dans des conditions pro-inflammatoires. Plus précisément, les microglies associées à la maladie (DAM) peuvent avoir des effets à la fois protecteurs et nocifs dans les maladies neurodégénératives. Au départ, elles peuvent protéger contre la maladie en éliminant les agrégats neurotoxiques par phagocytose. Cependant, les DAM peuvent également libérer des cytokines pro-inflammatoires, telles que l'IL-1β et le TNF-α, qui peuvent aggraver l'inflammation chronique et la neurodégénérescence. Des microglies de type DAM ont été identifiées dans diverses maladies neurodégénératives, notamment les tauopathies, la MA, la MP et la SLA.
- Les astrocytes peuvent également sécréter de l'IL-1β dans des conditions pro-inflammatoires. Certains astrocytes réactifs peuvent former une cicatrice gliale comme mécanisme de protection, servant de barrière pour empêcher d'autres dommages et la propagation de l'infection. Cependant, les astrocytes réactifs peuvent également produire des cytokines pro-inflammatoires qui exacerbent les lésions neuronales.
Les rôles détaillés des microglies et des astrocytes dans les troubles neurodégénératifs sont abordés dans les ressources intitulées "Microglies, astrocytes et tau dans les maladies neurodégénératives" et "Microglies, astrocytes et alpha-synucléine dans la maladie de Parkinson".
La maladie d'Alzheimer
La MA est reconnue comme la forme la plus répandue de démence, caractérisée par l'accumulation de protéines dans le cerveau, qui se manifeste par des plaques amyloïdes et des enchevêtrements neurofibrillaires de tau. L'IL-1β joue un rôle clé dans la pathologie de la MA, où elle intervient de manière complexe dans la régulation de la pathologie amyloïde-bêta et tau. Sa fonction peut être à la fois bénéfique et néfaste (Shaftel, 2008; Matousek, 2012; Boraschi, 2023). Du côté négatif, l'IL-1β est produite par l'inflammasome NLRP3, ce qui entraîne une neuroinflammation et des lésions neuronales associées à la MA (Lopez-Rodriguez, 2021; Boraschi, 2023).
D'autres cytokines participent également aux processus inflammatoires sous-jacents à la MA. Les taux d'IL-6, d'IL-12, d'IL-18, de TNF-α et de TGF-β sont significativement élevés dans le sang périphérique des personnes atteintes de MA (Xu, 2024). Des facteurs génétiques contribuent également au développement de la maladie. Parmi les polymorphismes spécifiques du gène IL-1 associés à un risque accru de MA, on peut citer (Mrak, 2001) :
- IL-1A 2 (-889) : cette variante est liée à des niveaux d'expression plus élevés de l'IL-1α.
- IL-1B 2 (exon 5) : cette variante est associée à des niveaux d'expression plus élevés de l'IL-1β.
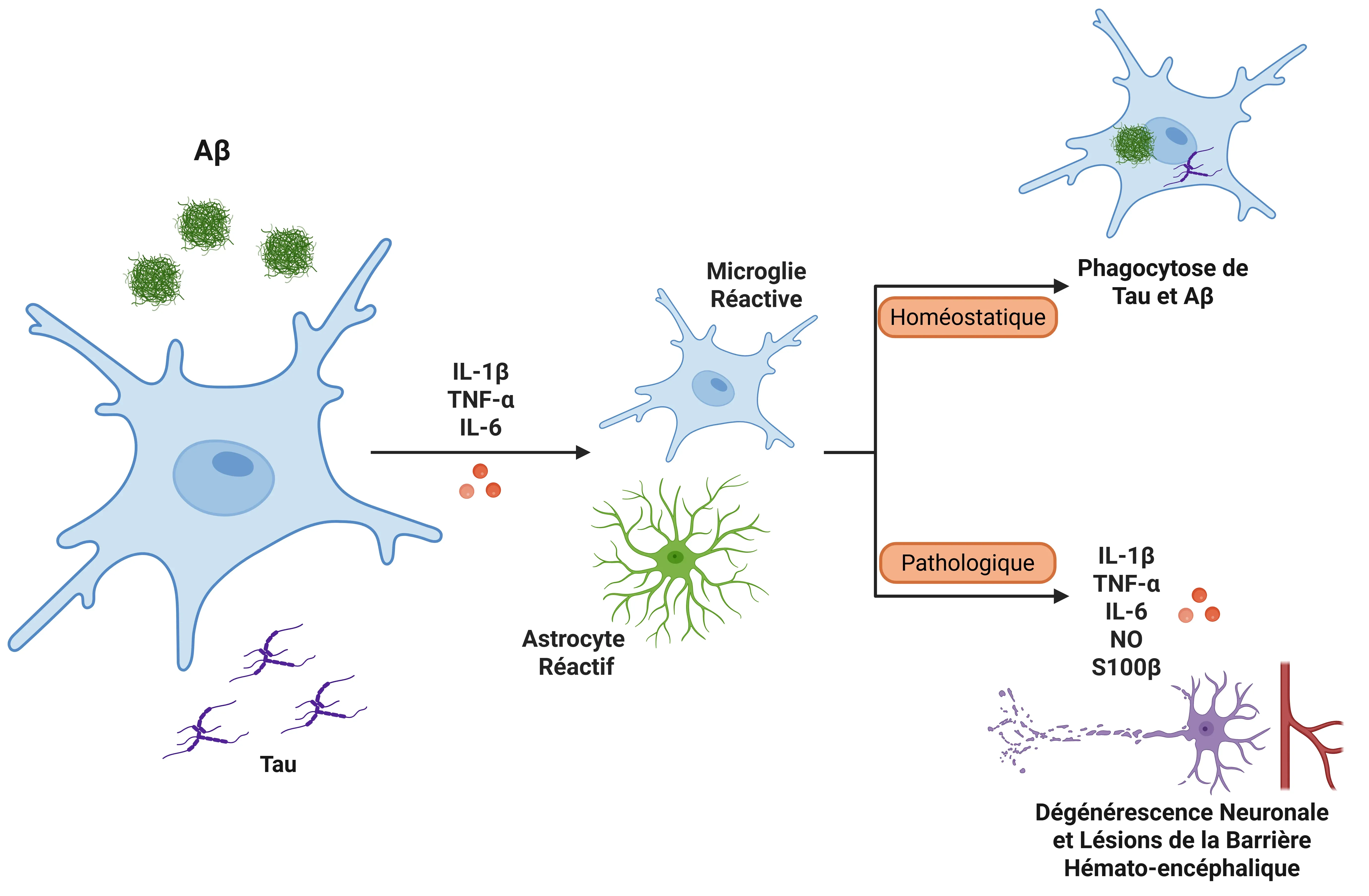
L'IL-1B peut activer les microglies et les astrocytes dans le contexte de la MA (Ghosh, 2013). Lorsque l'IL-1B est libérée, elle induit l'expression d'autres cytokines pro-inflammatoires, telles que le TNF-α et l'IL-6, amplifiant ainsi la réponse inflammatoire.
- Microglia : Les microglies peuvent initialement aider à lutter contre la MA en éliminant l'amyloïde bêta ; une activation chronique peut toutefois submerger ce système, entraînant une neuroinflammation. Cette activation conduit à une boucle de rétroaction dans laquelle les microglies libèrent davantage d'IL-1β et d'autres médiateurs inflammatoires, compromettant finalement l'élimination de l'amyloïde bêta et endommageant la barrière hémato-encéphalique (BHE) (Shaftel, 2008; Valiukas, 2025).
- Astrocytes : Les astrocytes peuvent produire des réponses exagérées à l'IL-1&beta lorsqu'ils sont activés par l'amyloïde bêta, ce qui contribue encore davantage à l'inflammation. La libération d'oxyde nitrique induite par l'IL-1β peut également entraîner une neurotoxicité. Les astrocytes, en particulier ceux qui surexpriment l'IL-1β, peuvent libérer la S100β, une protéine impliquée dans les lésions neuronales et l'exacerbation des processus inflammatoires (Mrak, 2000; Sama, 2008).
L'IL-1β est impliquée dans la pathologie tau, car elle stimule l'hyperphosphorylation de la protéine tau par l'activation microgliale et les voies de signalisation MAPK, ce qui peut perturber la stabilité des microtubules et contribuer à la formation d'enchevêtrements neurofibrillaires (Griffin, 2006; Shaftel, 2008; Ghosh, 2013). De plus, l'IL-1β est liée à la production et au dépôt de bêta-amyloïde. Les cytokines inflammatoires, notamment l'IL-1β, l'IL-6 et le TGF-β, s'accumulent autour des plaques amyloïdes dans le cerveau des personnes atteintes de la MA (Italiani, 2018). La surexpression de l'IL-1β est corrélée à une augmentation de la formation de plaques et à la croissance de neurites dystrophiques (Mrak, 2001).
Il est intéressant de noter que, malgré son rôle pro-inflammatoire, l'IL-1β pourrait également participer à des mécanismes de protection contre la MA. Dans un modèle murin transgénique de MA conçu pour la surexpression de l'IL-1β, une neuroinflammation prolongée a entraîné l'activation des astrocytes et des microglies, ainsi qu'une augmentation des cytokines pro-inflammatoires. Après quatre semaines de surexpression de l'IL-1β, ils ont observé une réduction de la pathologie amyloïde, suggérant une amélioration de la clairance microgliale de l'amyloïde bêta (Shaftel, 2007; Shaftel, 2008; Matousek, 2012).
Outre l'implication directe de l'IL-1β dans le cerveau, l'inflammation systémique périphérique peut également influencer et augmenter les niveaux d'IL-1β dans le cerveau, ce qui pourrait avoir un impact sur la pathologie de la MA (Wang, 2023). Diverses études sur des modèles murins indiquent que des agents systémiques, tels que le lipopolysaccharide (LPS), peuvent augmenter les dépôts de Aβ et entraîner des déficits cognitifs (Xie, 2021).
En raison de son implication dans la MA, l'IL-1β est apparue comme un biomarqueur potentiel, mais les études ont donné des résultats mitigés concernant ses niveaux dans le liquide céphalo-rachidien (LCR) et les tissus cérébraux des patients atteints (Ng, 2018; Scarabino, 2020). En fin de compte, des recherches supplémentaires sont nécessaires pour élucider la relation complexe entre l'IL-1β, la neuroinflammation et les différentes caractéristiques pathologiques de la maladie d'Alzheimer. La compréhension des mécanismes spécifiques par lesquels l'IL-1β influence la pathologie tau et la clairance amyloïde pourrait ouvrir la voie au développement de thérapies ciblées contre cette maladie dévastatrice.
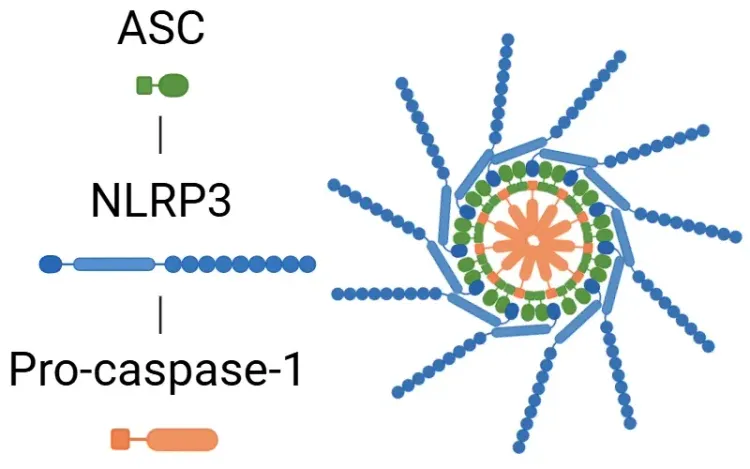
Maladies représentatives associées à l'activation de l'inflammasome.
La dérégulation de l'inflammasome est associée à un large éventail de maladies, notamment des troubles neurodégénératifs, cardiovasculaires, auto-immuns et métaboliques. La figure met en évidence des exemples clés, mais de nombreuses autres maladies impliquent également les voies de l'inflammasome.
La maladie de Parkinson
La maladie de Parkinson est une affection neurodégénérative caractérisée par la dégénérescence progressive des neurones dopaminergiques dans la substance noire des ganglions de la base, située dans le mésencéphale. Cette dégénérescence est associée à l'agrégation de l'alpha-synucléine dans les neurones.
La cytokine pro-inflammatoire IL-1β joue un rôle important dans la neuroinflammation et la neurodégénérescence dans la MP. Sa production est étroitement liée à l'activation de l'inflammasome NLRP3 dans les microglies. L'alpha-synucléine mal repliée active la signalisation TLR2/TLR4 des microglies, ce qui entraîne l'assemblage de l'inflammasome, l'activation de la caspase-1 et la conversion de la pro-IL-1β en sa forme active sécrétée (Koprich, 2008; Pott Godoy, 2008; Leal, 2013; Stojakovic, 2017; Tansey, 2022; Dzamko, 2023). Une élévation de l'IL-1β est détectée dans les régions dopaminergiques du cerveau, le LCR et le sang, en corrélation avec la gravité de la maladie et la progression des symptômes, y compris les troubles cognitifs (Dursun, 2015; Liu, 2022; Dzamko, 2023; Qu, 2023). En outre, d'autres cytokines pro-inflammatoires, telles que le TNF-α, l'IFN-γ, l'IL-6, l'IL-2 et l'IL-10, ont également été trouvées en concentration élevée dans le plasma (Xu, 2024).
Dans le contexte de la MP, les microglies sont les principaux producteurs et sécréteurs d'IL-1β :
- L'activation chronique perpétue la neuroinflammation via la libération d'IL-1β, de TNF-α, d'IL-6, d'espèces réactives de l'oxygène (ERO), d'oxyde nitrique et de TGF-β, créant un milieu toxique pour les neurones dopaminergiques dans la substance noire et le striatum (Leal, 2013; Tansey, 2022; Liu, 2022).
- Une activation microgliale robuste, y compris la transition vers des états phagocytaires, a été observée dans des modèles animaux de la MP, favorisant un cycle de lésions neuronales et d'inflammation supplémentaire (Ferrari, 2006; Pott Godoy, 2008).
- Des mutations génétiques, telles que LRRK2 et PINK1, peuvent augmenter la production d'IL-1β par les microglies et exacerber la neuroinflammation (Liu, 2022).
Les astrocytes contribuent également à la neuroinflammation dans la MP:
- Bien que les microglies soient responsables de la production d'IL-1β, les astrocytes régulent à la hausse les cytokines, notamment l'IL-1β et l'IL-6, lors d'une stimulation inflammatoire et peuvent potentialiser les réponses microgliales par le biais de voies dépendantes du NF-κB.
- L'activation astrocytaire augmente avec l'inflammation chronique, contribuant à l'astrogliose, à la formation de cicatrices et à la modulation du milieu inflammatoire.
- L'interaction entre les astrocytes et les microglies amplifie la toxicité dopaminergique (Ferrari, 2006; Leal, 2013).
Collectivement, l'axe IL-1β/inflammasome, principalement induit par les microglies et soutenu par les astrocytes, propage une neuroinflammation chronique, une perte de neurones dopaminergiques et la progression des symptômes de la MP (Leal, 2013; Tansey, 2022; Dzamko, 2023).
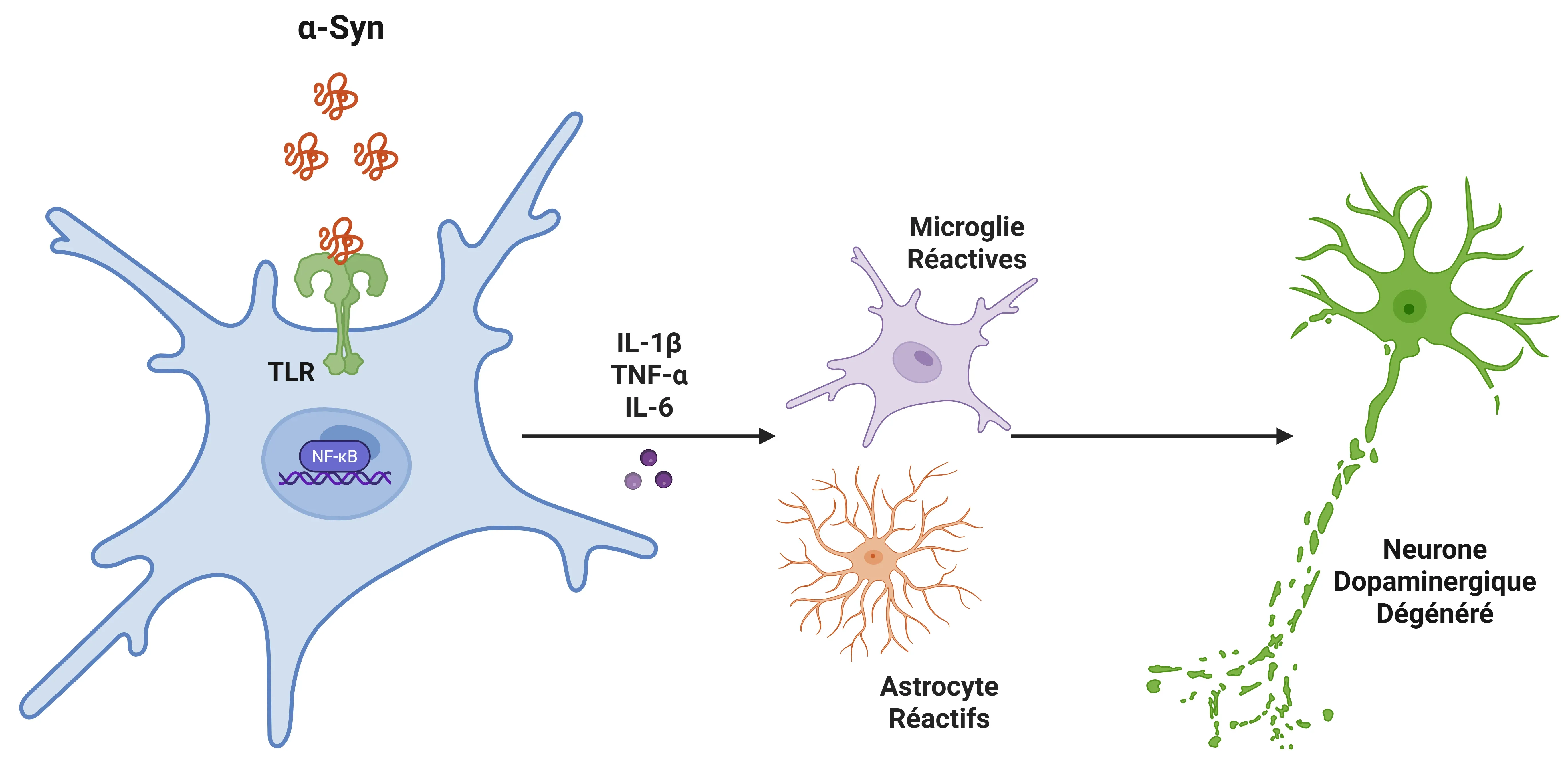
L'IL-1β dans la maladie de Parkinson (MP).
L'alpha-synucléine se lie aux récepteurs Toll-like (TLR) des microglies, déclenchant une cascade de signaux qui active NF-kappaB. Cela entraîne une augmentation des cytokines pro-inflammatoires, qui recrutent davantage de microglies et d'astrocytes, favorisant ainsi l'inflammation. À terme, cela conduit à la dégénérescence des neurones dopaminergiques dans la substance noire.
Sclérose latérale amyotrophique
Les cytokines pro-inflammatoires, telles que l'IL-1β, l'IL-6, l'IL-18 et le TNF-α, sont des médiateurs de la neuroinflammation dans la SLA. Des taux élevés de ces cytokines ont été observés dans le LCR et le sérum de patients ainsi que dans des modèles animaux de SLA (Xu, 2024).
La TDP-43 et la SOD1 mutante (qui sont liées à la SLA familiale) peuvent être absorbées par les microglies, activant un inflammasome contenant de la caspase-1 qui transforme la pro-IL-1β en sa forme active, l'IL-1β. Ce processus déclenche une cascade d'inflammations neurotoxiques, accélérant ainsi la progression de la maladie (Fogal, 2008; Meissner, 2010; van der Meer, 2010; Italiani, 2014; Olesen, 2020; Garofalo, 2022). Les astrocytes contribuent également à la neuroinflammation en adoptant des phénotypes réactifs, en modulant l'expression des gènes inflammatoires et en influençant l'environnement inflammatoire, bien que leur implication directe dans la production d'IL-1β soit moins importante (Meissner, 2010; Garofalo, 2022).
Les taux d'IL-1β dans le LCR et le sérum sont corrélés à des formes plus agressives de la maladie, en particulier dans des sous-types génétiques spécifiques tels que la SLA C9orf72. En revanche, les effets tissulaires spécifiques de l'IL-1β sont plus prononcés dans la SLA sporadique (Italiani, 2014; Olesen, 2020). Les analyses en composantes principales du LCR chez les patients atteints de SLA indiquent que l'IL-1β fait partie d'une signature inflammatoire plus large, qui comprend l'IL-2, l'IL-6, l'IL-13, le TNF-α et d'autres.
Le débat reste ouvert quant à savoir si la neuroinflammation est un facteur primaire ou une conséquence secondaire de la dégénérescence des motoneurones, en raison de la variabilité de la détectabilité de l'IL-1β dans les échantillons humains par rapport aux modèles animaux, ainsi que du double rôle de l'IL-1β, qui peut être soit neurotoxique, soit neuroprotectrice selon le contexte et le moment (Italiani, 2014; Boraschi, 2023; Femiano, 2024).
Dans l'ensemble, l'IL-1β et les molécules inflammatoires associées contribuent à la vulnérabilité neuronale par le biais de mécanismes impliquant la neurotoxicité, le stress oxydatif et le dysfonctionnement synaptique, soulignant ainsi le rôle de l'inflammation dans la progression de la SLA.
Quelles interventions thérapeutiques ciblent l'IL-1β dans le traitement des maladies neurodégénératives ?
L'IL-1β joue un rôle essentiel dans la neuroinflammation associée à diverses maladies neurodégénératives. Par conséquent, l'IL-1β a été ciblée afin de réduire la neuroinflammation, principalement par l'utilisation d'antagonistes des récepteurs de l'IL-1 (IL-1Ra). Les principales options d'IL-1Ra sont les suivantes :
- Anakinra : il s'agit d'un IL-1Ra humain qui inhibe l'activité de l'IL-1α et de l'IL-1β.
- Rilonacept : ce médicament combine les parties extracellulaires de l'IL-1R1 et de l'IL-1R3 humains avec la partie Fc de l'IgG1 humaine afin d'inhiber l'IL-1α et l'IL-1β à long terme.
- Canakinumab : il s'agit d'un anticorps monoclonal IgG1 humain qui cible spécifiquement l'IL-1&bêta.
Dans les modèles animaux de la MA:
- L'administration chronique d'un anticorps bloquant le récepteur de l'IL-1 chez des souris 3xTg-AD a montré une réduction de l'inflammation cérébrale, une atténuation des troubles cognitifs et une diminution de la pathologie tau, tout en réduisant partiellement certaines formes d'amyloïde bêta. Ces changements étaient corrélés à une réduction de l'activité NF-κB et à une diminution des niveaux de tau phosphorylé et de tau kinases (Kitazawa, 2011).
- Il est important de noter que l'IL-1β est nécessaire à l'élimination de l'amyloïde bêta, ce qui pourrait expliquer en partie les résultats mitigés obtenus dans le traitement de la MA par le blocage de l'IL-1β (Rivera-Escalera, 2019).
Dans différents modèles de PD chez le rat :
- L'administration périphérique d'Anakinra et la surexpression de l'IL-1Ra par AAV se sont révélées prometteuses pour réduire la neurodégénérescence dopaminergique et les cytokines pro-inflammatoires (Dzamko, 2023).
- L'injection de lipopolysaccharide dans la SN après exposition à la 6-hydroxydopamine a entraîné une augmentation de la neurodégénérescence et des symptômes moteurs, qui ont été inhibés par le traitement par IL-1Ra (Koprich, 2008).
Dans des modèles animaux de SLA:
- Des études précliniques chez des souris transgéniques SOD1 ont montré que l'anakinra prolongeait la survie et améliorait la fonction motrice pendant la phase active de la maladie (van der Meer, 2010; Meissner, 2010).
- Il a également été démontré que le blocage de l'IL-1Ra dans des modèles murins de SLA prolongeait la survie, mais n'avait pas d'effet sur l'apparition de la maladie (Maier, 2015).
- Bien que le blocage de l'IL-1β réduise la neuroinflammation, il est difficile de transposer ces résultats à la SLA humaine en raison de problèmes tels que la faible pénétration des médicaments dans le SNC et le développement rapide d'anticorps neutralisant le traitement. Des doses élevées d'Anakinra sont nécessaires pour atteindre efficacement le SNC (van der Meer, 2010; Maier, 2015).
D'autres traitements qui réduisent les niveaux d'IL-1β et l'activation microgliale comprennent l'administration de dexaméthasone (un stéroïde anti-inflammatoire) et de MCC950 (un inhibiteur de NLRP3) (Pott Godoy, 2008; Liu, 2022).
En résumé, le ciblage de l'inflammation induite par l'IL-1β présente un potentiel thérapeutique. Cependant, la complexité des fonctions pléiotropiques de l'IL-1β (à la fois toxiques et protectrices) suggère que les traitements anti-IL-1β généraux pourraient avoir un succès limité. Des traitements plus récents ciblant l'IL-1β, tels que le rilonacept et le canakinumab, sont encore à l'étude et semblent prometteurs pour le traitement futur des maladies neurodégénératives.
Notre équipe se fera un plaisir de répondre à vos questions sur l'interleukine-1 bêta (IL-1β) ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur l'interleukine-1 bêta (IL-1β) et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Qu'est-ce qu'un inflammasome?
Présentation générale des inflammasomes, notamment leurs mécanismes d'action, leur rôle dans les maladies et leur ciblage pour le développement de médicaments.
Qu'est-ce que le NLRP3?
Présentation générale du NLRP3 et des déclencheurs de l'activation de l'inflammasome NLRP3, des associations avec des maladies et des stratégies thérapeutiques ciblées.
Qu'est-ce que l'IL-1β?
Présentation générale de l'IL-1β, de son rôle pro-inflammatoire dans les maladies systémiques et neurologiques, et des stratégies thérapeutiques impliquant l'antagonisme de l'IL-1β.
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.