什么是 TDP-43 ΔNLS 转基因小鼠模型?
TDP-43 ΔNLS模型,也称为deltaNLS、delta NLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、NEFH-hTDP-43ΔNLS、dNLS、TDP43 NLS、rNLS和rNLS8,是Walker及其同事于2015年首次报道的转基因小鼠。该模型的关键独特之处在于,表达的人TDP-43蛋白具有缺陷的核定位信号(NLS),无法转移到细胞核(正常情况下,TDP-43蛋白会定位并发挥作用)。TDP-43蛋白在神经细胞质中积聚,导致形成聚集体,包括磷酸化TDP-43聚集体,与ALS患者体内观察到的聚集体类似。
在该模型中,hTDP-43ΔNLS的表达受神经丝重链(NEFH)启动子的控制,从而将其限制在神经元中。在Igaz及其同事报告的前身模型中,表达受Camk2a启动子的控制,这导致脑细胞质中TDP-43的积累,但病理TDP-43聚集物极少,且缺乏ALS样表型。这种表达可通过四环素类似物强力霉素(Dox)进行“调节”(因此称为“rNLS”)。rNLS8双转基因系在脑和脊髓中表达hTDP-43ΔNLS,是通过以下两个转基因系杂交产生的:NEFH-tTA(第8系;NEFH启动子控制四环素受体激活蛋白[tTA]的表达)和tetO-hTDP-43ΔNLS(第4系;四环素操作子启动子[tetO]控制hTDP-43ΔNLS的表达)。在繁殖期间和出生后的前几周(通常为5-12周大),双转基因小鼠以含有Dox的饮食为食,以抑制hTDP-43ΔNLS的表达。通过改用标准饲料(“停用Dox”模型)来诱发疾病。请注意,以Dox饲料喂养的小鼠(“使用Dox”小鼠)可作为对照组,因为它们没有出现疾病迹象。
该模型的一个关键特征是,通过恢复Dox饮食,能够实现病理和功能恢复。该模型中疾病进展的停止和可逆性表明,通过调节TDP-43表达和病理聚集,疾病改变是可能的,因此它成为ALS药物开发的一个有吸引力的模型。
最初的ΔNLS模型进展迅速,体重减轻和运动症状通常在停用多柔比星后一周内出现,并在几周内死亡。作为更适合大多数疗效研究的替代方案,我们的团队使用替代的多柔比星方案开发了一种进展较慢的模型。在我们的“低剂量阿霉素”模型中,会产生类似的表型,但会在更长时间内发展,小鼠在模型诱导后至少能存活3个月。
TDP-43 ΔNLS小鼠身上的人类ALS的关键特征是什么?
ALS是一种致命的神经退行性疾病,会影响人体的多个系统,包括中枢神经系统(CNS)、周围神经系统(PNS)、自主神经系统(ANS)、肌肉和免疫系统。 如下图所示,ΔNLS模型已被证明能够重现其中一些特征,而其他特征(例如ANS 和免疫系统)仍有待探索。
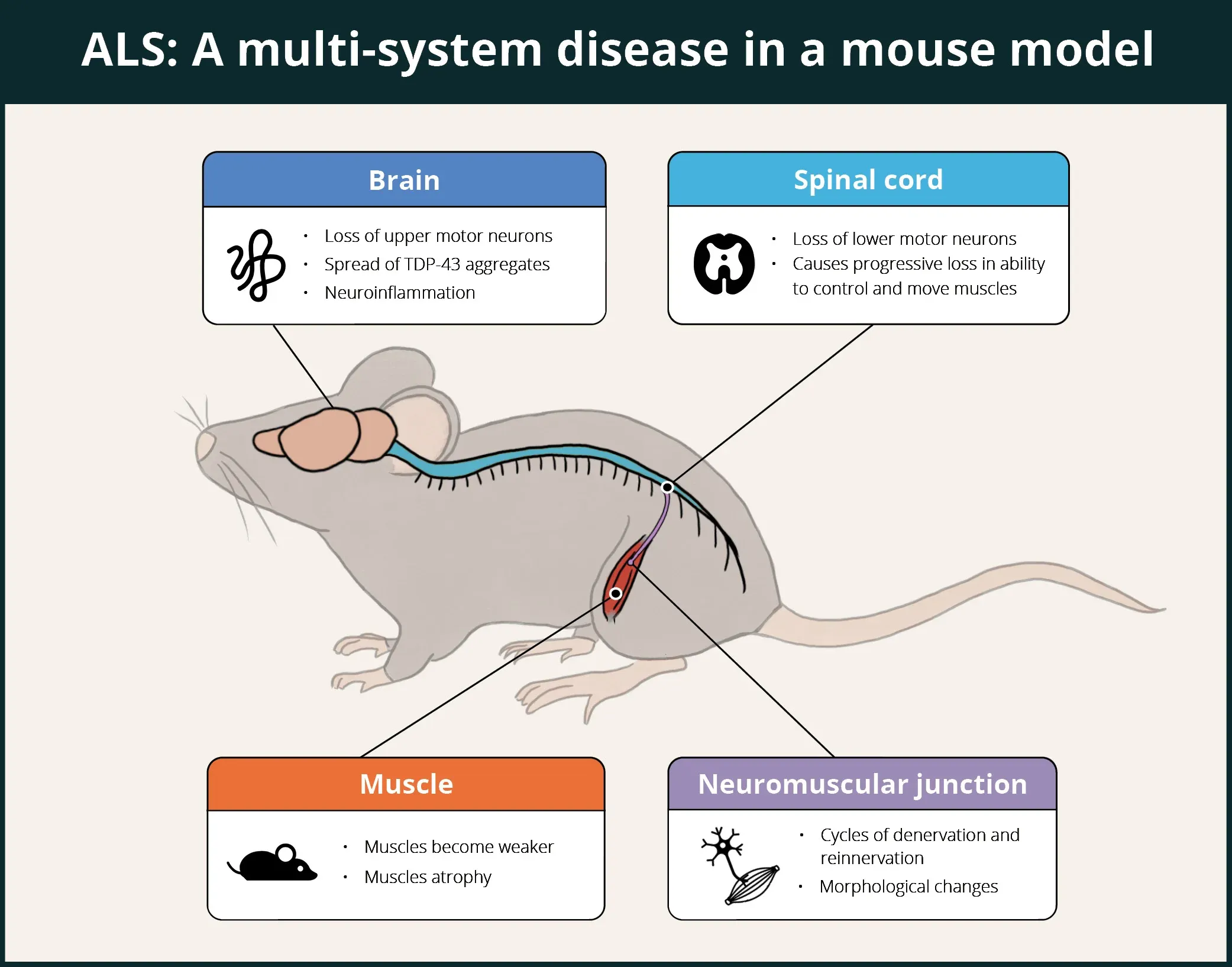
TDP-43 ΔNLS小鼠表现出多系统受累,包括大脑、脊髓、神经肌肉接头(NMJ)和肌肉,因此成为评估ALS假定治疗药物的良好模型。
点击复制链接
在脑部,ΔNLS小鼠表现出细胞质TDP-43聚集(包括磷酸化TDP-43)、神经变性、淋巴管功能受损、神经炎症(小胶质细胞和星形胶质细胞)以及蛋白质组学特征,这些特征与TDP-43蛋白病患者的死后脑组织特征相关。
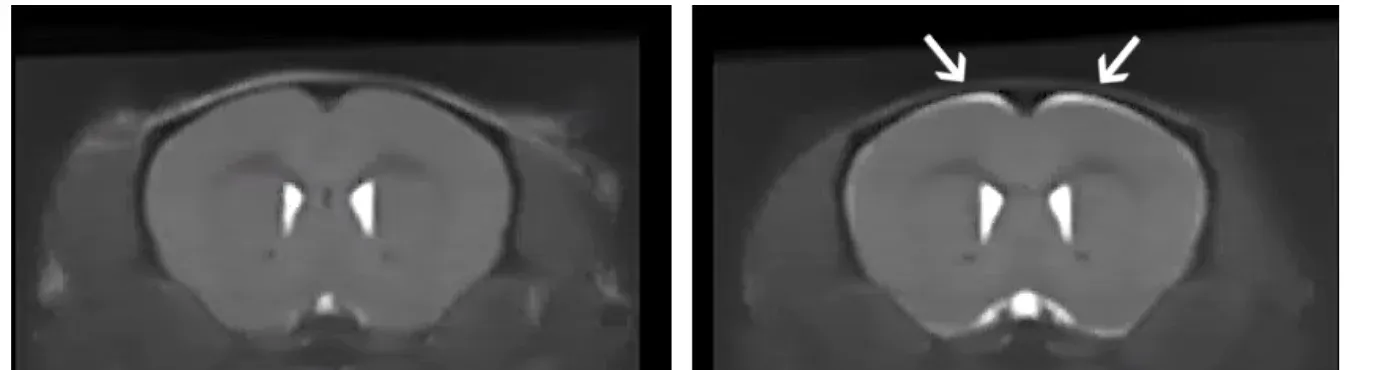
对照组(左)和停用Dox的ΔNLS小鼠(右)的解剖核磁共振成像。请注意,特定区域有明亮信号,表明ΔNLS小鼠的脑部萎缩。
在神经炎症方面,小胶质细胞在这个模型中扮演着有趣的角色 。Spiller等人发现,通过让小鼠重新服用Dox来阻止TDP-43的表达后,小胶质细胞会短暂增殖并改变其形态和基因表达,从而促进胞浆TDP-43的清除。当小胶质细胞耗竭时,恢复能力就会减弱。 Hunter等人对进展期和恢复期进行了转录组分析,发现差异表达基因与趋化性、吞噬作用、炎症和神经保护因子的产生有关 。Swanson等人发现,小胶质细胞在疾病的早期阶段具有吞噬作用,在后期阶段则转变为功能失调状态,这些功能状态是由磷酸化TDP-43聚集引起的。
在脊髓中, Spiller等人发现,慢速运动神经元具有弹性,而快速疲劳运动神经元则丧失弹性,轴突萎缩首先发生在快肌纤维,而慢肌纤维仍保持神经支配。这些在小鼠模型中的发现反映了人类疾病中运动神经元退化的选择性模式。
Walker等人报告了神经肌肉接头(NMJ)早期和渐进性神经支配缺失 。Hur等人证实,运动神经元的特性决定了神经肌肉接头对TDP-43病理的易感性,而慢运动神经元能够驱动运动系统的恢复,这是它们对TDP-43相关神经退行性病变具有恢复力的表现。包括 Spiller等人在内的多篇论文都报告了复合肌肉动作电位(CMAP)振幅的降低。
在肌肉受累方面,肌肉无力、纤维群萎缩和肌核集中化已在肌肉纤维中找到,Walker及其同事还报告了腓肠肌和胫骨前肌的肌肉质量下降。 Tsitkanou等人发现,在胫骨前肌、股四头肌和膈肌的神经肌肉纤维中,TDP-43和寡聚A11β淀粉样蛋白在细胞质中积聚。他们还发现胫骨前肌、股四头肌和腓肠肌萎缩,肌源性和神经肌肉接头(NMJ)压力标记上调,运动功能和肌肉力量产生受损,与线粒体复合体相关的几种蛋白质失调。
我们的研究小组使用非侵入性计算机断层扫描(CT)图像来证明选择性肌肉萎缩,这种萎缩在我们的“低剂量阿霉素”小鼠模型中影响最严重的是后肢腓肠肌。
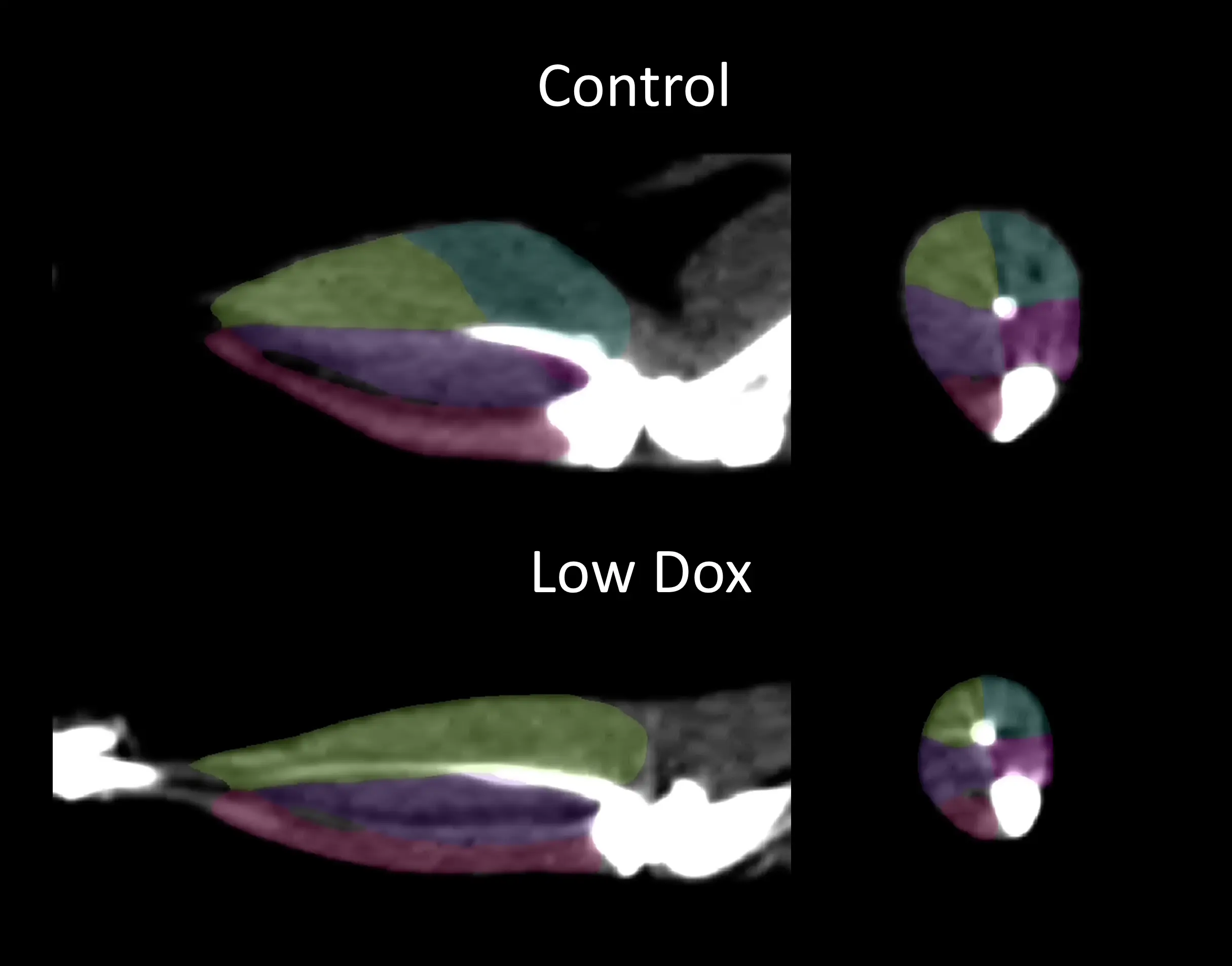
CT图像,显示对照组(多柔比星)和“低剂量多柔比星”TDP-43 ΔNLS小鼠后肢肌肉的分割;内侧腓肠肌=蓝色;外侧腓肠肌=黄色;胫骨后肌=紫色;胫骨前肌=粉红色;比目鱼肌=品红色。
对照组和“低剂量”TDP-43 ΔNLS小鼠内侧(蓝色)和外侧(黄色)腓肠肌的3D体积渲染图。
在TDP-43ΔNLS ALS小鼠模型中,采用了哪些措施来评估治疗效果?
多个研究小组通过治疗干预证实了这种小鼠模型的疾病改良效果 。Young等人证实了小分子PIKfyve抑制剂AIT-101(INN:阿匹莫德,又名LAM-002A)在Biospective的rNLS8模型低剂量多柔比星版本中,能够减轻体重减轻、运动障碍(包括后肢抓握、后肢瘫痪和格栅敏捷性),同时降低血浆和脑脊液神经丝轻链(NfL)水平、TDP-43聚集(通过IHC)和神经炎症(通过GFAP IHC)。
Stomakhina等人发现,在28天时间内,接受VRG50304治疗的rNLS8小鼠的血浆和脑脊液神经丝轻链(NfL)水平降低,尾状皮层酸性鞘氨醇酶(ASM)活性降低。 Droppelmann等人发现,在rNLS8模型中,脑室注射AAV9/NF242 N端片段(即罗氏鸟嘌呤核苷酸交换因子[RGNEF])可延长寿命,改善运动表现(后肢抓握、开放区域、步态[CatWalk]),并降低神经炎症标志物(GFAP和Iba-1)。
我们的团队非常乐意回答有关TDP-43 ΔNLS ALS小鼠模型的任何问题,或提供有关我们用于治疗功效研究的模型的具体信息。
了解更多关于我们的ALS车型的信息
相关内容
关于肌萎缩侧索硬化症的最新信息,以及ALS动物模型治疗剂评估的最佳实践。
神经肌肉接头(NMJ)形态学与ALS模型
对神经肌肉接头(NMJ)及其在肌萎缩侧索硬化症(ALS)中作用的深入理解,以及用于研究NMJ形态学变化的工具和方法。
ALS 小鼠模型和脊髓运动神经元
脊髓运动神经元在小鼠肌萎缩侧索硬化症(ALS)模型中疾病进展的概述。
ALS小鼠模型用于药物研发
指导如何最有效地使用肌萎缩侧索硬化症(ALS)的实验动物模型(小鼠和大鼠模型)进行临床前治疗测试。
ALS、阿尔茨海默氏症和帕金森氏症中的微胶质形态
概述微胶质形态学分析及其在神经退行性疾病研究和药物研发中的应用。