Dénervation de la jonction neuromusculaire (NMJ) dans le modèle TDP-43ΔNLS (rNLS8) de la SLA
Découvrez ce service :
- Quels services Biospective propose-t-il pour la marquage et l'analyse des jonctions neuromusculaires (NMJ) ?
- Quel est le processus de Biospective pour la marquage et l'analyse NMJ ?
- Qu'est-ce que la jonction neuromusculaire (NMJ) ?
- Quelle est la valeur de l'analyse NMJ dans les modèles animaux ?
- Comment la jonction neuromusculaire est-elle affectée dans le modèle murin TDP-43ΔNLS (rNLS8) de la SLA ?
- Comment l'automatisation améliore-t-elle les résultats ?
Quels services Biospective propose-t-il pour la marquage et l'analyse des jonctions neuromusculaires (JNM) ?
La jonction neuromusculaire (JNM) est affectée dans un large éventail de maladies neurologiques et musculaires, notamment :
- La scléroselatérale amyotrophique (SLA)(Verma, 2022)
- La myasthénie grave (Vincent, 2002)
- La maladie de Charcot-Marie-Tooth (Cipriani, 2018)
- L'amyotrophiespinale (SMA)(Murray,2010) et
- La dystrophie musculaire de Duchenne (DMD) (Pratt, 2015)
L'analyse quantitative des caractéristiques de la jonction neuromusculaire (JNM), telles que l'innervation et la dénervation de la JNM, est essentielle pour comprendre la progression de la maladie et la réponse à l'intervention thérapeutique, en particulier en ce qui concerne la pathologie de la SLA et la pathologie de la JNM dans d'autres modèles de maladies neuromusculaires. Notre équipe chez Biospective a développé des méthodes robustes pour la marquage immunofluorescente multiplexe et l'analyse quantitative d'images de JNM à partir de coupes de tissu musculaire, y compris l'optimisation pour les études sur la jonction neuromusculaire dans la SLA.
Quel est le processus de Biospective pour la marquage et l'analyse des jonctions neuromusculaires ?
Notre processus de marquage et d'analyse des jonctions neuromusculaires
Chez Biospective, nous avons mis en place un processus standardisé et hautement reproductible en plusieurs étapes pour la marquage et l'analyse des jonctions neuromusculaires à partir de muscles fixés au formol :
1. Sectionnement des tissus
- Nous incluons les muscles dans de l'OCT avant de les congeler et de les stocker à-80 °C.
- Nous produisons des coupes de tissus fixés et congelés de haute qualité à l'aide de microtomes spécialement équipés.
- Les coupessont montées surdes lames de verre haute performance afin de garantir leur adhérencependant le processus de marquage.
2. Immunofluorescence multiplexe marquage NMJ des coupes tissulaires
- Nous effectuons une marquage multiplex pour :
- Terminaison présynaptique (SV2A)
- Plaques motrices (alpha-bungarotoxine)
- Axone innervant (bêta-III-tubuline)
- La marquage est réalisée à l'aide d'un instrument IHC/IF automatisé à haut débit afin de garantir la cohérence et la reproductibilité.
3. Numérisation des lames
- Les sections entières sont numérisées à une résolution spatiale ultra-élevée à l'aide d'un scanner de lames numériques.
- Les images obtenuessont utilisées à la fois pour la visualisation et l'analyse quantitative.
4. Segmentation d'images, quantification NMJ et analyse NMJ
- Nos scientifiques spécialisés en imagerie ont développé des méthodes de segmentation avancées et entièrement automatisées pour les terminaisons présynaptiques (SV2A), les plaques motrices (α-bungarotoxine) et les axones innervants (β-III-tubuline).
- Nosoutils d'analyse des jonctions neuromusculaires permettent une quantificationà haut débit et à faible biais des jonctions neuromusculaires .
- Nous dérivons une série de mesures quantitatives à partir des images segmentées afin de caractériser la morphologie et l'état fonctionneldes jonctions neuromusculaires
Directives relatives au prélèvement, à la préparation et à l'expédition des échantillons
Nous fournissons une assistance complète afin de garantir l'intégrité des échantillons et la fiabilité des données :
- Collecte des échantillons : les animaux doivent être perfusés avec du PBS froid et/ou du formol tamponné neutre à 10 %, et les muscles doivent être soigneusement extraits.
- Préparation des échantillons : les tissusmusculaires doivent être brièvement fixés dans du formol tamponné neutre à 10 % et congelés rapidement.
- Expédition des échantillons : les échantillons doivent être expédiés dans de la glace carbonique à l'aide de conteneurs isothermes, en évitant les cycles répétés de congélation-décongélation.
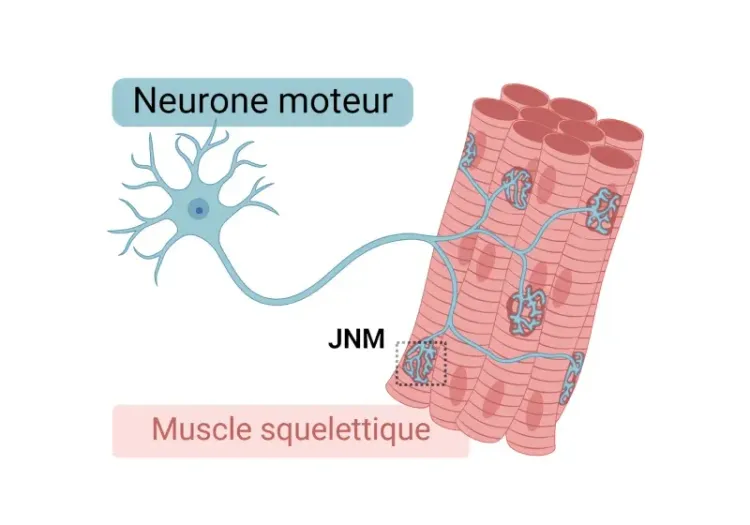
Schéma illustrant les principaux composants de la jonction neuromusculaire (JNM), notamment les terminaisons présynaptiques des motoneurones, la plaque motrice postsynaptique, les cellules de Schwann terminales et les kranocytes. Abréviations : jonction neuromusculaire (JNM), acétylcholine (ACh), récepteursde l'ACh (AChR).
Qu'est-ce que la jonction neuromusculaire (JNM) ?
La jonction neuromusculaire (JNM) est une synapse spécialisée qui permet la communication entre les motoneurones et les fibres musculaires squelettiques, permettant ainsi des contractions musculaires précises . Les terminaisons présynaptiques des motoneurones libèrent de l'acétylcholine (ACh) en réponse à des signaux électriques, qui se lie aux récepteurs de la plaque motrice de la membrane musculaire, déclenchant un potentiel d'action et la contraction musculairequi s'ensuit.
Pourquoi analyser la JNM ?
- Site précoce de la pathologie : les JNM sont touchées avant la perte des motoneurones dans de nombreuses maladies neurodégénératives (processus de « dépérissement »).
- Lecture quantitative : permet de surveiller la dénervation, le remodelage et la réponse thérapeutique dans les modèles précliniques.
- Accessibilité expérimentale : leur emplacement périphérique permet une imagerie et une analyse robustes, facilitant l'évaluation haute résolution de l'intégrité synaptique.
Dans cette vidéo, nous présentons un aperçu de notre technique de marquage et d'analyse des jonctions neuromusculaires (JNM). Elle comprend également un exemple illustratif de dénervation des JNM dans un modèle murin de SLA, démontrant comment nos services peuvent être utilisés pour mesurer la neurodégénérescence, surveiller la progression de la maladie et évaluer des thérapies potentielles dans le cadre d'études précliniques.
Veuillez cliquer pour copier le lien.
Quelle est la valeur de l'analyse de la jonction neuromusculaire dans les modèles animaux ?
La NMJ est très sensible aux changements d'innervation, aux altérations morphologiques et à la dégénérescence dans plusieurs maladies neuromusculaires. L'analyse NMJ dans les modèles animaux permet aux chercheurs de surveiller la progression de la maladie et d'évaluer l'efficacité des agents thérapeutiques expérimentaux dans les études précliniques.
Grâce à nos plateformes d'imagerie validées, à notre expertise scientifique et à notre vaste expérience, nous fournissons une quantification robuste et reproductible de la NMJ sur divers modèles et espèces. Nous mettons ici en évidence les altérations de la NMJ dans un modèle murin de SLA que nous utilisons régulièrement pour tester de nouvelles interventions thérapeutiques.
Modèles de sclérose latérale amyotrophique (SLA) et pathologie NMJ de la SLA
Un modèle animal optimal de la SLA (ou maladie du motoneurone [MND]) devrait présenter les caractéristiques clés suivantes :
- Similitude des symptômes avec ceux de la SLA / MND humaine, y compris les déficits moteurs et la vulnérabilité de la jonction neuromusculaire
- Évolution progressive de la maladie, permettant des études longitudinales de la pathologie
- Modification de la maladie, permettant des interventions qui altèrent la progression de la maladie
- Disponibilité d'animaux d'âge approprié pour les études précliniques
- Faible variabilité entre les animaux, garantissant des résultats reproductibles entre les cohortes
Modèle TDP-43ΔNLS (rNLS8)
Le modèle murin TDP-43ΔNLS (rNLS8)répond à ces critères,ce qui enfait un système intéressant pour le développement de médicaments contre la SLA. Ce modèle exprime la protéine humaine TDP-43 avec un signal de localisation nucléaire (NLS) défectueux, ce qui altère l'importation nucléaire et entraîne une accumulation cytoplasmique de TDP-43 dans les neurones. Au fil du temps, cette protéine mal localisée forme des agrégats de TDP-43 phosphorylés, reproduisant les principales caractéristiques pathologiques observées chez les patients atteints de SLA.
Chez Biospective, nous utilisons à la fois la version originale et la version modifiée du modèle murin rNLS8 de la protéinopathie TDP-43 :
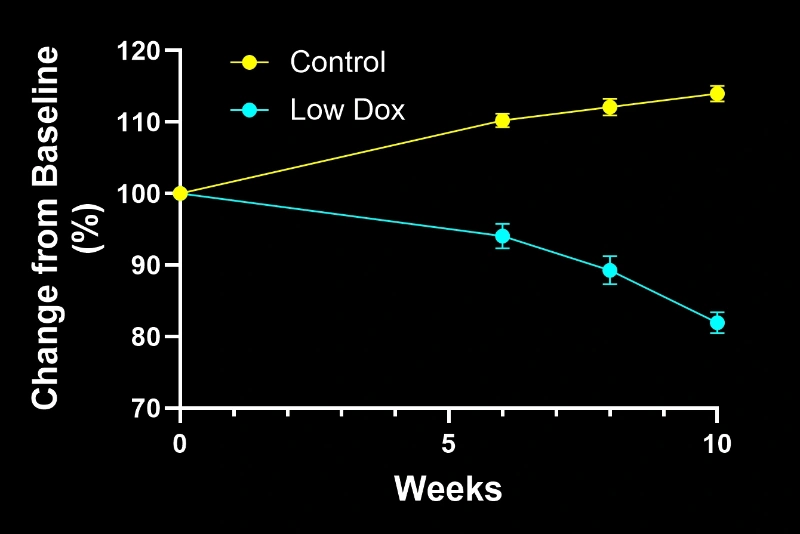
- Modèle murin original (« Off Dox »): progression rapide de la maladie en quelques semaines
- Modèle murin Biospective (« Low Dox »): progression plus lente de la maladie sur plusieurs mois
Les deux modèles présentent une pathologie progressive, notamment :
- Dégénérescence des motoneurones et atrophie cérébrale régionale
- Accumulation cytoplasmique de TDP-43 et agrégats de TDP-43 phosphorylée
- Déficits moteurs
- Pathologie du cerveau, de la moelle épinière et de la jonction neuromusculaire (JNM)
Pour plus d'informations, veuillez consulter nos ressources :
Comment la jonction neuromusculaire est-elle affectée dans le modèle murin TDP-43ΔNLS (rNLS8) de la SLA?
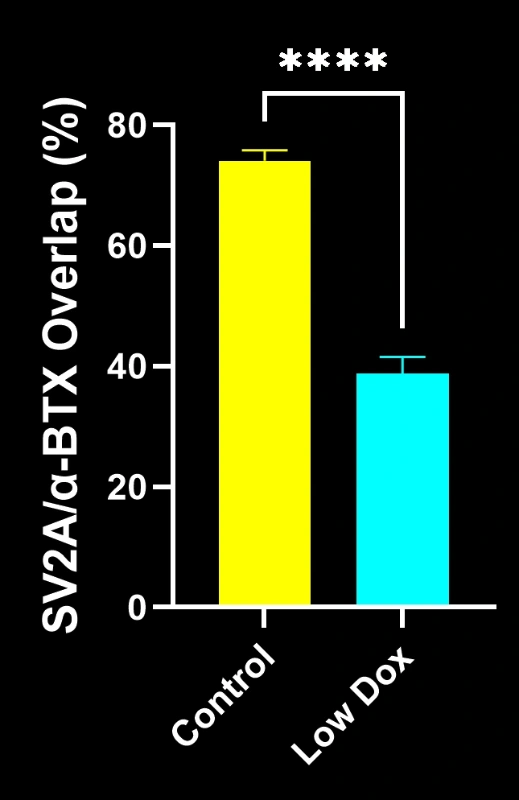
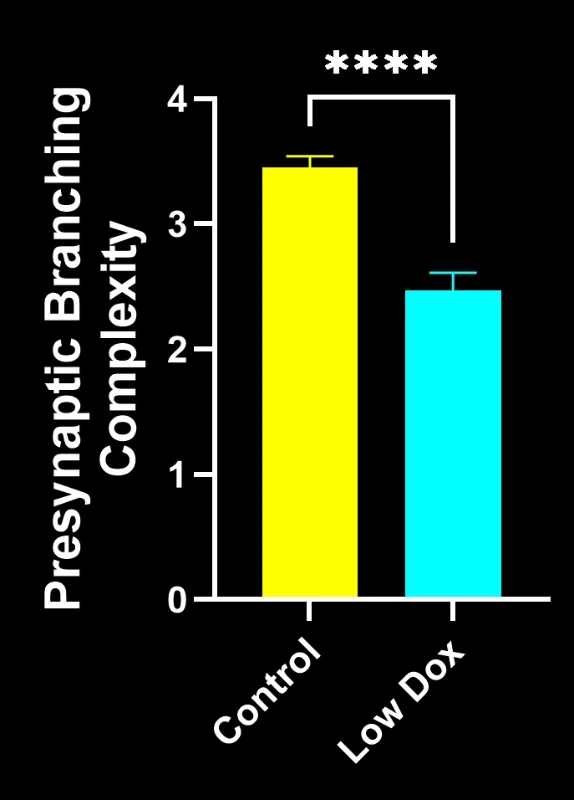
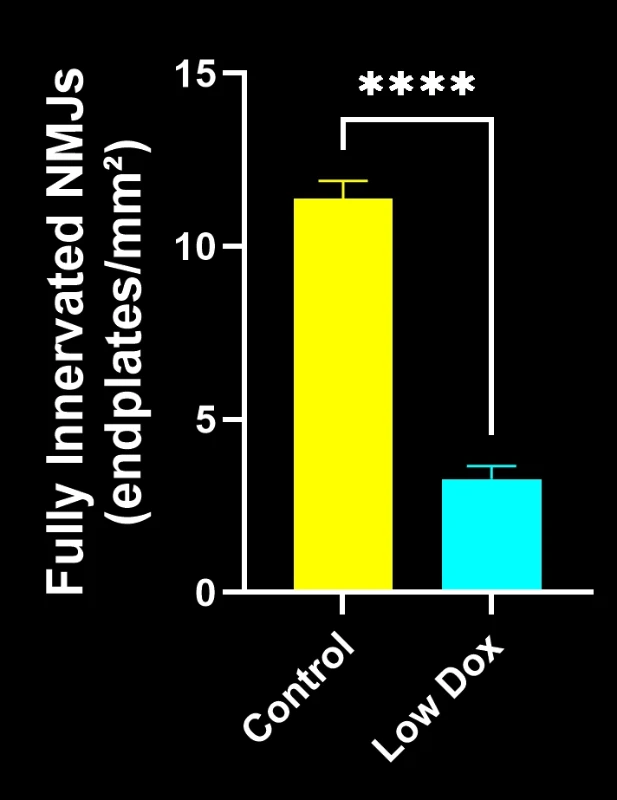
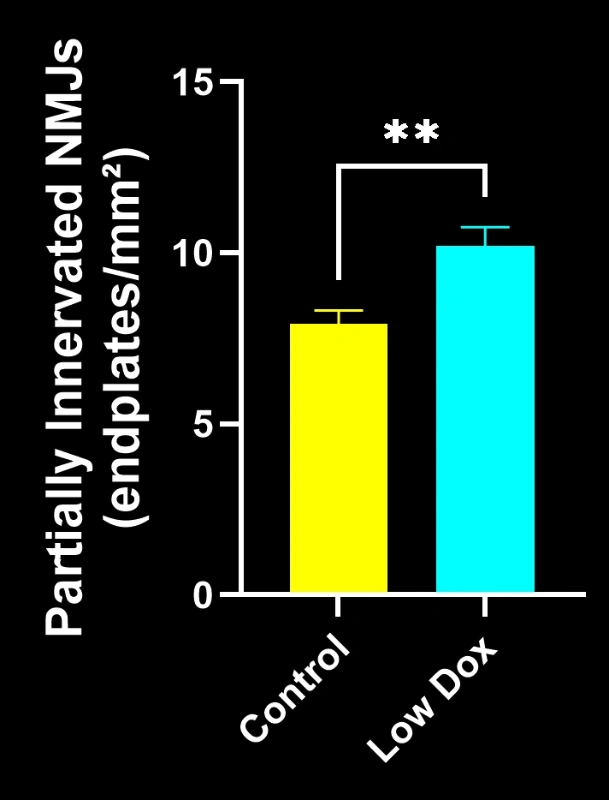
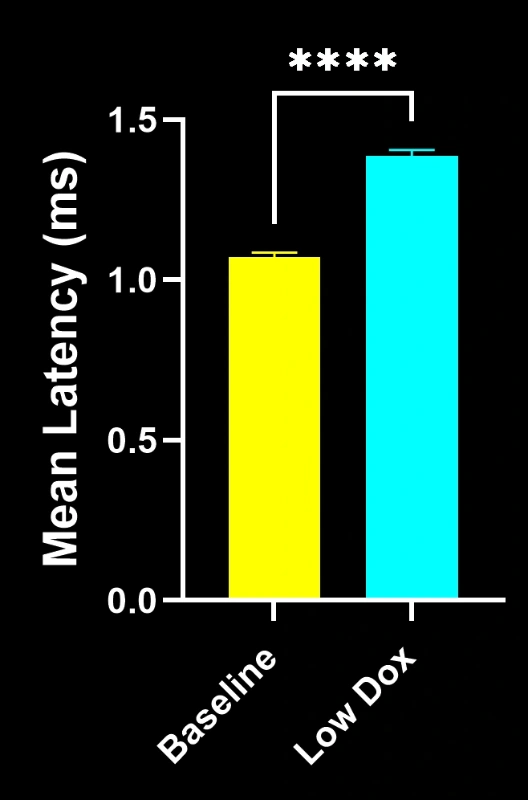
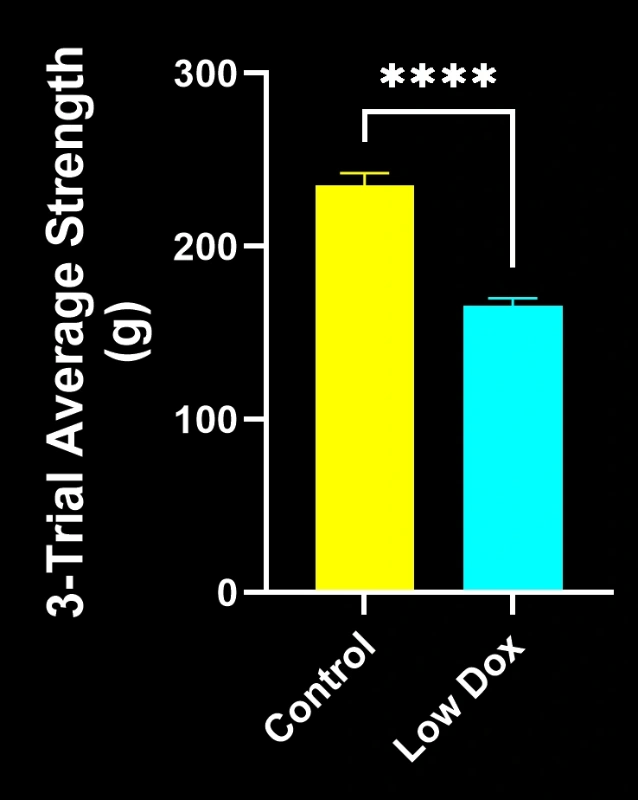
Les chercheurs scientifiques de Biospective ont mené une évaluation rigoureuse de l'intégrité et de la dénervation des jonctions neuromusculaires chez des souris transgéniques TDP-43. Cette étude a comparé des souris témoins tTA à des souris rNLS8 « Low Dox » huit semaines après l'induction du modèle.
Notre étude a démontré :
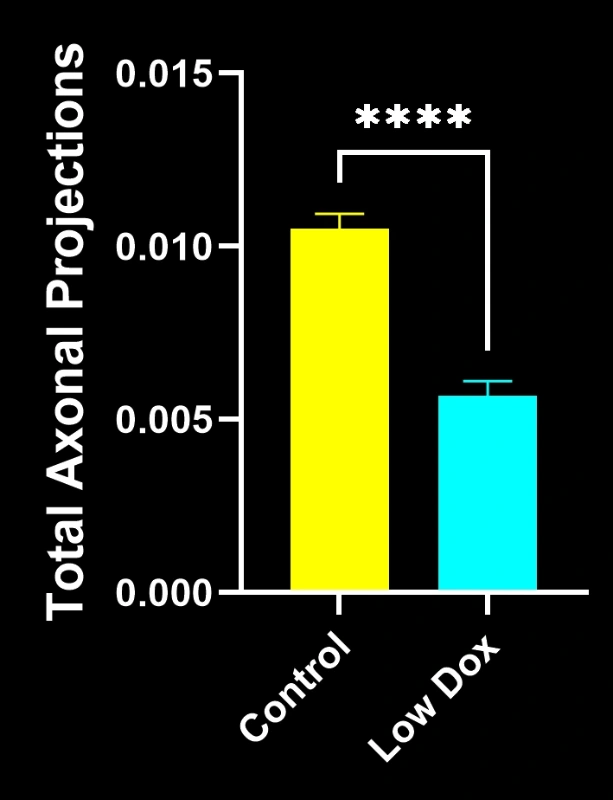
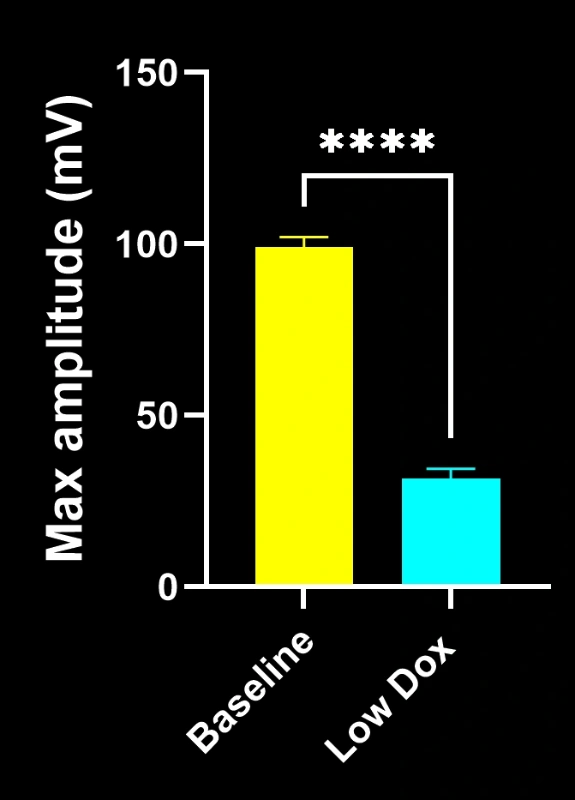
- Une réduction significative de la colocalisation SV2A/α-bungarotoxine, indiquant une dénervation de la jonction neuromusculaire
- Une diminution des projections axonales totales
- Une architecture présynaptique simplifiée, reflétant une pathologie synaptique de type SLA
Ces résultats mettent en évidence le dysfonctionnement synaptique progressif au niveau de la jonction neuromusculaire et soutiennent l'utilisation de ce modèle murin pour l'évaluation préclinique d'interventions thérapeutiques visant à préserver la jonction neuromusculaire dans la SLA.
Dans l'« Image interactive » ci-dessous, vous trouverez les résultats de notre analyse NMJ, y compris des coupes tissulaires à immunofluorescence multiplexe haute résolution de muscles provenant du modèle murin « Low Dox » TDP-43ΔNLS (rNLS8) de Biospective et de souris témoins.
Vous pouvez faire un panoramique sur l'image à l'aide du bouton gauche de la souris. Vous pouvez zoomer et dézoomer à l'aide de la souris/du pavé tactile (haut/bas) ou des boutons + et - dans le coin supérieur gauche. Vous pouvez activer/désactiver, modifier la couleur et ajuster les paramètres d'image pour les canaux dans le panneau de configuration dans le coin supérieur droit.
Nous vous recommandons d'utiliser le mode plein écran pour une expérience interactive optimale.
Image interactive présentant les résultats de l'analyse NMJ, avec des coupes musculaires à immunofluorescence multiplexe haute résolution provenant du modèle murin « Low Dox » TDP-43ΔNLS (rNLS8) de Biospective, ainsi que des tissus témoins.
Cliquez pour copier le lien
Comment l'automatisation améliore-t-elle les résultats?
Nous utilisons la marquage et l'analyse automatisées des jonctions neuromusculaires à l'aide de plateformes avancées d'imagerie et de quantification à haut débit. Cette approche garantit une évaluation précise et reproductible de la structure et de l'intégrité des jonctions neuromusculaires sur plusieurs échantillons et dans différentes conditions expérimentales.
Comparaison entre la marquage et l'analyse manuelles et automatisées de la jonction neuromusculaire
|
Caractéristique |
Manuelle |
Automatique |
|
Cohérence de la marquage |
Incubation variable des anticorps et distribution inégale des réactifs |
Contrôle précis du temps, de la température et de l'application des réactifs |
|
Rendement et efficacité |
Analyse de lames chronophage et en nombre limité |
Marquage, imagerie et traitement des données à haut débit |
|
Reproductibilité |
Variabilité dépendante de l'opérateur dans la marquage et l'analyse |
Protocoles standardisés et quantification NMJ basée sur des algorithmes |
|
Exactitude des données et |
Évaluation subjective de la NMJ ; précision quantitative limitée |
Segmentation, localisation et analyse morphologique automatisées |
|
Profilage morphologique |
Mesure manuelle de la taille, de la forme et de la complexité de la NMJ |
Extraction automatisée des mesures de la surface, du périmètre, de la ramification et de la complexité de la jonction neuromusculaire |
|
Cartographie spatiale |
Limitée aux régions d'intérêt (ROI) sélectionnées |
Cartographie complète de la distribution des jonctions neuromusculaires et de la couverture synaptique |
Ce tableau compare la marquage et l'analyse manuelles et automatisées des jonctions neuromusculaires (NMJ) selon des critères clés, notamment la cohérence de la marquage, le débit et l'efficacité, la reproductibilité, la précision des données et la profondeur de l'analyse, le profil morphologique et la cartographie spatiale.
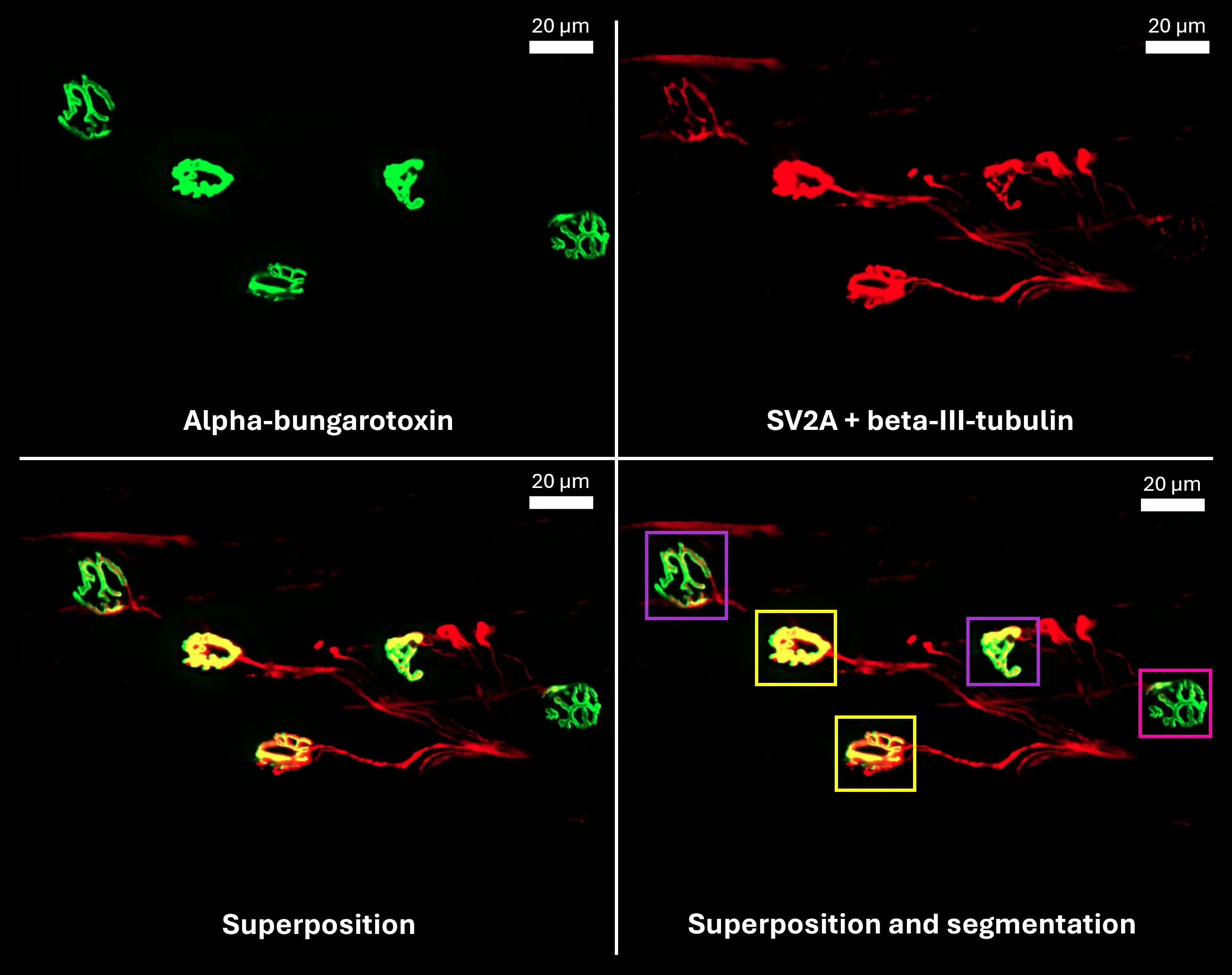
Exemples d'images de jonctions neuromusculaires provenant de muscles de souris ayant subi une marquage et une analyse d'image automatisées à l'aide des procédés développés par Biospective.
Pour discuter de vos besoins en matière d'études ou demander un devis pour des services de marquage et de quantification de la jonction neuromusculaire (JNM),
Contenu connexe
Informations actualisées sur les services de marquage et d'analyse NMJ.
Morphologie de la jonction neuromusculaire (JNM) dans les modèles de SLA
Aperçu de la jonction neuromusculaire (JNM), de son rôle dans la sclérose latérale amyotrophique (SLA) et des outils et méthodes utilisés pour étudier les changements morphologiques dans les JNM.
Modèles de souris SLA pour le développement de médicaments
Un guide pour l'utilisation la plus efficace possible des modèles animaux de recherche sur la sclérose latérale amyotrophique (SLA) pour les essais précliniques de produits thérapeutiques.
Modèles de souris SLA et neurones moteurs spinaux
Aperçu de l'implication des motoneurones spinaux dans la progression de la maladie dans les modèles murins de sclérose latérale amyotrophique (SLA).
Souris TDP-43 ΔNLS (rNLS8) pour le développement de médicaments contre la SLA
Cette ressource fournit des informations sur l'utilisation du modèle de souris transgénique TDP-43 ΔNLS (deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) de la SLA pour des études thérapeutiques précliniques.