ALS小鼠模型能否重现人类疾病中的脊髓运动神经元病变?
ALS有效动物模型的一个基本特征是,它能够再现人类疾病的多方面特征,这些特征可以很容易地测量(参见ALS药物研发小鼠模型)。运动神经元丢失以及轴突、树突和突触变性是ALS的特征(Salzinger,2024)。运动神经元变性导致骨骼肌无力、萎缩,最终死亡,通常是由于呼吸衰竭(Hardiman,2011)。家族性ALS约占病例总数的10%,最常见的突变发生在C9ORF72 、SOD1 、FUS和TARDBP基因中(Hardiman,2017)。虽然TARDBP基因中的突变非常罕见(<1%),但TARDBP基因编码的蛋白质(TDP-43)在约97%的ALS病例中形成细胞质聚集(Shatunov,2021)。因此,基于这些基因和其他基因,已经开发出ALS的基因工程动物模型。
hTDP-43ΔNLS (rNLS8)转基因小鼠模型(Walker,2015)是ALS小鼠模型的一个典型例子,它再现了人类疾病的神经运动特征(参见TDP-43ΔNLS (rNLS8)小鼠用于ALS药物开发)。这些小鼠体内的人类TDP-43表达过高,核定位信号(NLS)存在缺陷,导致定位错误(核TDP-43表达水平降低)和细胞质聚集的形成。对于脊髓运动神经元,该小鼠模型已被证明可表现出快速疲劳(FF)运动神经元的丧失,而慢速运动神经元相对不受影响,此外,该模型还表现出神经肌肉接头(NMJ)神经支配和再支配的迹象,这与人类ALS的症状一致(Spiller,2016 ;Hur,2022)。
有哪些生命期内的测量方法可用于评估脊髓运动神经元的参与度?
在临床前疗效研究中,评估疾病进展对脊髓运动神经元的影响具有显著优势。目前有多种方法可用,包括直接观察脊髓和相关定量成像指标,以及目标肌肉神经支配缺失导致的下游测量。
体内脊髓成像
非侵入性成像,例如体内磁共振成像(MRI),可以进行定量测量,反映脊髓运动神经元的状态。Grolez等人(Grolez,2018)发现,SOD186R转基因小鼠的颈椎脊髓厚度逐渐减少。Marcuzzo等人(Marcuzzo,2017)通过G93A-SOD1小鼠的纵向体内扩散张量成像(DTI)发现了脊髓白质和灰质随时间的变化。Figini等人(Figini,2016)优化了DTI参数,以便可靠地检测G93A-SOD1小鼠和野生型小鼠脊髓之间的差异。Gatto及其同事(Gatto,2018)对YFP、G93A‐SOD1小鼠进行了体内DTI,发现出生后第80天(P80)小鼠的各向异性(FA)、轴向扩散率(AD)和径向扩散率(RD)发生了显著变化。G93A‐SOD1小鼠与对照组小鼠之间的这些体内成像差异与轴突荧光强度和细胞膜标记的变化有关。Underwood等人(Underwood,2011)发现,扩散张量成像(DTI)可以检测脊髓轴突的体内损伤,与野生型同窝仔鼠相比,G93A-SOD1小鼠腰椎脊髓腹侧白质束的FA值降低,这种效应随着疾病进展而变得更加明显,并与疾病严重程度相关。FA值降低仅限于运动神经元产生的白质束,而感觉白质纤维则得以保留。此外,轴向和径向扩散率的重大变化与电子显微镜(EM)测量的轴突变性有关。
肌肉萎缩的非侵入性成像
脊髓本身的扩散特性评估在小鼠模型中可能具有挑战性,作为替代方案,通过非侵入性成像测量轴突变性/脊髓运动神经元丢失引起的神经支配丧失导致的肌肉萎缩难度较小,且具有临床可转化性。从临床角度来看,Wilcox等人(Wilcox,2021)的研究表明,容积核磁共振成像具有可重复性、时间响应性和与肌肉功能临床评估的相关性,并认为容积核磁共振成像可以作为肌肉神经再生的潜在结果指标。Jenkins及其同事(Jenkins,2013; Jenkins,2018)使用核磁共振成像测量ALS患者的肌肉体积变化和其他成像参数(例如T2信号)。在一项初步研究中,该小组发现ALS患者的特定肌肉体积逐渐减少,临床症状也不断恶化(Jenkins,2013)。Klickovic等人(Klickovic,2024)报告说,在个人最长观察期内,优势手、头颈肌肉以及下肢横截面积(CSA)的体积明显下降。
在动物模型中,使用核磁共振成像(MRI)和计算机断层扫描(CT)等方法对肌肉萎缩进行纵向、活体测量是可行的。Marcuzzo及其同事(Marcuzzo,2011)对G93A-SOD1小鼠进行了纵向定量MRI分析,并证明从8周龄开始后肢肌肉体积明显减少。Pasetto等人 (Pasetto,2018)和van der Heyden等人(van der Heyden,2020)报告了用微CT测量小鼠后肢下部的可行性,以此作为MRI的替代方法。
我们Biospective团队一直在利用临床前微CT成像技术评估TDP-43型ALS模型的肌肉萎缩情况。我们能够以较短的采集时间获得TDP-43 ΔNLS (rNLS)小鼠后肢的高分辨率图像。下图显示了我们的“低剂量阿霉素”小鼠模型在疾病诱导后10周肌肉体积相对于基线的变化百分比。
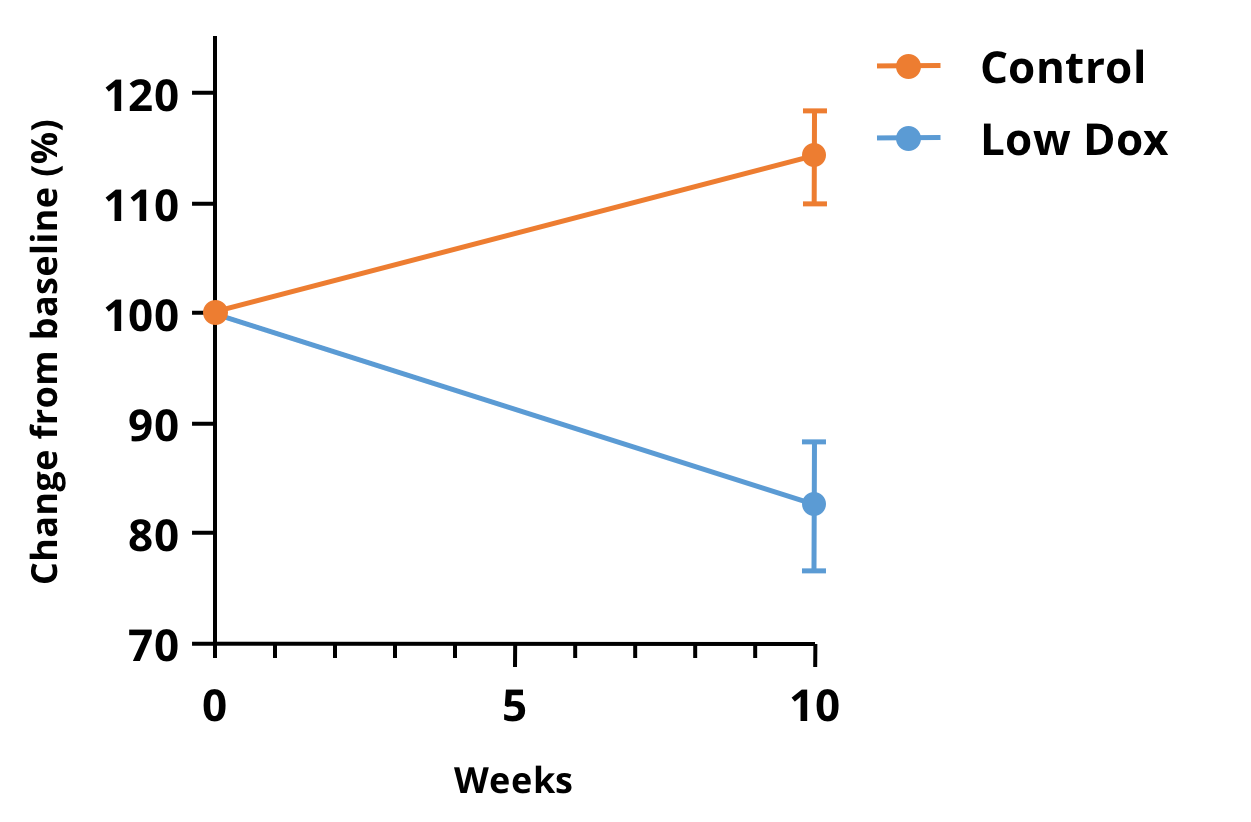
“低剂量多柔比星”hTDP-43ΔNLS小鼠模型中,微CT成像所得的下肢后部肌肉体积变化百分比。在10周内,对照组(tTA)和低剂量Dox小鼠之间存在显著差异(p<0.0001),这使得该测量方法成为该模型治疗功效研究的极具吸引力的实时读数。
神经肌肉电生理学
电生理学(例如肌电图[EMG])是ALS患者诊断和监测疾病的标准测试。该技术也可用于ALS动物模型,以评估神经肌肉功能状态。
Spiller等人(Spiller,2016)测量了非转基因(nTg)和rNLS8小鼠在腓肠肌中诱发复合肌肉动作电位(CMAP)的振幅,这些小鼠已经停止高剂量强力霉素饮食(以允许转基因表达)数周。该小组发现,随着hTDP-43ΔNLS表达的增加,CMAP测量值显著下降。
我们Biospective小组使用rNLS8模型的“低剂量强力霉素”版本进行了类似的研究。与“停用强力霉素”模型中的观察结果一致,我们发现“低剂量强力霉素”模型中的CMAP振幅有非常显著的下降。该测试可在多个时间点进行,非常适合评估实验性治疗药物在此模型中的效果。此外,CMAP评估是对基于微CT成像的肌肉萎缩度量的补充,可提供神经肌肉结构和功能变化的全面信息,从而了解疾病进展和通过治疗干预进行潜在疾病修正的情况。
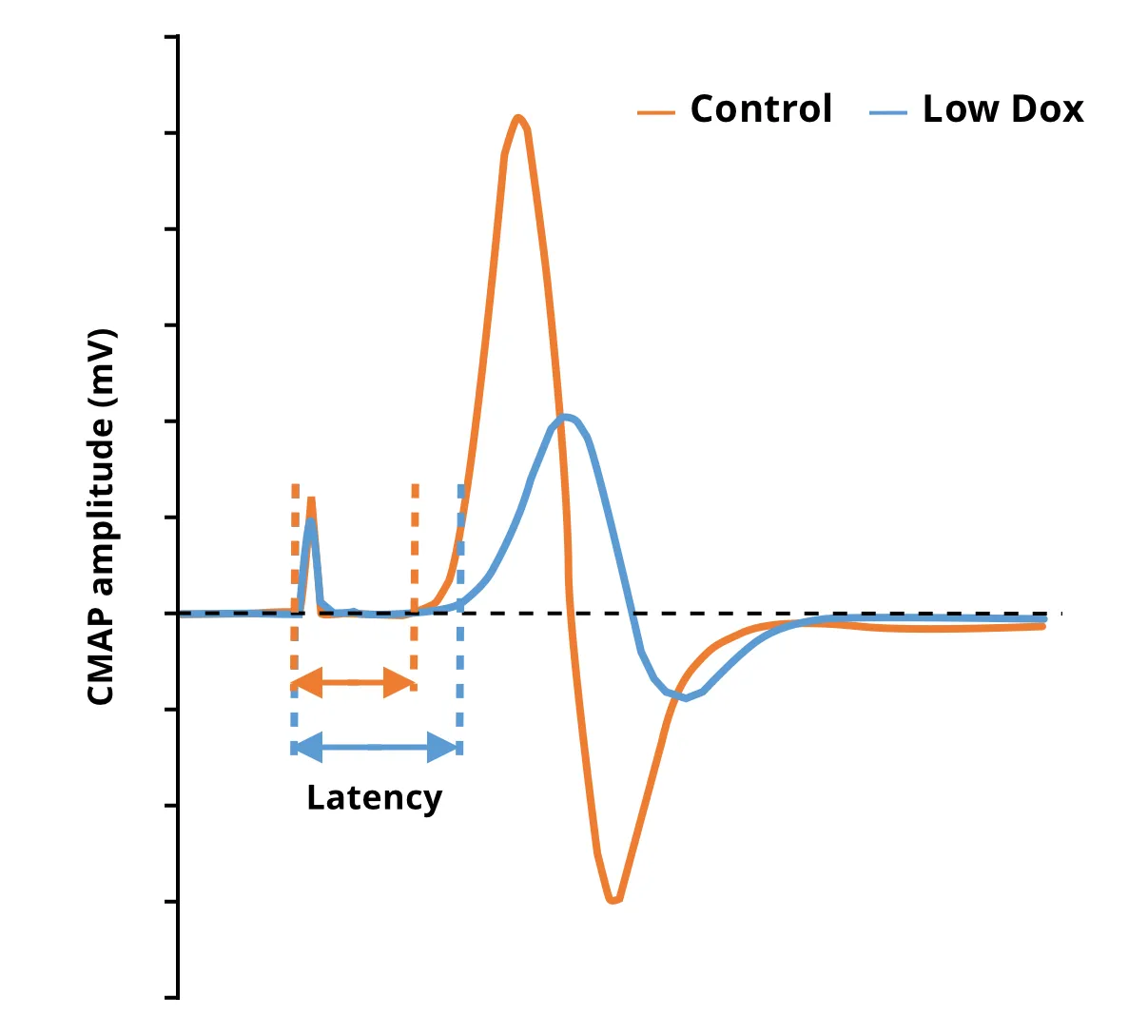
与对照组小鼠相比,低剂量多巴胺受体激动剂hTDP-43ΔNLS小鼠的CMAP振幅降低,延迟增加。
CMAP还被用于评估ALS突变SOD1小鼠和大鼠模型的运动系统功能。例如,在SOD1G93A小鼠中,CMAP会随着时间的推移而下降(Mancuso,2011 ;Mancuso,2014)。McCampbell等人(McCampbell,2018)的研究表明,在5周龄时用反义寡核苷酸(ASO)治疗的SOD1G93A小鼠在接下来的12周内保持了CMAP,而对照小鼠的CMAP在同一时期内减少了超过一半。
如何通过组织切片评估ALS模型中脊髓运动神经元的受累情况?
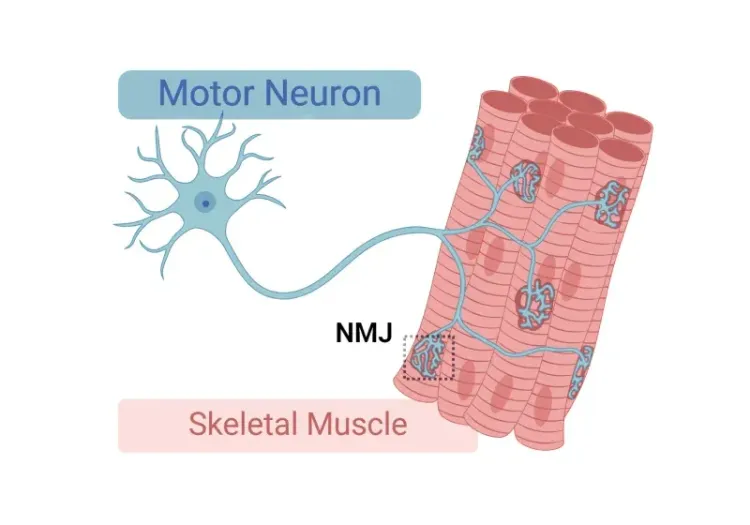
脊髓运动神经元(细胞体和突起)的直接可视化、表征和定量分析可通过免疫组织化学(IHC)和免疫荧光(IF)方法在死后组织切片上进行。多重免疫荧光(mIF)特别有用,因为可以在同一组织切片上评估多个标记物,并评估特定标记物的共定位。在组织切片上成像脊髓运动神经元的一种策略是通过注射逆行示踪剂来追踪神经元,逆行示踪剂可以是荧光分子(如霍乱毒素亚基B、Alexa Fluor™ 594 Conjugate;CTB-594)或表达报告基因(如GFP、mCherry)的载体(如AAV9)。另一种方法是免疫染色脊髓运动神经元表达的抗原。常见的目标包括胆碱乙酰转移酶(ChAT)、囊泡乙酰胆碱转运蛋白(VAChT)、基质金属蛋白酶-9(MMP-9)和3型小导钙激活钾通道(SK3)。
一系列定量测量可以从数字化组织切片得出。细胞体和轴突的数量和大小可以通过ChAT或VAChT染色组织测量,而末端可以通过VAChT或其他标记物(如SV2)的染色进行量化。MMP-9和SK3可以分别用于评估快和慢运动神经元。形态测量,如体表面积和各种树突特性(如总树突长度、平均树突长度、最大树突伸展度和树突复杂度)(Fogarty,2020),也可以通过先进的图像处理方法从染色组织切片图像中获得。
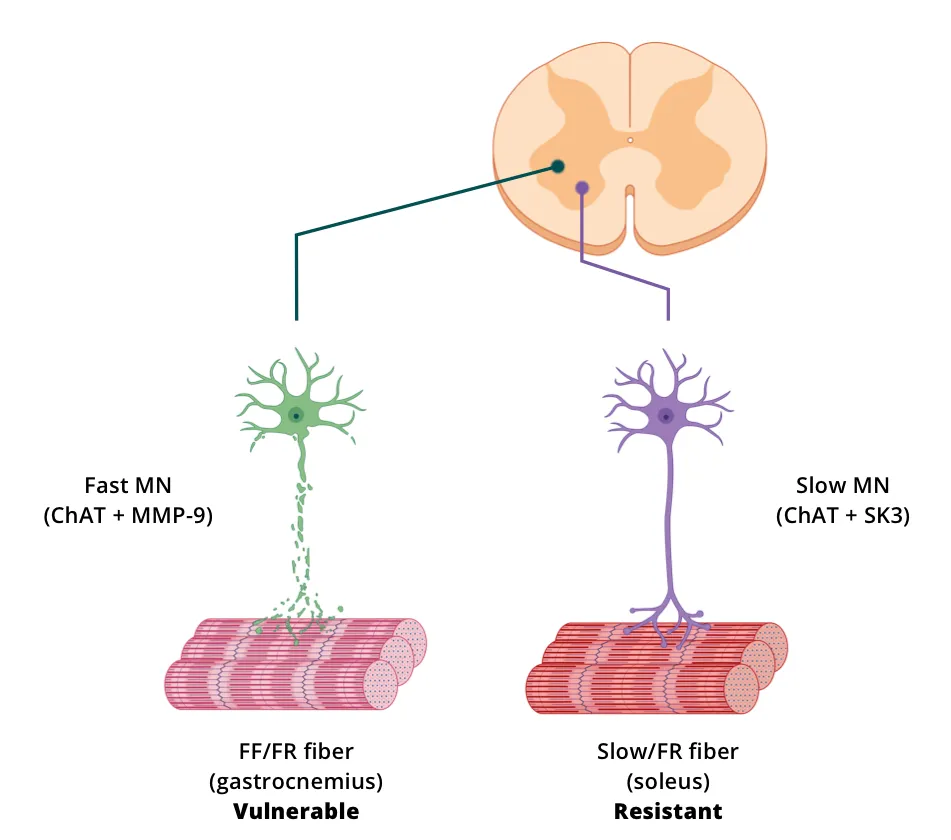
动物模型脊髓运动神经元标记策略图解(图片根据《Hur,2022》改编,已获得知识共享署名许可)。
Spiller等人(Spiller,2016)通过hTDP-43ΔNLS小鼠脊髓中的VAChT IF测量了运动神经元的数量和体细胞大小,并通过VAChT和MMP-9共定位测量了快速运动神经元的数量。该小组报告称,在rNLS8小鼠的脊髓内,“慢运动神经元”存活到末期,而“快速易疲劳运动神经元”则消失了。他们还发现,轴突萎缩首先发生在快肌纤维上,而慢肌纤维仍保持神经支配。在转基因抑制后,抗性运动神经元萌生侧枝,重新支配先前失去神经支配的神经肌肉接头(NMJ)。运动神经元的选择性脆弱性/抗性会导致不同肌肉群出现不同的萎缩或电生理学变化,具体取决于纤维类型的分布。例如,腓肠肌浅层主要由II型(快速收缩)纤维组成,而比目鱼肌主要由I型(慢速收缩)纤维组成(Rosser,1992)。
我们的团队非常乐意回答有关TDP-43 ΔNLS ALS小鼠模型的任何问题,或提供有关我们用于治疗功效研究的模型的具体信息。
了解更多关于我们的ALS车型的信息
相关内容
关于肌萎缩侧索硬化症的最新信息,以及ALS动物模型治疗剂评估的最佳实践。
自噬与神经退行性疾病
细胞自噬在脑健康和神经退行性疾病中发挥作用的概述。
神经肌肉接头(NMJ)形态学与ALS模型
对神经肌肉接头(NMJ)及其在肌萎缩侧索硬化症(ALS)中作用的深入理解,以及用于研究NMJ形态学变化的工具和方法。
ALS小鼠模型用于药物研发
指导如何最有效地使用肌萎缩侧索硬化症(ALS)的实验动物模型(小鼠和大鼠模型)进行临床前治疗测试。
ALS、阿尔茨海默氏症和帕金森氏症中的微胶质形态
概述微胶质形态学分析及其在神经退行性疾病研究和药物研发中的应用。
TDP-43 ΔNLS (rNLS8) 小鼠用于ALS药物研发
该资源提供了有关使用ΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43 ALS转基因小鼠模型进行临床前治疗研究的信息。