Neurodégénérescence et neuroinflammation dans le modèle de souris AAV-Synucléine
Présentation des modèles
Chez Biospective, nous développons et utilisons des modèles murins rigoureusement caractérisés qui reflètent fidèlement les principales caractéristiques de la maladie de Parkinson chez l'homme, notamment l'agrégation de l'α-synucléine, la perte de neurones dopaminergiques, la neuroinflammation, les troubles moteurs et les troubles du sommeil. Ces modèles sont conçus pour soutenir les recherches sur les mécanismes de la maladie, la progression pathologique et les effets thérapeutiques à un stade précoce, avec une forte pertinence translationnelle.
Notre portefeuille de modèles animaux met l'accent sur la reproductibilité, des phénotypes bien définis et l'intégration de critères d'évaluation comportementaux, d'imagerie, biochimiques, moléculaires et histopathologiques afin de permettre une évaluation préclinique complète. Cette base scientifique permet aux chercheurs d'explorer les voies pathogènes, d'évaluer les interventions thérapeutiques candidates et de générer des données solides pour éclairer les efforts de développement de médicaments.
Modèles de fibrilles préformées d'α-synucléine (PFF)
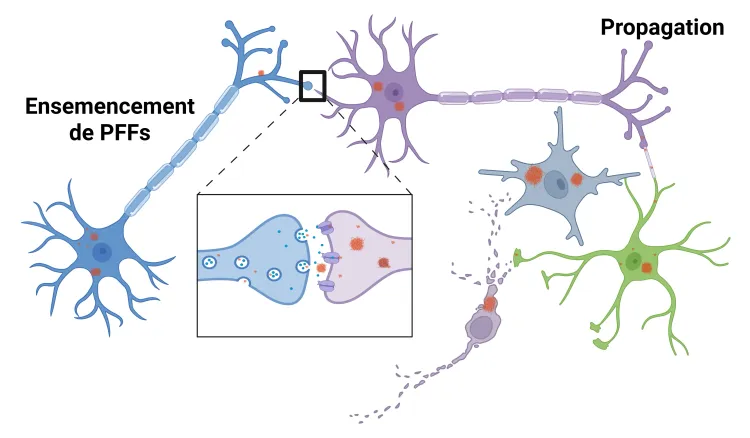
La propagation pathologique de l'alpha-synucléine mal repliée, caractéristique de la maladie de Parkinson chez l'homme, peut être modélisée dans le cerveau d'animaux par injection de fibrilles préformées d'alpha-synucléine (PFF). Ce « modèle de propagation et d'ensemencement des PFF » peut être induit chez des souris transgéniques surexprimant l'alpha-synucléine humaine ou chez des souris ou des rats de type sauvage.
Induction du modèle PFF de l'alpha-synucléine
- Injection de fibrilles préformées (PFF) d'alpha-synucléine recombinante
- Applicable à
- Souris transgéniques M83 surexprimant l'alpha-synucléine A53T
- Souris ou rats de type sauvage
Sites d'injection validés pour la PFF α-synucléine
- Noyau olfactif antérieur (AON)
- Faisceau médian du cerveau antérieur (MFB)
- Striatum +/- cortex cérébral sus-jacent
Caractéristiques de la maladie α-synucléine PFF modélisées
- Propagation de l'α-synucléine selon un schéma spatio-temporel bien défini
- Neuroinflammation
- Neurodégénérescence
- Troubles comportementaux mesurables
- Déficits moteurs
- Symptômes non moteurs (par exemple, troubles du sommeil)
Ces modèles PFF PD à alpha-synucléine sont hautement reproductibles pour tester des traitements modificateurs de la maladie.
Chez Biospective, nous avons plus de dix ans d'expérience dans la réalisation d'études précliniques sur des modèles PFF à alpha-synucléine de la maladie de Parkinson afin d'évaluer :
- La biodistribution
- L'engagement de la cible
- Le mécanisme d'actionL'efficacité thérapeutique
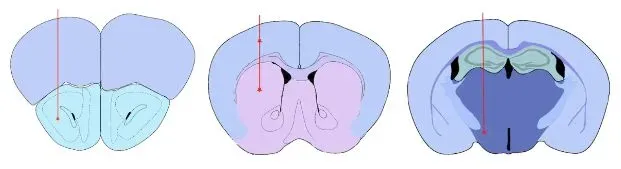
Our validated injection sites: Anterior Olfactory Nucelus (AON). Striatum +/- Overlying Cerebral Cortex, and Medial Forebrain Bundle (MFB).
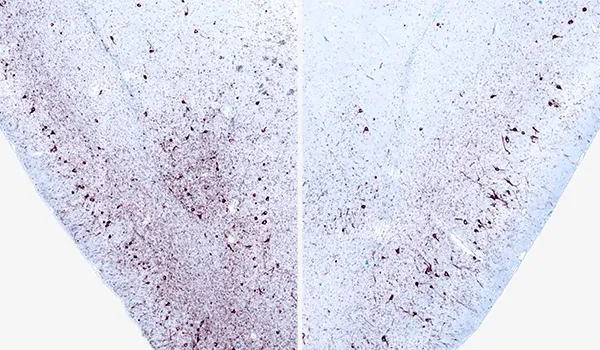
Phosphorylated α-synuclein (pSyn129) IHC of ipsilateral (left) and contralateral (right) piriform cortex 12 weeks after unilateral α-synuclein PFF injection into the AON of an M83+/- mouse.
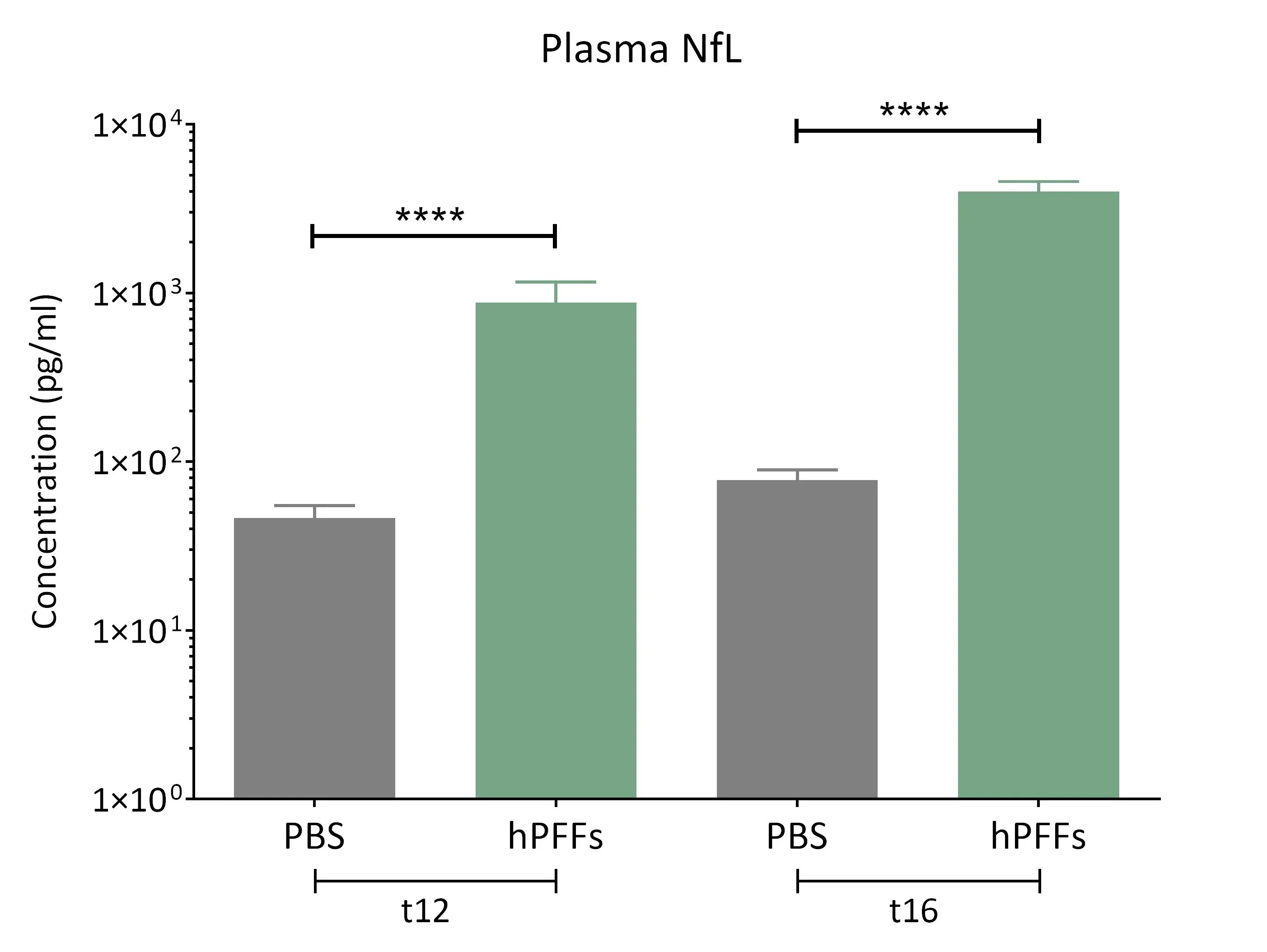
Highly elevated levels of neurofilament light (NF-L) are observed in the plasma from the α-synuclein fibril seeding mice.
Modèle de souris AAV A53T Alpha-Synucléine
La pathologie de l'α-synucléine dans le cerveau adulte des rongeurs peut être générée par injection de vecteurs de virus adéno-associés (AAV). Dans ce modèle murin de la maladie de Parkinson, des souris de type sauvage (C57BL/6) ou des modèles génétiquement modifiés subissent une injection stéréotaxique réalisée par des experts à l'aide de dispositifs stéréotaxiques numériques équipés de micro-injecteurs automatisés (pour une grande précision) de vecteurs AAV surexprimant l'alpha-synucléine humaine mutante A53T à proximité de la substance noire compacte.
Induction du modèle AAV-A53T α-synucléine
- Injection stéréotaxique de vecteurs de virus adéno-associés (AAV) surexprimant la α-synucléine humaine mutante A53T
Sites d'injection validés pour l'AAV-A53T α-synucléine
- Substantia nigra pars compacta (SNc)
Modèle de la maladie liée à l'α-synucléine AAV-A53T
- Perte de neurones dopaminergiques dans le SNc et dénervation du striatum ipsilatéral.
- Agrégats d'α-synucléine phosphorylée dans le SNc et le striatum.
- Neuroinflammation.
- Neurodégénérescence.
- Déficits moteurs unilatéraux mesurables à l'aide du
- Test de la rotarod.
- Test de suspension par la queue (TSST).
- Test du cylindre
- Test de préhension des membres postérieurs
Chez Biospective, nous pouvons également réaliser des examens d'imagerie non invasifs (par exemple, volumétrie IRM, TEP au [18F]FDG, TEP au [18F]DOPA) sur ces modèles AAV-A53T α-synucléine afin de générer des biomarqueurs d'imagerie cliniquement translatables (par exemple, atrophie cérébrale régionale, hypométabolisme cérébral du glucose, perte des terminaisons dopaminergiques).
Le modèle de maladie de Parkinson AAV-A53T α-synucléine offre un système robuste et flexible qui convient parfaitement à l'étude des effets des agents thérapeutiques (par exemple, petites molécules, ASO, thérapies géniques, produits biologiques) sur les mécanismes pathogènes et les troubles fonctionnels associés à la maladie de Parkinson.
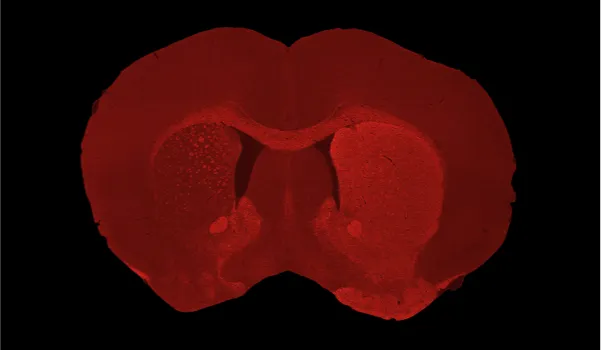
Severe dopaminergic neuron loss and dopaminergic denervation in the ipsilateral (left hemisphere) caudate-putamen following unilateral AAV-hA53Tα-Syn injection into the SNc of a C57BL/6 mouse.
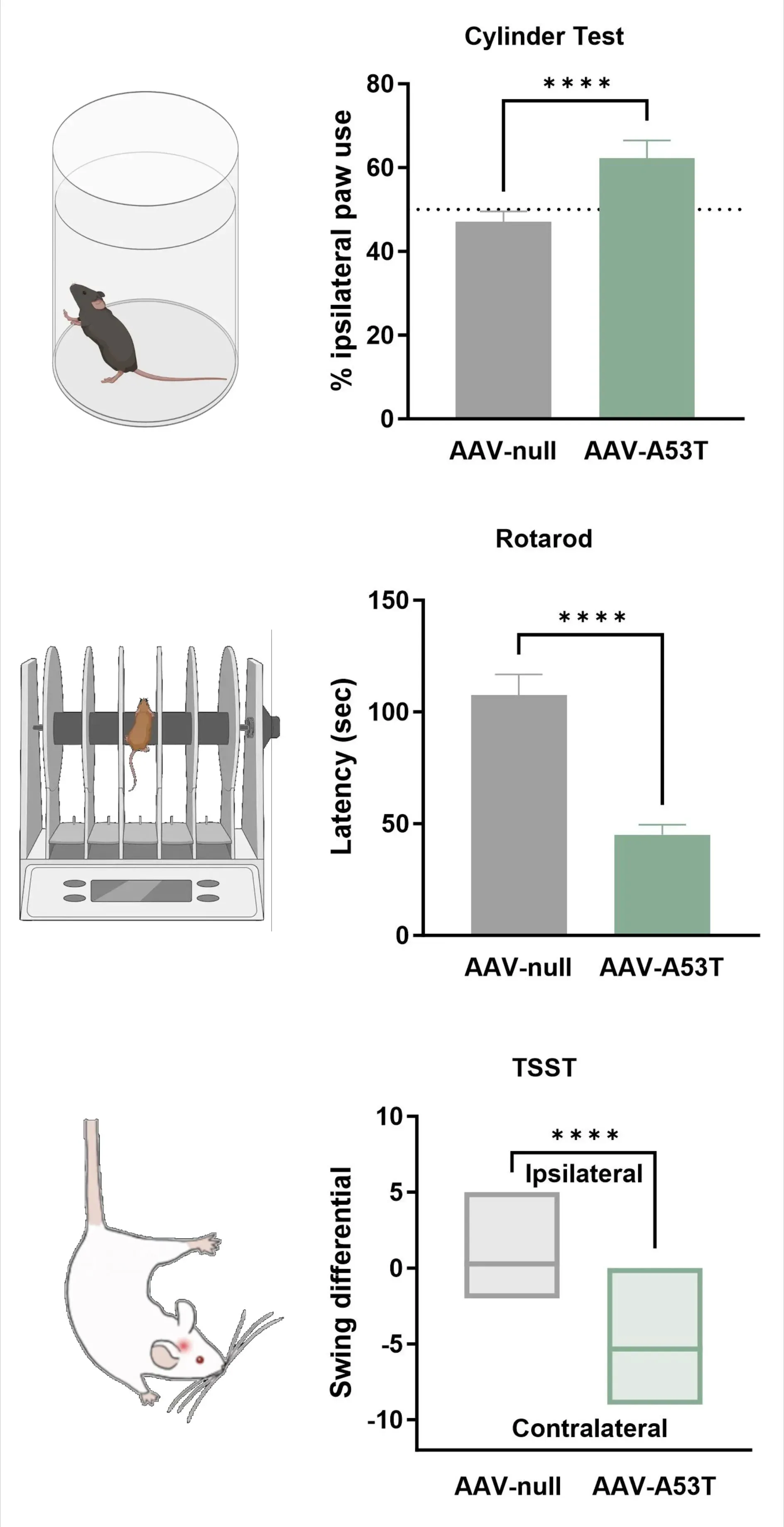
Loss of dopaminergic innervation corresponds with unilateral motor deficits, including increased ipsilateral paw use (Cylinder Test), reduced latency to fall (Rotarod), and increased contralateral swings (Tail Suspension Swing Test).
Quelles caractéristiques de nos modèles de la maladie de Parkinson sont transposables à la maladie humaine ?
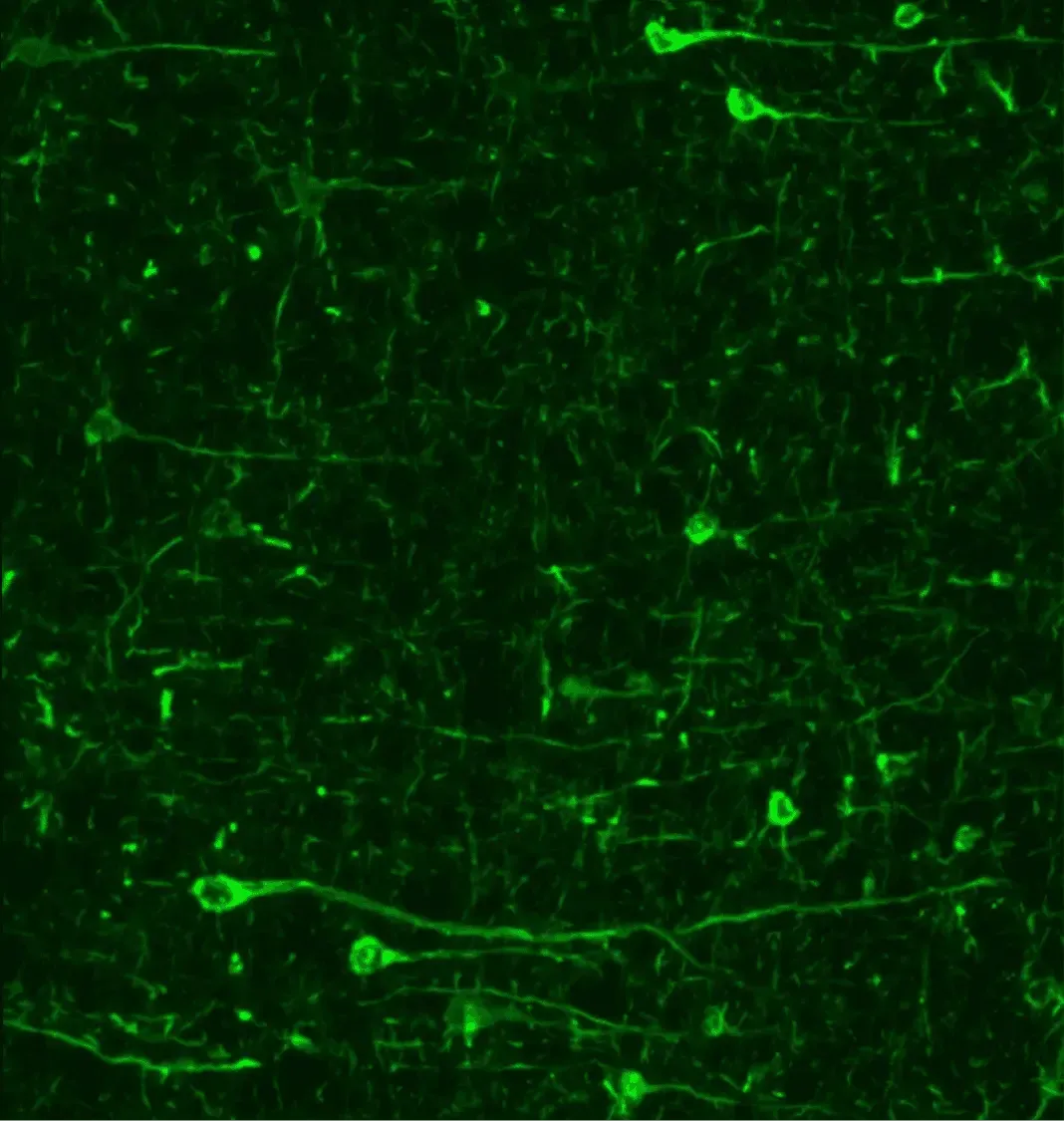
L'immunofluorescence de la synucléine phosphorylée (pSyn129) dans des modèles animaux de la maladie de Parkinson révèle une accumulation prononcée dans le soma et les processus neuronaux.
Agrégats d'alpha-synucléine
Les agrégats d'alpha-synucléine mal repliée constituent une caractéristique pathologique clé de la maladie de Parkinson chez l'être humain. Des corps de Lewy et des neurites de Lewy sont observés dans les neurones dopaminergiques de la substance noire compacte, ainsi que dans d'autres régions du cerveau. Cette pathologie liée à l'alpha-synucléine mal repliée suit une progression spatio-temporelle caractéristique (Braak, 2003).
Dans nos modèles animaux de la maladie de Parkinson induite par AAV et PFF, nous observons :
- Des niveaux élevés d'α-synucléine phosphorylée dans le soma et les processus neuronaux
- Une propagation et une dissémination robustes de la pathologie dans les modèles PFF
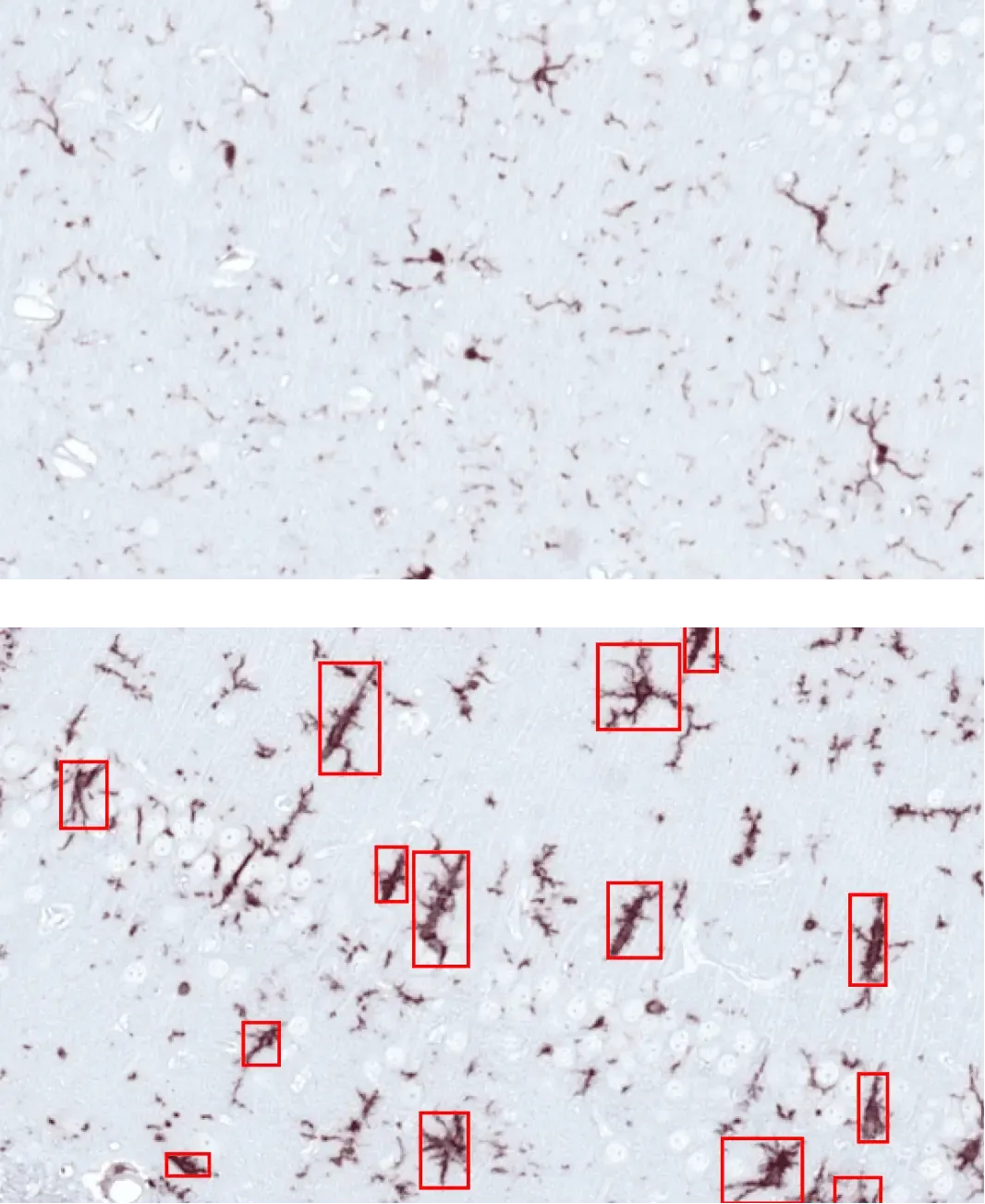
Microglies activées (encadrés rouges) dans l'hippocampe de souris ayant reçu une injection d'AON avec du PBS (en haut) ou des PFF d'α-synucléine (en bas).
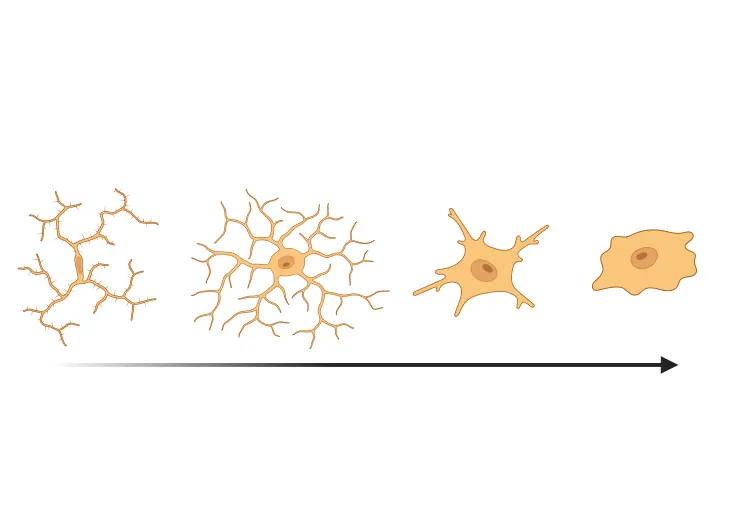
Microglies activées et astrocytes réactifs
La neuroinflammation est une caractéristique pathologique clé de la maladie de Parkinson, les microglies activées et les astrocytes réactifs jouant un rôle essentiel dans la pathogenèse (Kam, 2020; Chen, 2023).
Dans nos modèles murins de la maladie de Parkinson induits par AAV et PFF, nous observons :
- Des schémas spatio-temporels distincts de réponses neuroinflammatoires
- Une morphologie microgliale et astrocytaire altérée, détectée à l'aide d'algorithmes de vision par ordinateur,d'apprentissage automatique et d'apprentissage profond développés en interne
Consultez notre initiative sur la neuroinflammation : Microglia, astrocytes et maladies neurodégénératives
Consultez notre rubrique Innovation : Activation microgliale dans un modèle murin de la maladie de Parkinson à α-synucléine
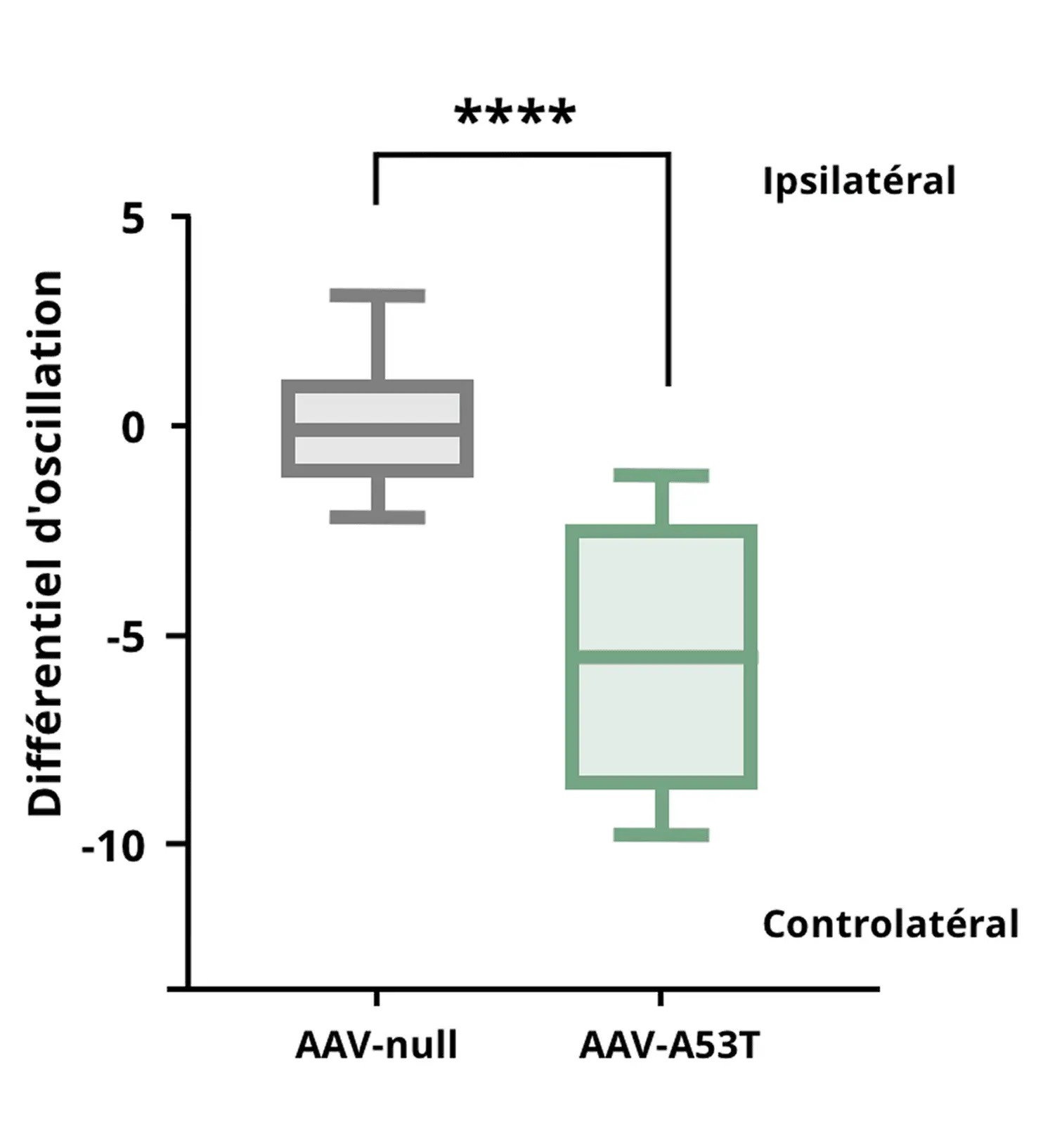
Test de suspension par la queue démontrant que les souris AAV-A53T α-syn présentent une augmentation des oscillations controlatérales due à un déficit dopaminergique unilatéral, par rapport aux souris témoins AAV-null.
**** p<0,0001.
Perte de neurones dopaminergiques et déficits moteurs
Les symptômes moteurs extrapyramidaux sont caractéristiques de la maladie de Parkinson. Ils sont principalement dus à la perte de neurones dopaminergiques dans la substance noire compacte (SNc) et à la dénervation striatale (par exemple, le noyau caudé et le putamen).
Dans nos modèles de la maladie de Parkinson, nous induisons la pathologie en ciblant la SNc avec :
- des AAV surexprimant l'α-synucléine, ou
- des fibrilles préformées d'α-synucléine (PFF)
Consultez notre ressource : Fibrilles préformées – Guide des modèles cellulaires et animaux
Ces interventions entraînent :
- Une neurodégénérescence des neurones dopaminergiques dans la SNc
- Une perte des terminaisons dopaminergiques dans le striatum
- Des troubles moteurs évalués par :
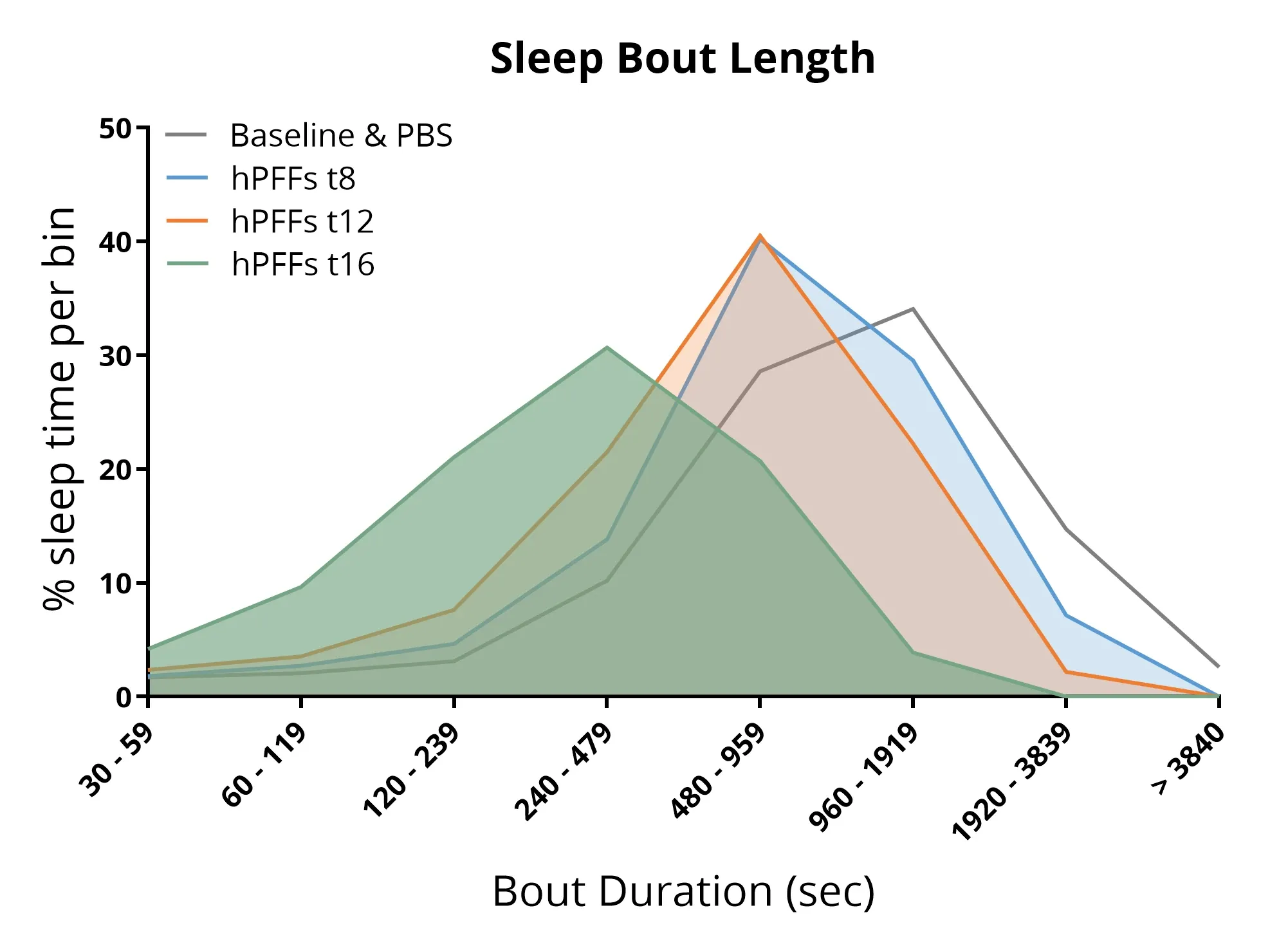
L'analyse du sommeil montre que les souris auxquelles on a injecté des PFF α-syn dans l'AON présentent une architecture du sommeil perturbée, notamment des phases de sommeil plus courtes et une durée totale de sommeil réduite.
Troubles du sommeil
Les troubles du sommeil comptent parmi les symptômes non moteurs les plus courants de la maladie de Parkinson, touchant jusqu'à environ 85 % des patients (Stefani, 2020; Asadpoordezaki, 2025).
À l'aide d'un système de surveillance non invasive du sommeil chez des souris atteintes de la maladie de Parkinson, nous avons démontré que :
- L'injection de PFF d'α-synucléine dans l'AON de souris transgéniques A53T entraîne :
- Une modification de l'architecture veille-sommeil
- Des changements dans le pourcentage total de sommeil
- Une perturbation de la durée des phases de sommeil
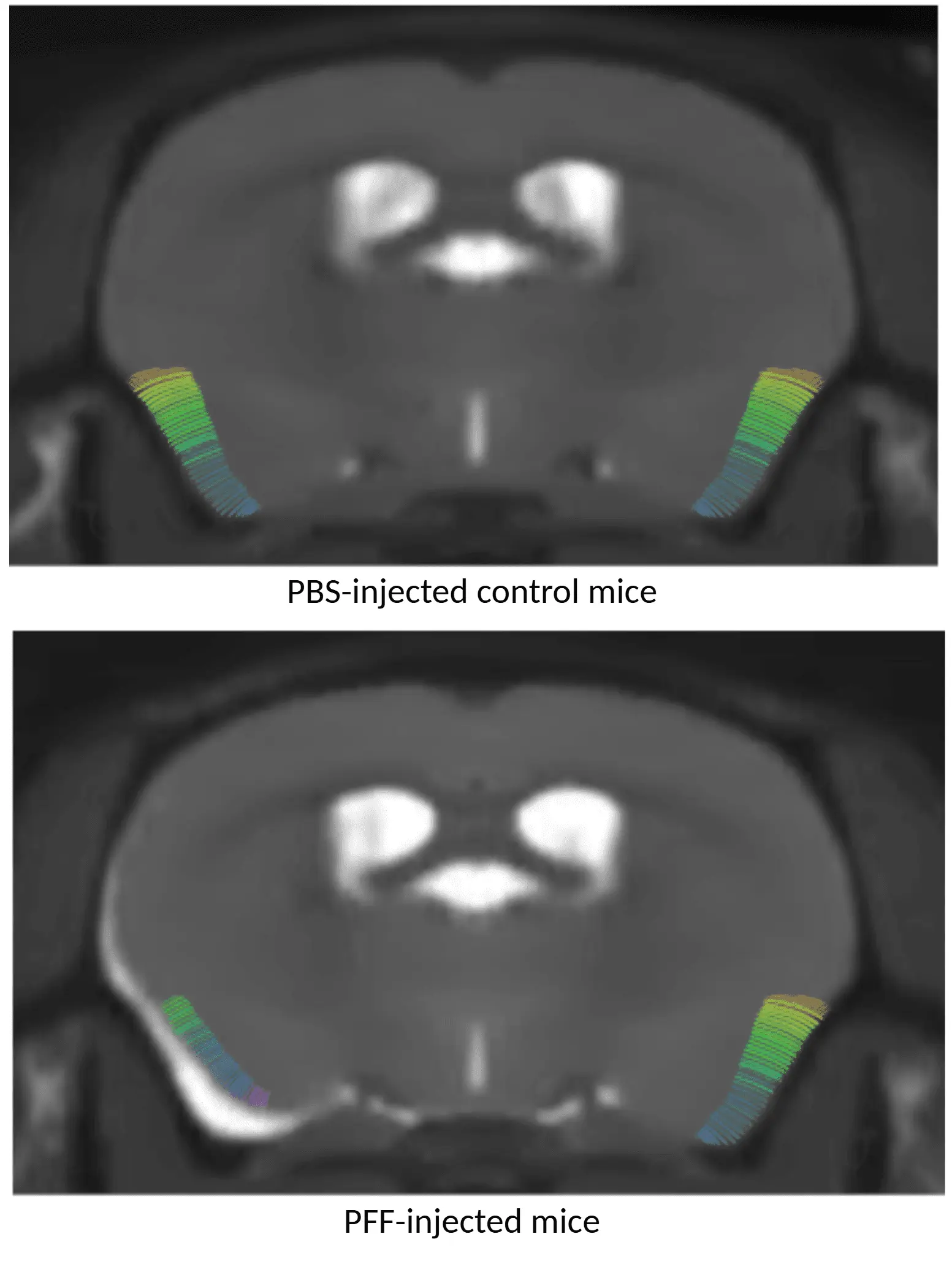
Cartes d'épaisseur corticale obtenues par IRM montrant des souris ayant reçu une injection de PBS (en haut) et des souris ayant reçu une injection d'AON α-syn PFF (en bas), les animaux traités au PFF présentant un amincissement cortical.
Atrophie cérébrale régionale
Les biomarqueurs d'imagerie cérébrale multimodale sont largement utilisés dans les essais cliniques sur la maladie de Parkinson. Les mesures dérivées de l'IRM des volumes neuroanatomiques régionaux et de l'épaisseur corticale sont des indicateurs sensibles de l'atrophie cérébrale dans la maladie de Parkinson (Tremblay, 2021; Abdelgawad, 2023).
À l'aide d'une IRM anatomique haute résolution du cerveau entier, associée à un traitement et une analyse d'images entièrement automatisés et avancés, nous avons démontré :
- Une atrophie cérébrale régionale reproductible chez nos souris atteintes de la maladie de Parkinson induite par AAV et PFF
Consultez notre innovation : Analyse de l'atrophie cérébrale dans des modèles murins de neurodégénérescence
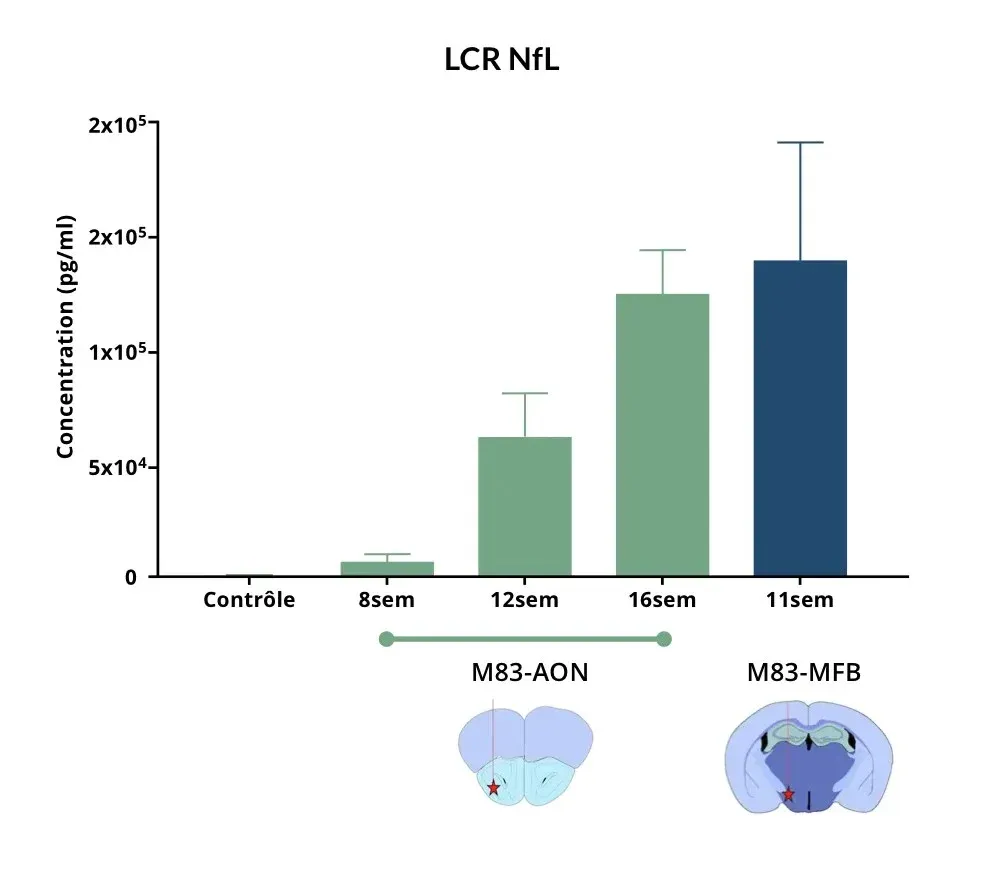
Les souris ayant reçu une injection de PFF α-Syn dans l'AON et le MFB présentent des taux élevés de NF-L dans le LCR par rapport aux souris témoins.
Taux élevé de neurofilament léger dans le LCR et le plasma
La chaîne légère du neurofilament (NF-L) est élevée dans le LCR et le plasma des patients atteints de la maladie de Parkinson et est couramment utilisée comme biomarqueur liquide dans les essais cliniques sur la maladie de Parkinson (Bäckström, 2020; Urso, 2023; Pedersen, 2024). Une augmentation des taux de NF-L a également été signalée dans plusieurs modèles précliniques de la maladie de Parkinson.
Dans nos modèles murins de la maladie de Parkinson, nous observons :
- Une augmentation significative des taux de NF-L dans le plasma et le LCR chez les souris transgéniques M83+/- après injection de PFF d'α-synucléine humaine dans :
- Le noyau olfactif antérieur (AON)
- Le faisceau médian du cerveau antérieur (MFB)
Veuillez consulter notre ressource : Chaîne légère du neurofilament dans les modèles de la maladie de Parkinson
Quels sont les profils pathologiques et phénotypiques des modèles murins PFF et AAV α-synucléine ?
Les tableaux ci-dessous résument la mesure dans laquelle chaque modèle reproduit les caractéristiques distinctives de la maladie de Parkinson chez l'homme, ce qui permet de comparer rapidement leur pertinence pour des questions de recherche spécifiques.
Pathologie
Ce tableau présente les principales caractéristiques pathologiques associées à la maladie de Parkinson, telles que l'agrégation de l'α-synucléine, la neuroinflammation et la perte de neurones dopaminergiques, et compare leur degré d'apparition dans les modèles murins induits par PFF et AAV.
| Caractéristique/Domaine | Modèles PFF | Modèles AAV |
|
✔️ |
✔️ | |
|
✔️ |
✔️ | |
|
✔️ |
✔️ |
des caractéristiques fonctionnellesCe tableau compare les troubles comportementaux et physiologiques liés à la pathologie de la maladie de Parkinson, notamment les déficits moteurs et les troubles du sommeil, en soulignant les différences entre les modèles murins.
|
Caractéristique/Domaine |
Modèles PFF |
Modèles AAV |
|
✔️ |
✔️ | |
|
✔️ |
N/A |
Biomarqueurs
Ce tableau résume les biomarqueurs non invasifs basés sur l'imagerie et les fluides pertinents pour la progression de la maladie. Ces biomarqueurs fournissent des critères d'évaluation quantitatifs pour évaluer la neurodégénérescence et les effets thérapeutiques dans les modèles animaux induits par PFF et AAV.
|
Caractéristique/Domaine |
Modèles PFF |
Modèles AAV |
|
✔️ |
✔️ | |
|
✔️ |
✔️ |
Résumé: Les modèles PFF et AAV α-synucléine présentent tous deux une pathologie α-synucléine prononcée, le modèle PFF affichant des schémas spatio-temporels caractéristiques de propagation et d'ensemencement. Des réponses neuroinflammatoires sont observées dans les deux modèles, tandis que la perte de neurones dopaminergiques est généralement plus grave et régionalement sélective dans le modèle AAV. Des troubles moteurs apparaissent dans les deux modèles, mais ils surviennent plus tôt et sont plus importants dans le modèle AAV. Les phénotypes liés au sommeil n'ont pas encore été évalués dans le modèle AAV. L'atrophie cérébrale mesurée par IRM et l'élévation du NF-L constituent des biomarqueurs cliniques translationnels de la neurodégénérescence dans les deux modèles murins.
Quelles sont les caractéristiques des modèles murins de la maladie de Parkinson ?
L'« Image interactive » ci-dessous vous permet d'explorer notre caractérisation du modèle murin AAV-A53T-Synuclein, y compris les données in vivo et les images haute résolution de coupes tissulaires multiplexées par immunofluorescence.
Vous pouvez facilement naviguer dans l'« histoire en images » à l'aide du panneau de gauche.
Vous pouvez faire un panoramique sur les images microscopiques haute résolution à l'aide du bouton gauche de la souris. Vous pouvez zoomer et dézoomer à l'aide de la souris/du pavé tactile (haut/bas) ou des boutons + et - dans le coin supérieur gauche. Vous pouvez activer/désactiver, modifier la couleur et ajuster les paramètres d'image pour les canaux et les segmentations dans le panneau de configuration dans le coin supérieur droit.
Nous vous recommandons d'utiliser le mode plein écran pour une expérience interactive optimale.
Characterization of our AAV-A53T-Synuclein mouse model, including in vivo data and high-resolution images of entire Multiplex Immunofluorescence tissue sections.
Cliquez pour copier le lien
Modèles animaux de la maladie de Parkinson Résumé : Comparaison entre les modèles PFF et AAV α-synucléine
Ensemble, les modèles murins PFF et AAV α-synucléine constituent des plateformes complémentaires pour étudier les mécanismes de la maladie de Parkinson et évaluer les stratégies thérapeutiques. Tous deux reproduisent les principales caractéristiques pathologiques de la maladie, notamment une forte agrégation de l'α-synucléine et une neuroinflammation mesurable, tout en différant dans l'expression et la progression des phénotypes clés. Le modèle PFF offre un cadre solide pour étudier l'apparition et la propagation de la pathologie, tandis que le modèle AAV montre une perte plus prononcée et régionalement sélective des neurones dopaminergiques, ainsi que des troubles moteurs plus précoces et plus graves. Bien que les phénotypes liés au sommeil n'aient pas encore été évalués dans le contexte de l'AAV, les deux modèles soutiennent l'utilisation de l'atrophie cérébrale basée sur l'IRM et des niveaux de NF-L dans les biofluides comme biomarqueurs translationnels de la neurodégénérescence. Collectivement, ces modèles permettent une évaluation complète des voies pertinentes pour la maladie de Parkinson et des effets thérapeutiques à travers divers objectifs expérimentaux.
Veuillez découvrir notre caractérisation des modèles murins de la maladie de Parkinson, nos mesures validées et nos services de CRO en neurosciences précliniques.
Contenu connexe
Informations actualisées sur la maladie de Parkinson et les meilleures pratiques relatives à l'évaluation des agents thérapeutiques dans les modèles animaux de la maladie de Parkinson.
Fibrilles préformées - Guide des modèles cellulaires et animaux
Présentation des modèles cellulaires et animaux induits par des fibrilles préformées pour les essais précliniques de traitements modificateurs de la maladie dans plusieurs maladies neurodégénératives.
Microglie, astrocytes et α-synucléine dans la maladie de Parkinson
Comment l'α-synucléine influence les microglies et les astrocytes dans la maladie de Parkinson et d'autres synucléinopathies.
Modèles AAV d'α-synucléine pour le développement de médicaments contre la maladie de Parkinson
Vue d'ensemble des modèles de souris et de rats à α-synucléine induite par un vecteur du virus adéno-associé (AAV), à utiliser dans les études précliniques de thérapeutiques modificatrices de la maladie.
Le neurofilament à chaîne légère dans les modèles de la maladie de Parkinson
Comment les niveaux de neurofilament à chaîne légère (NfL ; NF-L) peuvent être utilisés comme biomarqueurs dans le sang et le LCR dans les modèles de souris et de rats atteints de la maladie de Parkinson.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Mitophagie et maladie de Parkinson
Une vue d'ensemble de la façon dont une mitophagie déficiente peut conduire à la neurodégénérescence dans la maladie de Parkinson.
Autophagie, maladie de Parkinson et neurones dopaminergiques
Une vue d'ensemble de la façon dont une autophagie déficiente peut conduire à des changements pathologiques et à la neurodégénérescence des neurones dopaminergiques dans la maladie de Parkinson.
Dysfonctionnement mitochondrial et maladie de Parkinson
Un aperçu de la façon dont le dysfonctionnement mitochondrial est associé à la neurodégénérescence dans la maladie de Parkinson.