Aperçu du modèle de la synucléine
L'alpha-synucléine (α-synucléine ; α-syn) est une protéine pathogène majeure que l'on trouve dans les corps de Lewy et les neurites de la substantia nigra pars compacta et d'autres régions du cerveau dans la maladie de Parkinson (MP). Pour ce modèle animal de la maladie de Parkinson, nous procédons à l'inoculation stéréotaxique de fibrilles préformées d'α-syn humaine recombinante dans le cerveau de souris transgéniques M83 [B6;C3-Tg( Prnp SNCA A53T )83Vle/J] qui surexpriment l'α-synucléine, ou nous injectons de l'α-syn recombinante murine dans le cerveau de souris non transgéniques de type sauvage (B6-C3H).
Nos sites d'injection validés sont les suivants Noyau olfactif antérieur (NIO), Striatum +/- cortex cérébral sus-jacent, et faisceau cérébral antérieur médian (MFB).
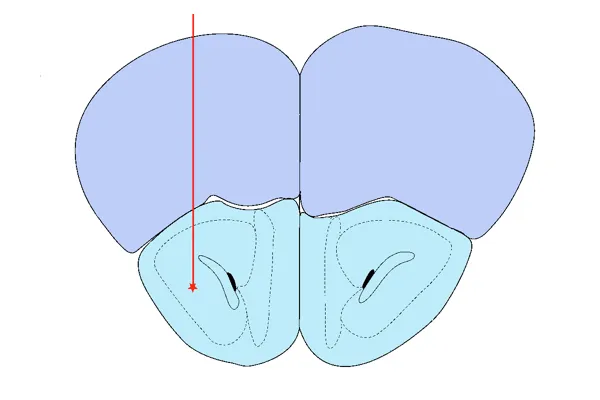
Injection d'AON
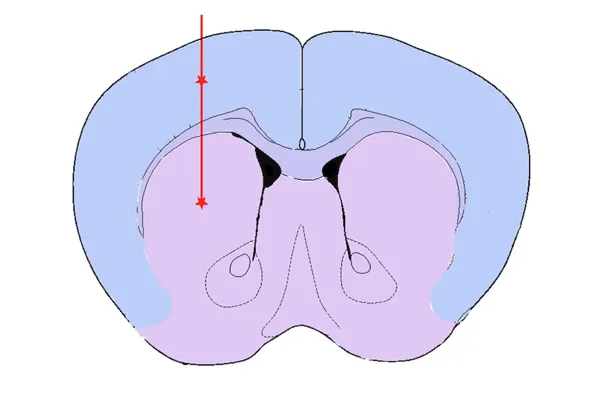
Injection dans le striatum et le cortex sus-jacent
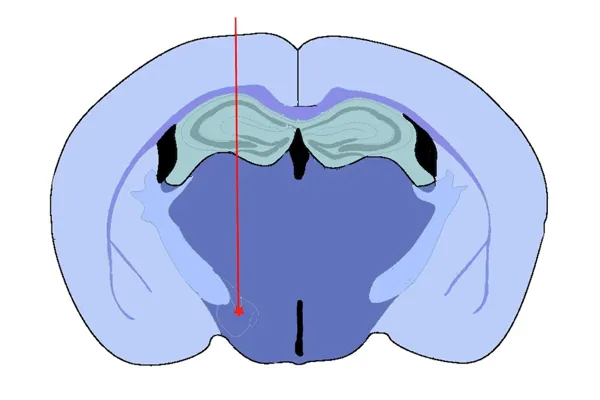
Injection du faisceau frontal médian (MFB)
Modèle spatial de propagation de la pathologie α-synucléine après injection stéréotaxique de fibrilles préformées recombinantes dans le noyau olfactif antérieur (AON).
Le ciblage du noyau olfactif antérieur (NIO) se justifie par les raisons suivantes:
- C'est l'un des premiers sites à démontrer une pathologie α-synucléine dans la maladie de Parkinson humaine (stade 1 de Braak).
- Les symptômes non moteurs associés au système limbique (par exemple, hyposmie/anosmie, altérations du sommeil) sont des symptômes prévalents et précoces de la maladie de Parkinson.
- L'AON est connecté à plusieurs régions cérébrales ipsilatérales et controlatérales, y compris des connexions directes (1er ordre) avec le bulbe olfactif, l'amygdale, le cortex piriforme, et des connexions d'ordre supérieur, telles que le cortex entorhinal et l'hippocampe ; nombre de ces régions sont très vulnérables à la neurodégénérescence.
Le ciblage du striatum +/- du cortex sus-jacent se justifie par les raisons suivantes:
- Il s'agit du site d'injection initialement rapporté (Luk et al., J. Exp. Med., 209: 975-986, 2011 ; doi: 10.1084/jem.20112457; Luk et al., Science, 338: 949-953, 2012 ; doi: 10.1126/science.1227157).
- Les terminaisons nerveuses dopaminergiques du striatum proviennent des neurones de la substantia nigra.
- L'injection dans le cortex cérébral sus-jacent augmente l'étendue de la pathologie de l'alpha-synucléine dans le cerveau.
Le ciblage du faisceau cérébral antérieur médian (MFB) se justifie notamment par les raisons suivantes:
- Il s'agit d'un tractus directement connecté à la substantia nigra et à l'aire tegmentale ventrale, et il est souvent ciblé dans les modèles de la maladie de Parkinson humaine basés sur les toxines (par exemple la 6-hyroxydopamine [6-OHDA]).
- Elle sert de « plaque tournante » pour les projections provenant de nombreuses autres régions cérébrales, constituant ainsi un excellent point de départ pour faciliter la propagation de la pathologie de l'alpha-synucléine à des régions cérébrales éloignées.
- Ce modèle entraîne une perte de neurones dopaminergiques positifs pour la tyrosine hydroxylase dans la substantia nigra et des déficits moteurs associés.
Un avantage significatif de ce modèle animal de la maladie de Parkinson est qu'il reproduit de nombreux aspects de la maladie humaine, notamment:
- Propagation hautement reproductible de l'alpha-synucléine selon un schéma spatio-temporel bien défini, entraînant une pathologie étendue de l'alpha-synucléine dans les corps cellulaires neuronaux et les neurites
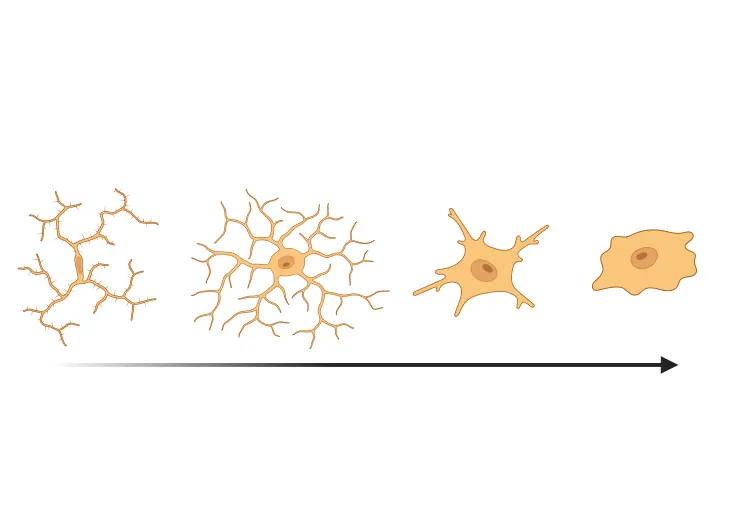
- Forte neuroinflammation (microglies activées et astrocytes réactifs)
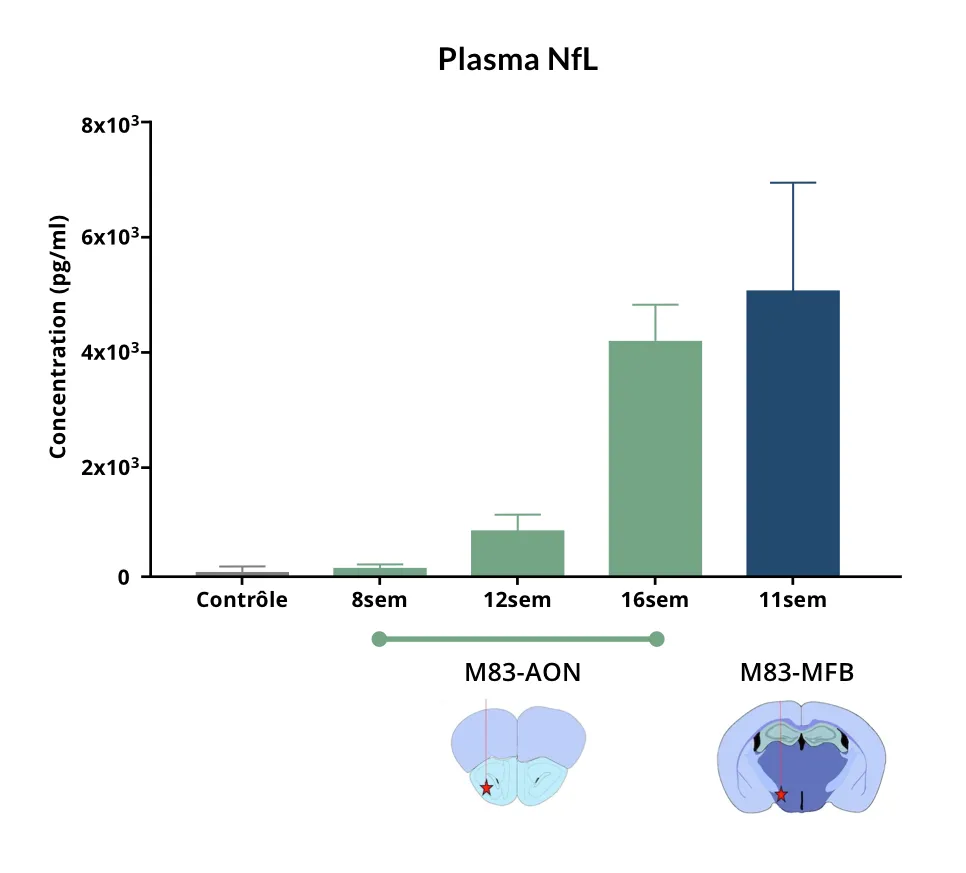
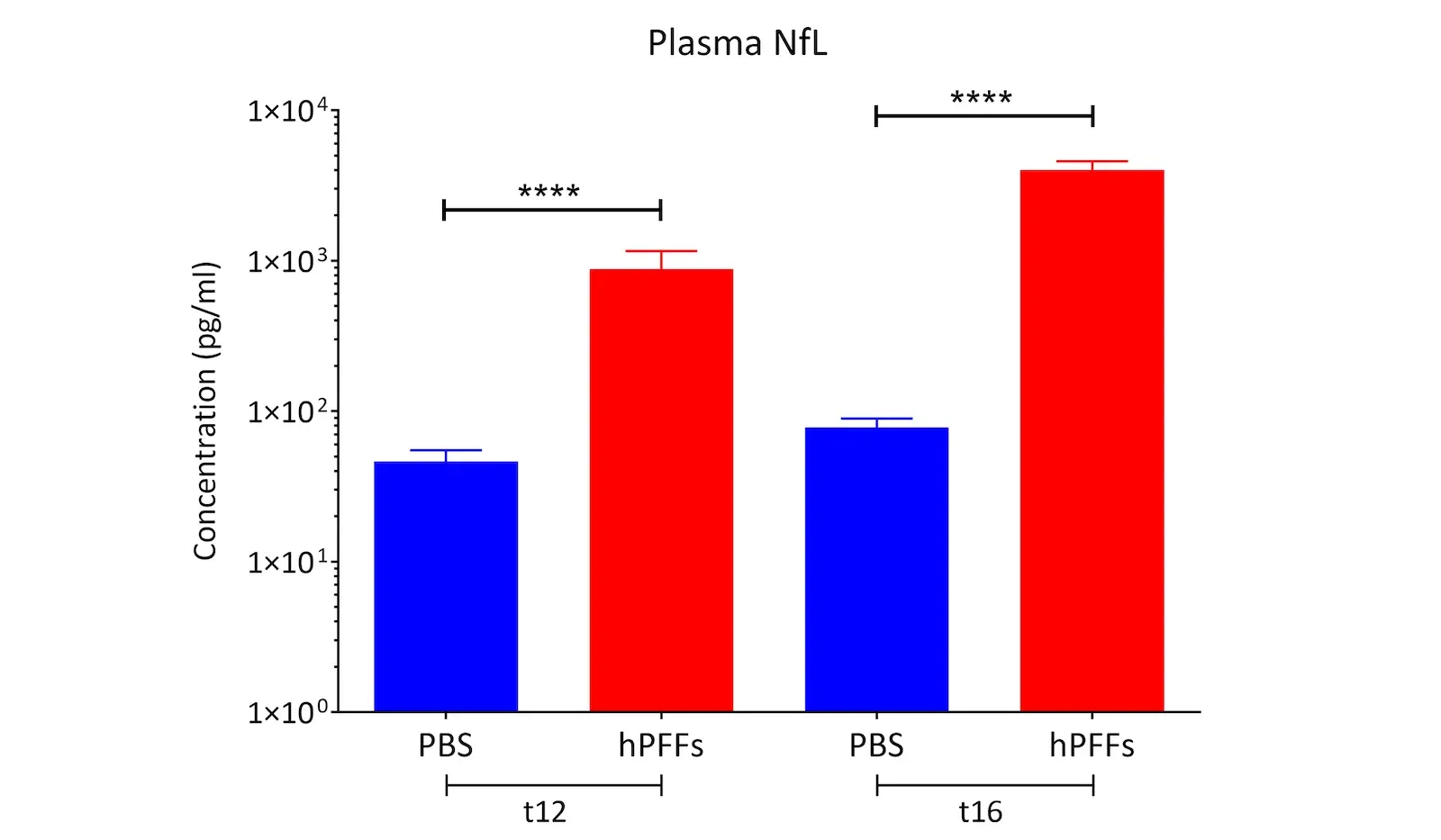
- Neurodégénérescence avec augmentation des niveaux de chaîne légère des neurofilaments (NfL ; NF-L) dans le sang et le LCR
- Changements comportementaux mesurables (par exemple, fonction motrice, sommeil)
- Possibilité de modifier la maladie par une intervention thérapeutique
Génération de modèles de synucléine
Un schéma général pour la génération de modèles animaux de synucléine PFF est le suivant:
Nous avons obtenu une licence pour les souris transgéniques (tg) M83. En tant qu'ORC en neurosciences précliniques, nous maintenons une colonie de reproduction bien établie de ces souris transgéniques alpha-synucléine en interne à Biospective, ce qui nous permet de mener des études à grande échelle (>100 souris).
Pour ce modèle de rongeur, nous élevons et vieillissons des souris M83+/- jusqu'à l'âge de 8 à 12 semaines. Nous pouvons également utiliser des souris de type sauvage (B6-C3H) âgées de 8 à 12 semaines. Nous procédons ensuite à l'injection stéréotaxique de PFFs d'alpha-synucléine humaine recombinante soniquée dans la région cible. Nous utilisons des appareils stéréotaxiques numériques avec des micro-injecteurs automatisés pour une grande précision.
Ce modèle animal est hautement reproductible avec un taux de réussite de près de 100% de l'ensemencement de PFF de synucléine.
Nos mesures validées pour le modèle de souris à la synucléine
- Poids corporel
- Résultats cliniques
- Tests de la fonction motrice
- Analyse du sommeil
- Atrophie cérébrale par IRM (Pour en savoir plus, consultez notre présentation - Analyse de l'atrophie cérébrale dans des modèles de rongeurs atteints de maladies neurodégénératives)
- Mesures du neurofilament à chaîne légère dans le plasma et le LCR (Pour en savoir plus, consultez notre ressource - Le neurofilament à chaîne légère dans les modèles de la maladie de Parkinson)
- Immunohistochimie et immunofluorescence multiplexe (Lire la suite de notre présentation - Activation microgliale dans un modèle de souris α-synucléine de la maladie de Parkinson)
En savoir plus sur la transposabilité de ce modèle à la maladie de Parkinson humaine.
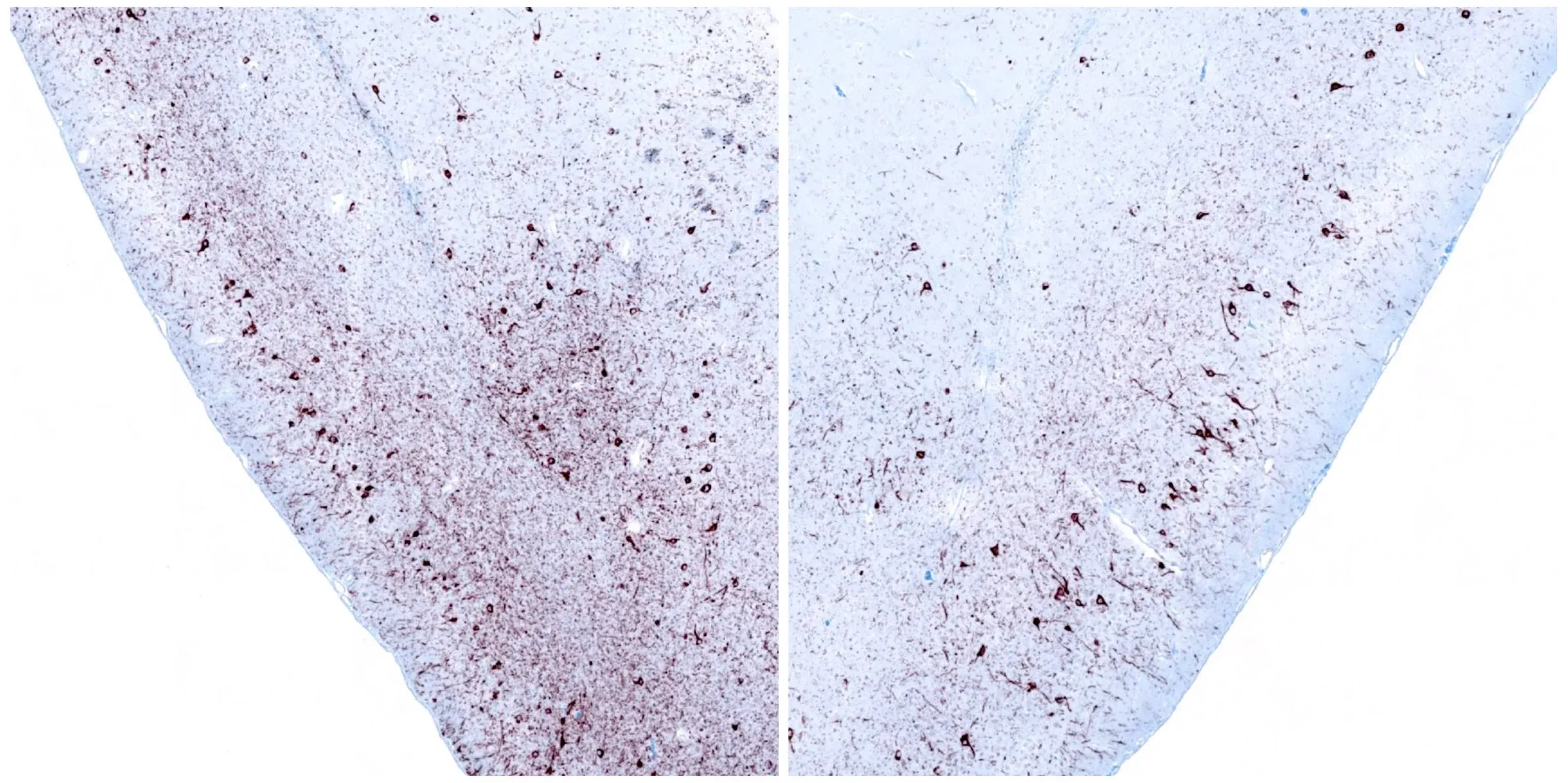
Coloration par immunohistochimie de l'α-synucléine phosphorylée du cortex piriforme ipsilatéral (gauche) et controlatéral (droite) 12 semaines après l'injection stéréotaxique unilatérale de fibrilles préformées d'α-synucléine dans le noyau olfactif antérieur d'une souris M83+/-.
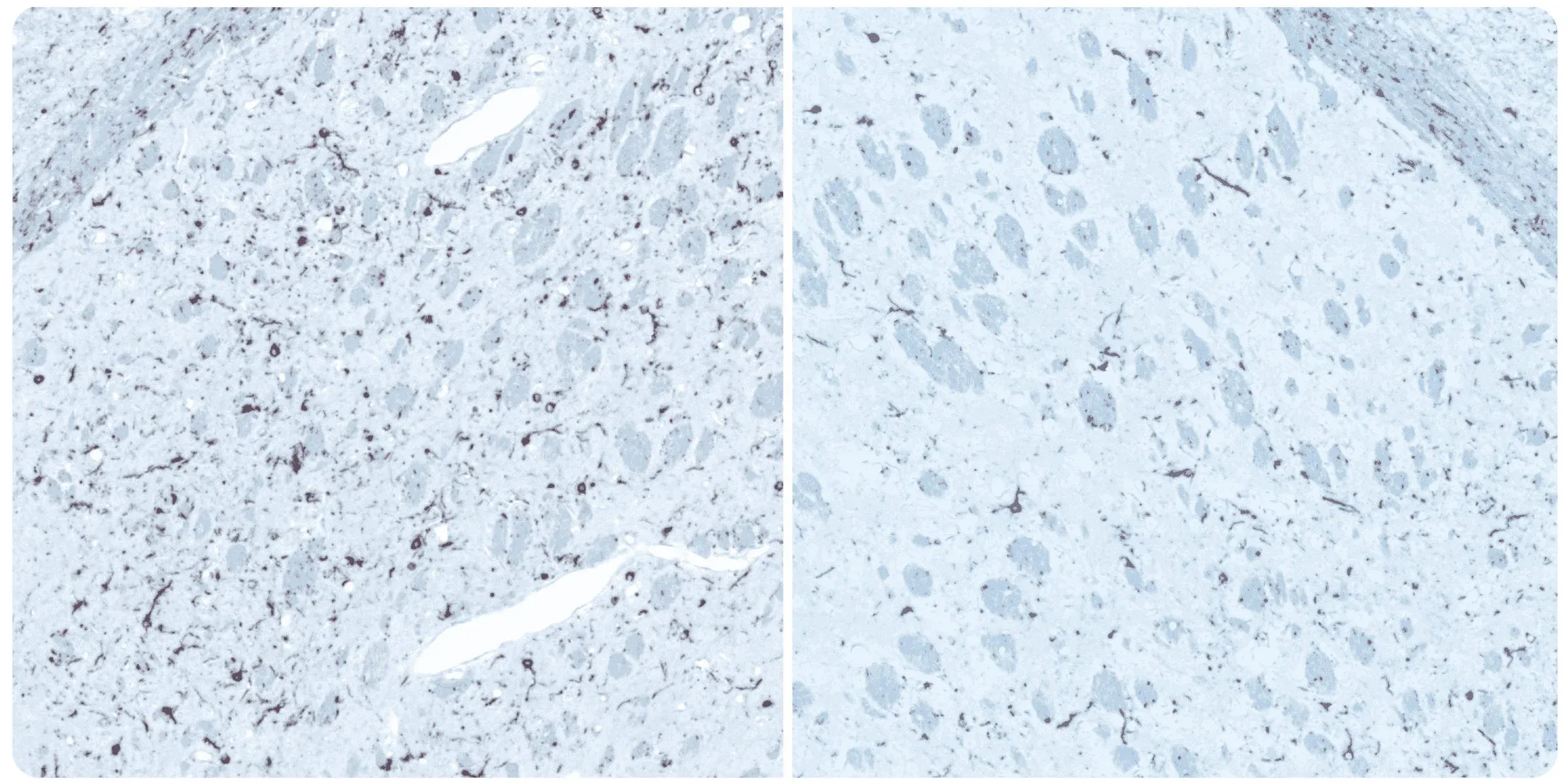
Coloration immunohistochimique de l'alpha-synucléine phosphorylée du striatum ipsilatéral (gauche) et controlatéral (droite) 12 semaines après l'inoculation stéréotaxique unilatérale de fibrilles préformées d'α-synucléine (PFFs) dans le striatum et le cortex cérébral sus-jacent d'une souris M83+/-.
En savoir plus sur notre caractérisation de ce modèle, nos mesures validées et nos services de CRO en neurosciences précliniques.
Découvrez d'autres de nos modèles sur la maladie de Parkinson
Contenu connexe
Informations actualisées sur la maladie de Parkinson et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la maladie de Parkinson.
Le neurofilament à chaîne légère dans les modèles de la maladie de Parkinson
Comment les niveaux de neurofilament à chaîne légère (NfL ; NF-L) peuvent être utilisés comme biomarqueurs dans le sang et le LCR dans les modèles de souris et de rats atteints de la maladie de Parkinson.
Modèles AAV d'α-synucléine pour le développement de médicaments contre la maladie de Parkinson
Vue d'ensemble des modèles de souris et de rats à α-synucléine induite par un vecteur du virus adéno-associé (AAV), à utiliser dans les études précliniques de thérapeutiques modificatrices de la maladie.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.