Caractérisation d'un nouveau modèle de souris AAV-hTau pour les tauopathies présentant des caractéristiques parkinsoniennes
Modèle de tauopathie induite par AAV (AAV Tau) - Présentation
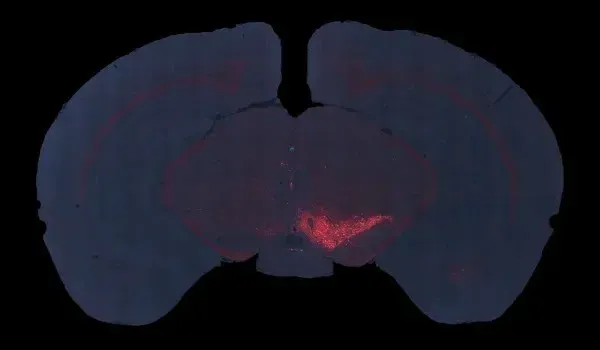
Pour ce modèle de paralysie supranucléaire progressive et de dégénérescence corticobasale, nous effectuons une inoculation stéréotaxique unilatérale d'AAV surexprimant la protéine tau humaine de type sauvage (MAPT) dans la substance noire de souris C57BL/6 âgées de 2 à 3 mois environ. Ce modèle murin reproduit plusieurs caractéristiques clés des tauopathies humaines, notamment :
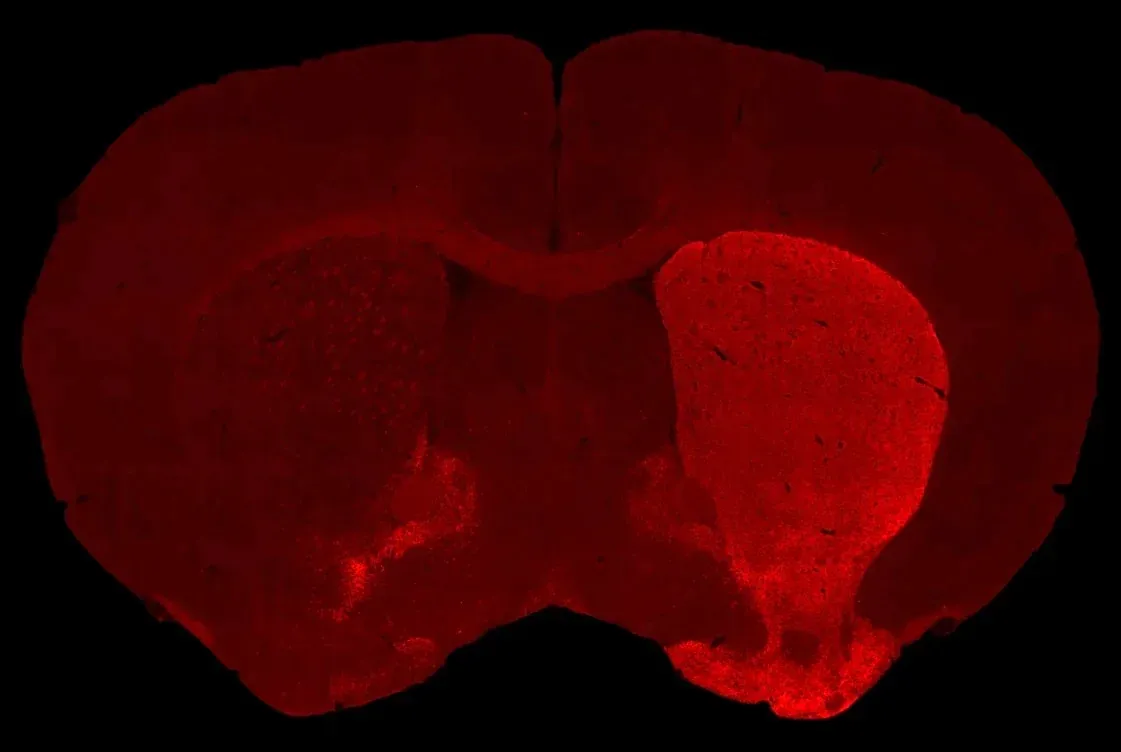
- Réduction des neurones dopaminergiques dans la substance noire pars compacta
- Dénervation dopaminergique du striatum ipsilatéral
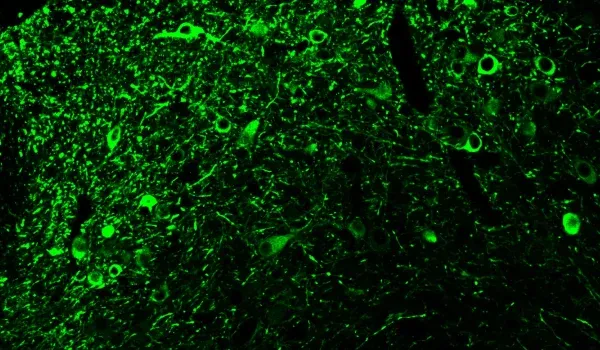
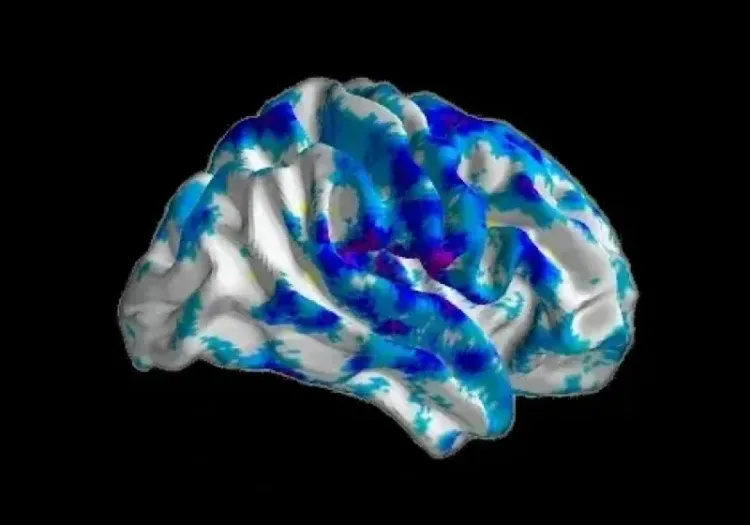
- Agrégats de protéine tau phosphorylée dans les corps cellulaires et les neurites
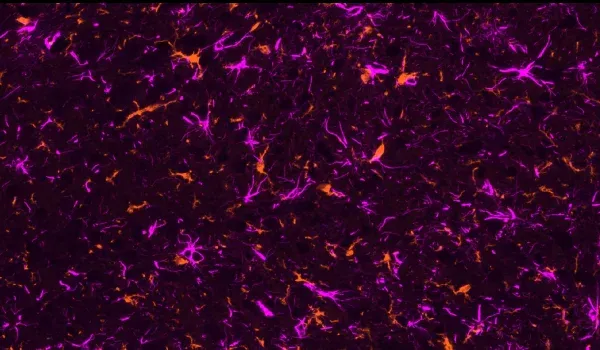
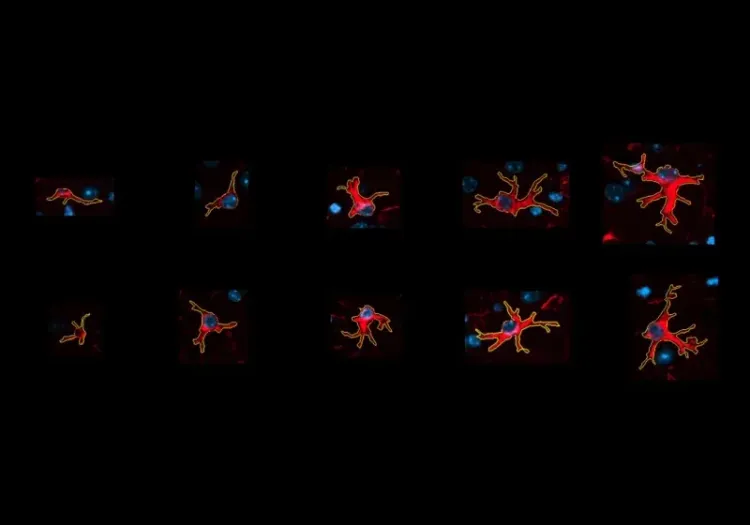
- Microglie activée
- Astrocytes réactifs
- Dysfonctionnement moteur
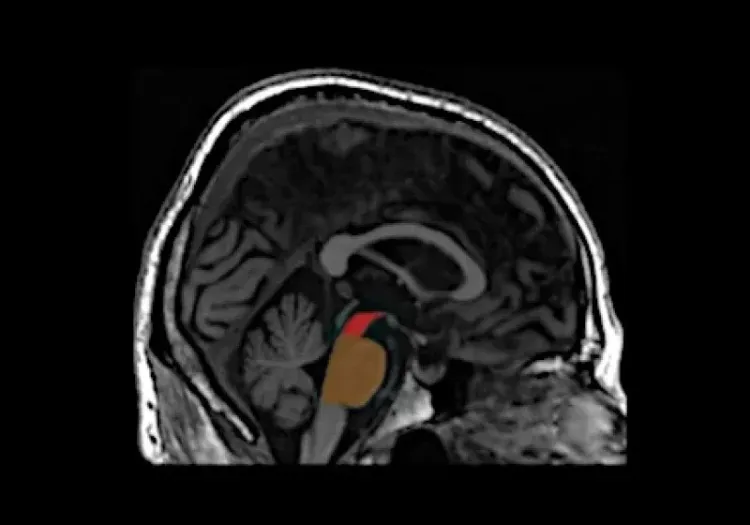
- Atrophie cérébrale (substantia nigra, mésencéphale, caudé-putamen) mesurée par IRM in vivo
Génération du modèle AAV Tau
Le schéma général de la génération du modèle est le suivant :

Pour ce modèle spécifique, nous utilisons des souris C57BL/6 âgées de 8 à 12 semaines. Nous procédons ensuite à une injection stéréotaxique de vecteurs AAV à proximité de la substance noire. Nous utilisons des dispositifs stéréotaxiques numériques avec des micro-injecteurs automatisés pour une grande précision.
Les études utilisant ce modèle peuvent être rapidement lancées. La phase in vivo de l'étude dure généralement environ 6 semaines. Ainsi, les résultats peuvent être fournis dans un délai relativement court, surtout par rapport aux modèles transgéniques tau conventionnels de la maladie d'Alzheimer et des tauopathies.
Nos mesures validées
- Test de préhension des membres postérieurs
- Test de suspension par la queue
- Test du cylindre
- Test de la tige tournante
- IRM atrophie cérébrale
- IHC et immunofluorescence multiplexe
En savoir plus sur la transposabilité de ce modèle aux tauopathies humaine.
Caractérisation du modèle
La présentation interactive ci-dessous vous permet d'explorer la caractérisation de notre modèle de souris AAV Tau, y compris les données in vivo et les images haute résolution de coupes de tissus entières obtenues par immunofluorescence multiplex.
Vous pouvez simplement naviguer dans cette "histoire d'images" à l'aide du panneau de gauche.
Vous pouvez effectuer un panoramique sur les images microscopiques à haute résolution en utilisant le bouton gauche de la souris. Vous pouvez effectuer un zoom avant et arrière à l'aide de la souris/du trackpad (haut/bas) ou des boutons + et - situés dans le coin supérieur gauche. Vous pouvez basculer (on/off), changer la couleur et ajuster les paramètres d'image pour les canaux et les segmentations dans le panneau de contrôle situé dans le coin supérieur droit.
Nous vous conseillons d'utiliser le mode plein écran pour une meilleure expérience interactive.
Découvrez notre caractérisation des modèles murins AAV Tau, nos mesures validées et nos services CRO en neurosciences précliniques.
Découvrez nos modèles des tauopathies
Contenu connexe
Informations actualisées sur la maladie d'Alzheimer et les tauopathies et meilleures pratiques liées à l'utilisation de biomarqueurs translationnels pour l'évaluation d'agents thérapeutiques dans des modèles animaux.
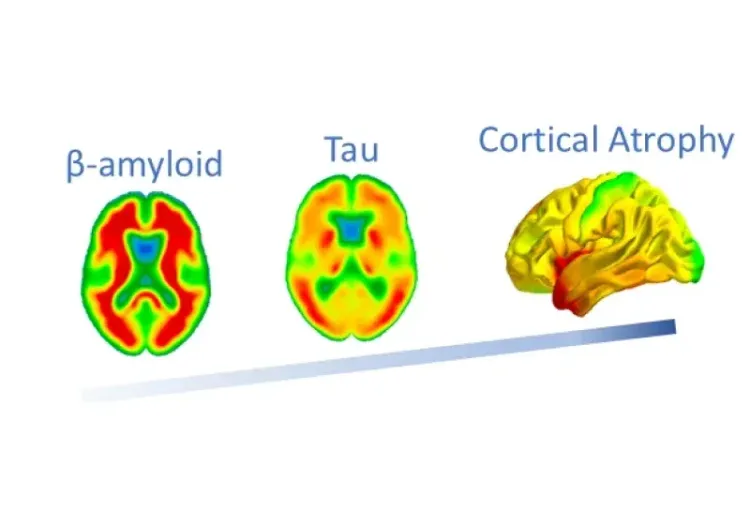
L'atrophie liée à la protéine Tau est indépendante de la β-amyloïde et de l'APOE ε4
En utilisant les biomarqueurs d'imagerie IRM, Tau PET et Amyloid PET de l'étude ADNI, nous montrons que la protéine Tau est plus fortement liée à l'atrophie cérébrale que la β-amyloïde ou l'APOE ε4.
Mesures IRM de la progression de la maladie pour les essais cliniques sur la PSP
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études 4RTNI et FTLDNI sur l'histoire naturelle de la paralysie supranucléaire progressive (PSP).
IRM et dégénérescence corticobasale (CBD)
Mesures longitudinales de l'atrophie cérébrale par IRM provenant des études 4RTNI et FTLDNI, y compris le calcul de la taille des échantillons pour les essais cliniques sur la dégénérescence corticobasale.
La diminution du métabolisme du glucose cérébral dans la DCL est induite par la protéine Tau
Nous démontrons un rôle plus important de la protéine tau que de la β-amyloïde dans la réduction du métabolisme cérébral du glucose en analysant les images TEP de l'étude ADNI.
Morphologie des astrocytes dans la maladie d'Alzheimer
Une vue d'ensemble de l'analyse morphologique des astrocytes et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Astrocytes et modèles murins β amyloïde de la maladie d’Alzheimer
L'analyse de la morphologie des astrocytes dans le microenvironnement de la plaque amyloïde-β fournit une mesure sensible de la progression de la maladie chez les souris transgéniques.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
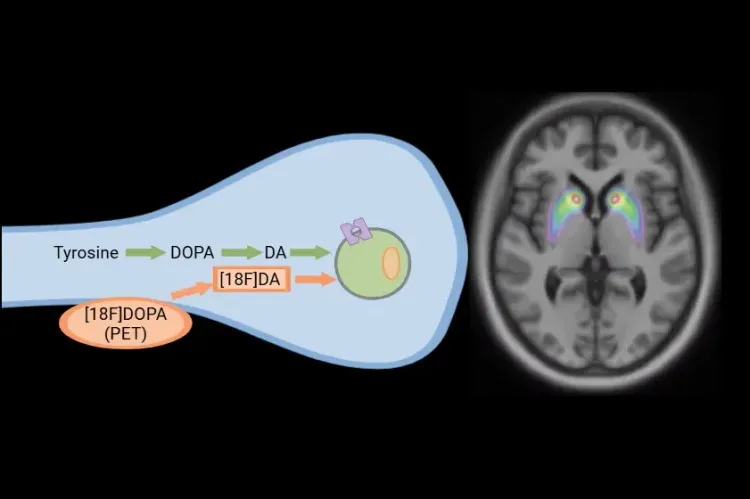
[18F]DOPA PET dans les essais cliniques sur la maladie de Parkinson
Comment la [18F]DOPA PET est utilisée pour surveiller la progression de la maladie et la réponse à l'intervention thérapeutique dans les essais cliniques sur la maladie de Parkinson et les troubles du mouvement.