La tau, plutôt que l'amyloïde-β, est le moteur de la neurodégénérescence dans la maladie d'Alzheimer et dans les modèles murins de la maladie d'Alzheimer
Modèles transgéniques de bêta-amyloïde
La pathologie bêta-amyloïde qui caractérise la maladie d'Alzheimer humaine peut être modélisée par la surexpression de la protéine précurseur amyloïde (APP) humaine mutante et de la préséniline 1 (PS1 ; PSEN1) dans des souris transgéniques. Comme pour la maladie humaine, l'évolution de la pathologie augmente avec l'âge.
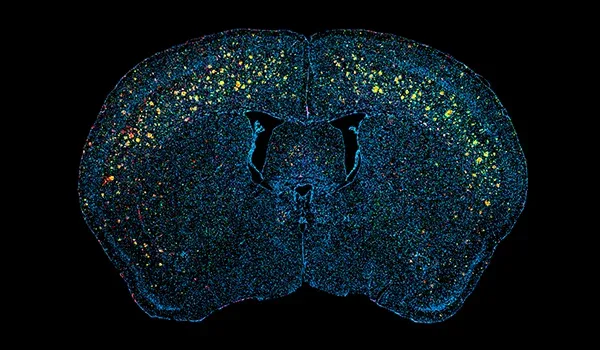
Le modèle APP/PS1 que nous utilisons pour l'évaluation préclinique de l'efficacité d'agents thérapeutiques expérimentaux modifiant la maladie est hautement reproductible et reproduit plusieurs caractéristiques clés de la MA humaine. Ces souris présentent un développement progressif des plaques de bêta-amyloïde (Aβ), une pathologie cérébrovasculaire et une neuroinflammation. La réponse à l'intervention thérapeutique peut être évaluée par plusieurs lectures quantitatives, y compris l'analyse d'image avancée de la coloration d'immunofluorescence multiplex des coupes de tissus cérébraux numérisés.
Modèle de co-pathologie amyloïde bêta et tau
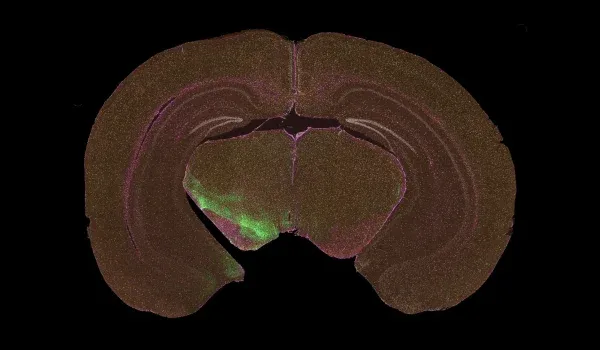
Notre modèle murin présentant une co-pathologie amyloïde bêta (Aβ) et tau reproduit deux caractéristiques déterminantes de la maladie d'Alzheimer, à savoir l'accumulation de plaques Aβ et la neurodégénérescence associée à la protéine tau, en combinant des méthodologies transgéniques et basées sur des vecteurs viraux. Ce modèle offre une plateforme robuste et pertinente sur le plan translationnel pour étudier les mécanismes de la maladie et évaluer l'efficacité des interventions thérapeutiques modificatrices de la maladie d'Alzheimer.
La pathologie amyloïde-β est établie à l'aide de souris transgéniques APP/PS1, qui présentent un dépôt de plaques Aβ dépendant de l'âge. Pour induire une tauopathie, des vecteurs viraux adéno-associés (AAV) codant pour la protéine tau humaine de type sauvage (2N4R) sont administrés par injection stéréotaxique dans des régions du cerveau pertinentes pour la maladie. Cette expression ciblée entraîne l'accumulation d'agrégats de protéine tau phosphorylée dans le soma et les processus neuronaux. Ce modèle de co-pathologie présente une neuroinflammation marquée, une neurodégénérescence et des troubles fonctionnels associés, reflétant les interactions pathologiques complexes pertinentes pour la maladie d'Alzheimer.
Transposabilité de nos modèles de la maladie d'Alzheimer et des tauopathies aux maladies humaines
Plaques amyloïdes-β et pathologie cérébrovasculaire
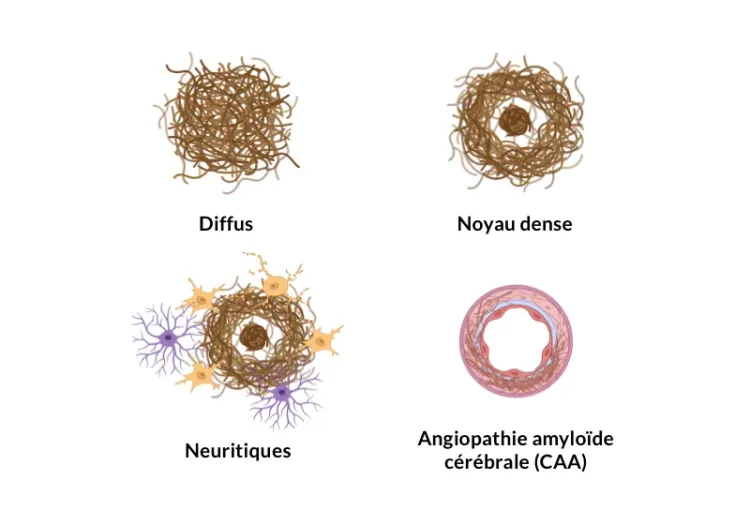
Les plaques extracellulaires et les dépôts cérébrovasculaires d'amyloïde-β agrégée sont des caractéristiques neuropathologiques de la maladie d'Alzheimer (Serrano-Pozo, 2011). Notre modèle de souris APP/PS1 montre des augmentations dépendantes du temps de la pathologie amyloïde-&bêta; (y compris les plaques diffuses, à noyaux denses et névritiques, l'amyloïde-&bêta; intracellulaire et la pathologie cérébrovasculaire). La pathologie A&bêta; progresse selon un schéma spatiotemporel bien défini et peut être quantifiée à l'aide d'algorithmes sophistiqués développés par notre équipe.
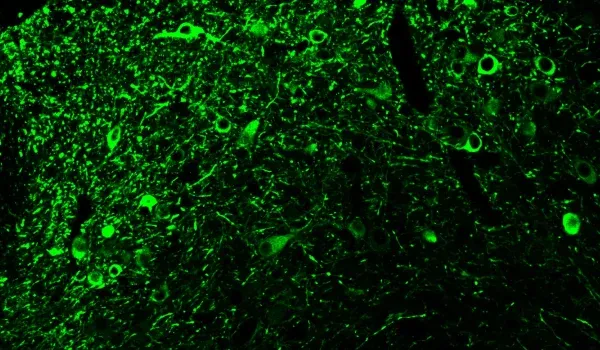
La protéine tau
En plus de l'amyloïde-β, la protéine tau est une protéine mal repliée clé présente dans la maladie d'Alzheimer. On pense que la protéine tau est le principal moteur de certaines des caractéristiques cliniques et de neuroimagerie de la maladie d'Alzheimer (Lew, 2021; Carbonell, 2025). Notre modèle APP/PS1/tau humaine présente à la fois une pathologie amyloïde-β et une pathologie tau. Une coloration de la protéine tau phosphorylée est observée dans les corps cellulaires et les processus. Les tauopathies, telles que la paralysie supranucléaire progressive, la dégénérescence corticobasale et la démence frontotemporale, présentent une pathologie tau pure dans des régions spécifiques du cerveau. Dans notre modèle AAV-hTau, nous sommes en mesure de cibler l'expression de la protéine tau dans les régions de la substance noire et du mésencéphale pour modéliser efficacement les tauopathies présentant des caractéristiques parkinsoniennes.
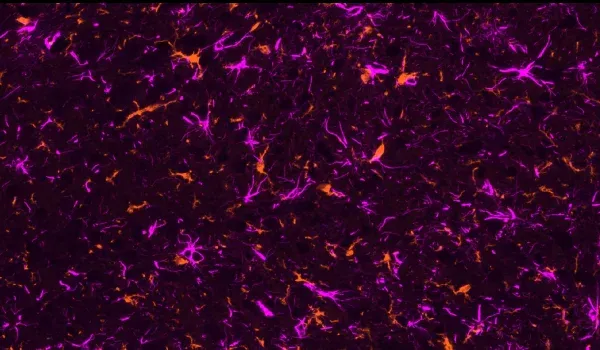
Microglies activées et astrocytes réactifs
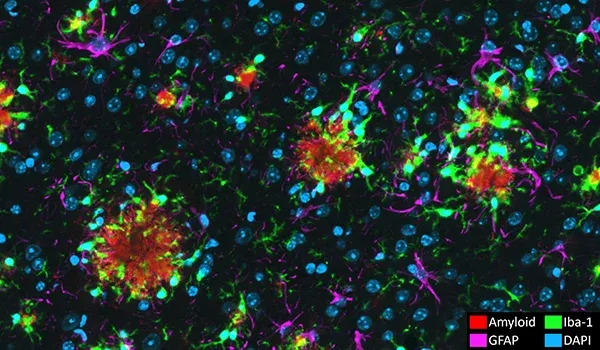
Les cellules neuro-inflammatoires, y compris la microglie activée et les astrocytes réactifs, se trouvent à proximité immédiate des plaques amyloïdes et bêta et tau mal repliées (Minter, 2015; Chen et Yu, 2023). Dans notre modèle murin APP/PS1, nous avons démontré une relation spatiale et temporelle entre les plaques Aβ, la microglie activée et la microglie non activée, ainsi qu'entre les plaques Aβ et les astrocytes hypertrophiques et non hypertrophiques. Nous observons également une forte microgliose et astrogliose en relation avec la tau phosphorylée dans notre co-pathologie APP/PS1/hTau et nos modèles de tauopathie induite par AAV.
Les caractéristiques motrices parkinsoniennes induites par la tauopathie
La paralysie supranucléaire progressive et la dégénérescence corticobasale sont des tauopathies pures qui, entre autres manifestations cliniques, se caractérisent par des symptômes parkinsoniens et une perte importante de neurones dans la substance noire (Oyangi, 2001). Dans notre modèle AAV-hTau, nous avons constaté des déficits moteurs importants (sur la base du test du cylindre, du test de suspension de la queue par balancement, du test de la tige tournante et du test de préhension des membres postérieurs) résultant de la dégénérescence des neurones dopaminergiques de la substance noire et de la dénervation correspondante du striatum.
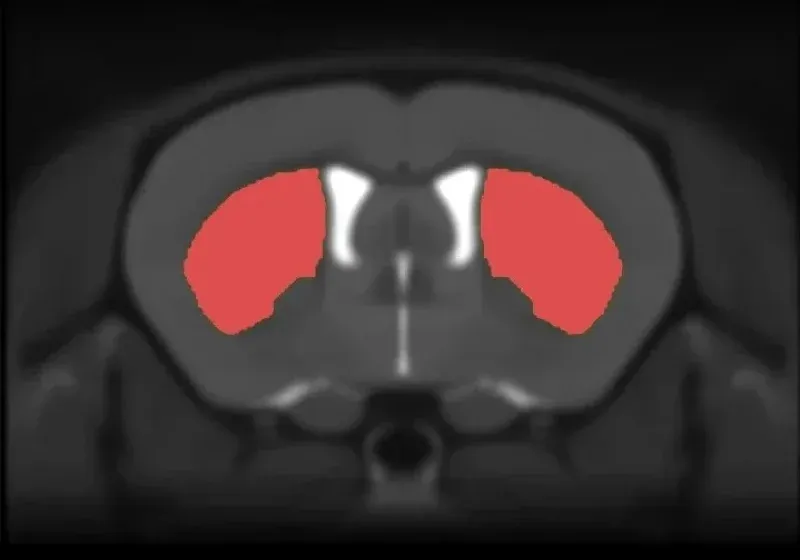
Atrophie cérébrale régionale
Les biomarqueurs d'imagerie multimodale sont largement utilisés dans les essais cliniques sur la maladie d'Alzheimer et les tauopathies. Les mesures du volume régional et de l'épaisseur corticale dérivées de l'IRM sont très sensibles à l'atrophie cérébrale et permettent de suivre l'évolution de la maladie au fil du temps dans les cas de maladie d'Alzheimer, de paralysie supranucléaire progressive, de dégénérescence corticobasale et de démence frontotemporale. En utilisant l'acquisition non invasive d'IRM in vivo du cerveau entier, combinée à un traitement et une analyse d'images avancés et entièrement automatisés, nous avons mis en évidence une atrophie cérébrale régionale très significative, spécifiquement liée à la pathologie tau, servant ainsi de mesure robuste de la neurodégénérescence in vivo et de biomarqueur translationnel.
Modèles de souris pour la maladie d'Alzheimer Caractéristiques
La présentation interactive ci-dessous vous permet d'explorer la relation entre l'amyloïde-β, la protéine tau et l'atrophie cérébrale dans la maladie d'Alzheimer chez l'homme et dans nos modèles murins de la maladie d'Alzheimer, y compris les données in vivo et les images haute résolution de coupes de tissus entières obtenues par immunofluorescence multiplex.
Vous pouvez simplement naviguer dans cette "histoire d'images" à l'aide du panneau de gauche.
Vous pouvez effectuer un panoramique sur les images microscopiques à haute résolution en utilisant le bouton gauche de la souris. Vous pouvez effectuer un zoom avant et arrière à l'aide de la souris/du trackpad (haut/bas) ou des boutons + et - situés dans le coin supérieur gauche. Vous pouvez basculer (on/off), changer la couleur et ajuster les paramètres d'image pour les canaux et les segmentations dans le panneau de contrôle situé dans le coin supérieur droit.
Nous vous conseillons d'utiliser le mode plein écran pour une meilleure expérience interactive.
Pour en savoir plus sur la caractérisation de ces modèles murins de la maladie d'Alzheimer et des tauopathies, nos mesures validées et nos services CRO en neurosciences précliniques.
Contenu connexe
Informations actualisées sur la maladie d'Alzheimer et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la maladie d'Alzheimer.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Analyse des plaques amyloïdes-β dans la maladie d'Alzheimer
Aperçu des méthodes de classification et de quantification des plaques Aβ dans les coupes de tissus cérébraux provenant d'humains et de modèles animaux de la maladie d'Alzheimer (souris et rats transgéniques).