ALS의 마우스 모델은 인간 질병에서 관찰되는 척수 운동 신경 병리를 재현합니까?
유용한 ALS 동물 모델의 필수적인 특징은 쉽게 측정할 수 있는 인간 질병의 여러 측면을 재현한다는 것입니다 (ALS 마우스 모델의 약물 개발 참조). 운동 신경 세포의 손실과 축삭, 수상돌기 및 시냅스 퇴화는 ALS의 특징입니다 (Salzinger, 2024). 운동 신경 세포의 퇴화는 골격근 약화와 소모, 그리고 일반적으로 호흡 부전으로 인한 최종 사망으로 이어집니다 (Hardiman, 2011). 가족성 ALS는 전체 사례의 약 10%를 차지하며, 가장 흔한 돌연변이는 C9ORF72, SOD1, FUS, TARDBP 유전자에서 발생합니다 (Hardiman, 2017). TARDBP 유전자에서 관찰되는 돌연변이는 드물지만(1% 미만), TARDBP 유전자에 의해 암호화된 단백질(TDP-43)은 약 97%의 ALS 사례에서 세포질 응집체를 형성합니다 (Shatunov, 2021). 따라서 이러한 유전자와 다른 유전자를 기반으로 한 ALS의 유전자 조작 동물 모델이 개발되었습니다.
인간 질병의 신경 운동적 특징을 요약한 ALS 마우스 모델의 예로는 hTDP-43ΔNLS (rNLS8) 트랜스제닉 마우스 모델 (Walker, 2015)이 있습니다 [ALS 약물 개발을 위한 TDP-43 ΔNLS (rNLS8) 마우스 참조]. 이 쥐들은 핵 내 위치 결정 신호(NLS)에 결함이 있는 인간 TDP-43을 과발현하여, 핵 내 TDP-43 발현 수준이 감소한 상태에서 잘못된 위치에 위치하게 되고, 세포질 응집체가 형성됩니다. 척수 운동 뉴런과 관련하여, 이 마우스 모델은 인간 ALS에서 볼 수 있는 것처럼, 상대적으로 느린 운동 뉴런을 보존하면서 빠르게 피로해지는(FF) 운동 뉴런의 손실을 보여주고, 신경근 접합부(NMJ) 탈신경과 재신경화의 증거를 보여줍니다 (Spiller, 2016; Hur, 2022).
척수 운동 뉴런의 관여를 평가하는 데 사용할 수 있는 생체 내 측정법은 무엇입니까?
전임상 치료 효능 연구의 생체 내 단계에서 척수 운동 뉴런에 대한 질병 진행의 영향을 평가할 수 있는 능력은 상당한 이점을 가지고 있습니다. 척수 직접 시각화 및 관련 정량적 영상 측정법, 그리고 표적 근육의 탈신경으로 인한 하류 측정을 포함한 여러 가지 접근법이 이용 가능합니다.
생체 내 척수 영상
생체 내 자기공명영상(MRI)과 같은 비침습적 영상은 척수 운동 뉴런의 상태를 반영하는 정량적 측정을 가능하게 합니다. Grolez et al. (Grolez, 2018) 은SOD186R 형질전환 마우스의 경추 척수 두께가 점진적으로 감소하는 것을 보여주었습니다. Marcuzzo et al. (Marcuzzo, 2017 )은 G93A-SOD1 마우스의 척수 백질과 회백질에서 시간의 흐름에 따른 변화를 종단 생체 내 확산 텐서 영상(DTI)을 통해 발견했습니다. Figini et al. (Figini, 2016)은 G93A-SOD1 마우스와 야생형 마우스의 척수 차이를 확실하게 감지할 수 있도록 DTI 매개 변수를 최적화했습니다. Gatto와 동료 연구원들 (Gatto, 2018)은 YFP,G93A‐SOD1 마우스에서 생체 내 DTI를 수행했고, 출생 후 80일(P80)에 분수 이방성(FA), 축 방향 확산도(AD), 방사상 확산도(RD)에 상당한 변화가 있음을 발견했습니다. G93A-SOD1 마우스와 대조군 마우스 사이의 이러한 생체 내 영상 차이는 축삭 형광 강도와 세포막 세포 표지자의 변화와 관련이 있었습니다. Underwood et al. (Underwood, 2011 )은 확산 텐서 영상(DTI)이 생체 내 척수 손상 축삭을 감지할 수 있다는 사실을 발견했습니다. 이 효과는 야생형 쥐와 비교했을 때 G93A-SOD1 쥐의 요추 척수 배측 백질에서 FA 값이 감소하는 것으로 나타났으며, 이 효과는 질병의 진행에 따라 더욱 두드러지고 질병의 중증도와 상관관계가 있었습니다. 감소된 FA 값은 운동 뉴런에서 발생하는 백질로 제한되었고, 감각 백질 섬유는 보존되었습니다. 또한, 축 및 방사상 확산성의 현저한 변화는 전자 현미경(EM)으로 측정된 축삭 변성과 관련이 있었습니다.
비침습적 근육 위축 영상
마우스 모델에서 척수 자체의 확산 특성을 평가하는 것은 어려울 수 있지만, 비침습적 영상으로 축삭 변성/척수 운동 뉴런 손실로 인한 탈신경으로 인한 근육 위축을 측정하는 것은 덜 어렵고 임상적으로 적용할 수 있습니다. 임상적 관점에서 볼 때, Wilcox 외 (Wilcox, 2021)는 체적 MRI가 재현성, 시간적 반응성, 그리고 근육 기능의 임상적 평가와의 상관성을 보여준다는 것을 보여 주었고, 체적 MRI가 근육 재신경 분포의 잠재적 결과 측정 지표가 될 수 있다고 제안했습니다. Jenkins와 동료 연구원들 (Jenkins, 2013; Jenkins, 2018)은 ALS 환자의 근육 부피 변화와 기타 영상 파라미터(예: T2 신호)를 측정하기 위해 MRI를 사용했습니다. 이 연구팀은 파일럿 연구에서 임상적 약화가 진행된 ALS 환자의 특정 근육에서 점진적인 근육 부피 손실을 발견했습니다 (Jenkins, 2013). Klickovic et al. (Klickovic, 2024 )은 개별 최대 관찰 기간 동안 지배적인 손과 머리 및 목 근육의 부피와 하반신의 단면적(CSA)이 현저하게 감소했다고 보고했습니다.
근육 위축의 종단적 생체 내 측정은 MRI와 컴퓨터 단층 촬영(CT)과 같은 양상을 사용하는 동물 모델에서 가능합니다. 마르쿠조와 동료 연구원들 (Marcuzzo, 2011)은 G93A-SOD1 마우스에서 종단적 정량적 MRI 분석을 수행했고, 생후 8주부터 뒷다리 근육 부피의 상당한 손실을 입증했습니다. Pasetto 외 (Pasetto, 2018)와 van der Heyden 외 (van der Heyden, 2020)는 MRI의 대안으로 쥐의 하부 뒷다리에 대한 마이크로CT 측정의 타당성을 보고했습니다.
Biospective의 우리 팀은 ALS의 TDP-43 모델에서 근육 위축을 평가하기 위해 전임상 마이크로 CT 영상을 활용하고 있습니다. 우리는 짧은 촬영 시간으로 TDP-43 ΔNLS(rNLS) 마우스의 하부 뒷다리에 대한 고해상도 이미지를 얻을 수 있었습니다. 아래 그림은 저독성 마우스 모델에서 질병 유발 후 10주째 기준선 대비 근육 부피의 변화율을 보여줍니다.
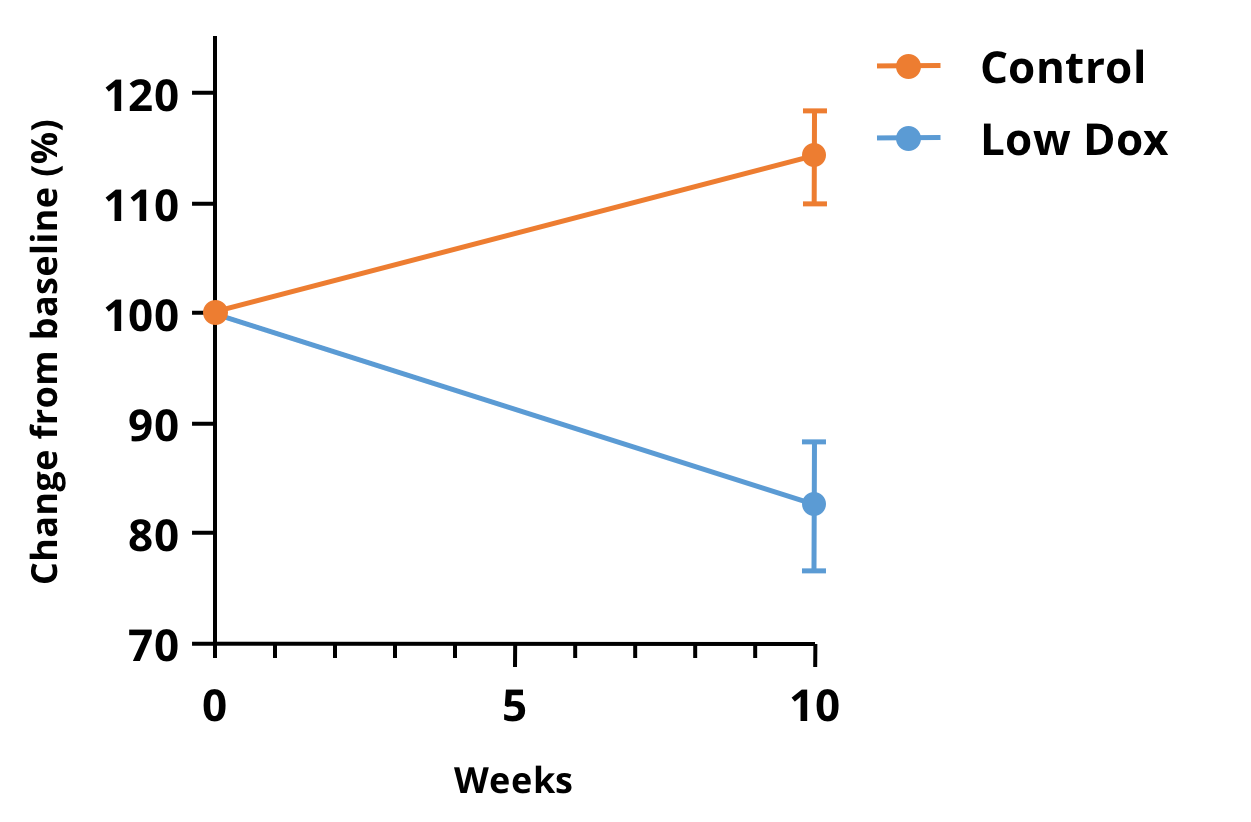
마이크로CT 영상에서 얻은 하부 뒷다리 근육 부피의 변화율(퍼센트)은 "Low Dox" hTDP-43ΔNLS 마우스 모델에서 측정되었습니다. 10주 동안 대조군(tTA)과 저독성 마우스 사이에 매우 유의미한 차이(p<0.0001)가 존재하므로, 이 측정 방법은 이 모델에서 치료 효능 연구를 위한 실제 측정값으로 매력적입니다.
신경근 전기 생리학
전기 생리학(예: 근전도 검사[EMG])은 ALS 환자의 진단과 질병 모니터링을 위해 사용되는 표준 검사입니다. 이 기술은 ALS의 동물 모델에 적용하여 신경근 기능 상태를 평가할 수도 있습니다.
Spiller et al.(Spiller, 2016 )은 비유전자 변형(nTg) 마우스와 rNLS8 마우스에서 고농도 독시사이클린을 투여하지 않은 상태에서 몇 주 동안 좌골신경 자극 후 비복근의 복합근육활동전위(CMAP) 진폭을 측정했습니다. 이 그룹은 hTDP-43ΔNLS 발현으로 CMAP 측정치가 상당히 감소한다는 것을 발견했습니다.
Biospective의 우리 그룹은 "Low Dox" 버전의 rNLS8 모델을 사용하여 유사한 연구를 수행했습니다. "Off Dox" 모델의 관찰 결과와 일치하여, 우리는 "Low Dox" 모델에서 CMAP 진폭의 통계적으로 유의미한 감소를 발견했습니다. 이 테스트는 여러 시점에 걸쳐 수행할 수 있으며, 이 모델에서 실험적 치료제의 효과를 평가하는 데 적합합니다. 또한, CMAP의 평가는 근육 위축에 대한 마이크로-CT 영상 기반 측정을 보완하여 질병 진행의 기능적 측면과 치료적 개입을 통한 잠재적 질병 변형의 측면에서 구조적 및 기능적 신경근 변화에 대한 포괄적인 그림을 제공합니다.
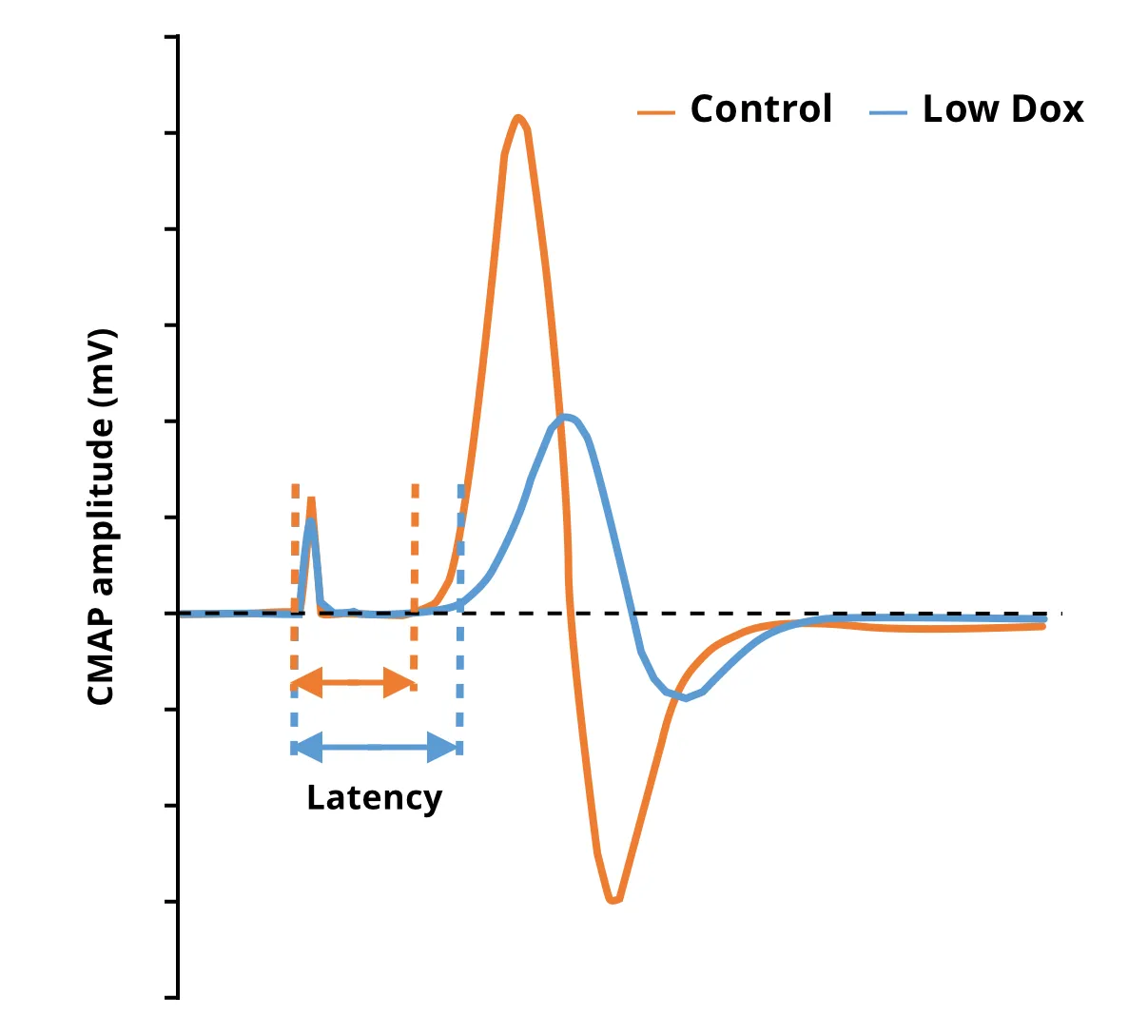
대조군 마우스와 비교하여 Low Dox hTDP-43ΔNLS 마우스에서 CMAP 진폭 감소 및 지연 증가를 나타내는 개별 추적.
CMAP는 ALS의 돌연변이 SOD1 마우스와 랫트 모델에서 운동 시스템 기능을 평가하는 데에도 사용되었습니다. 예를 들어,SOD1G93A 마우스에서 CMAP는 시간이 지남에 따라 감소합니다 (Mancuso, 2011; Mancuso, 2014). McCampbell et al. (McCampbell, 2018 ) 은 생후 5주령에 안티센스 올리고뉴클레오티드(ASO)를 투여한SOD1G93A 마우스 의 경우, 그 후 12주 동안 CMAP가 유지되는 반면, 대조군 마우스의 CMAP는 같은 기간 동안 절반 이상 감소하는 것으로 나타났습니다.
ALS 모델에서 척수 운동 신경 세포의 침범을 조직 섹션에서 어떻게 평가할 수 있습니까?
사후 조직 섹션에서 면역조직화학(IHC)과 면역형광(IF) 방법을 사용하여 척수 운동 뉴런(세포체와 돌기)을 직접 시각화하고, 특성화하고, 정량화할 수 있습니다. 다중 면역형광(mIF) 은 동일한 조직 섹션에서 여러 마커를 평가할 수 있고 특정 마커의 공동 국소화를 평가할 수 있다는 점에서 특히 유용합니다. 조직 섹션에서 척추 운동 뉴런을 시각화하는 한 가지 전략은 형광 분자(예: 콜레라 독소 서브유닛 B, Alexa Fluor® 594 Conjugate; CTB-594) 또는 리포터 유전자(예: GFP, mCherry)를 발현하는 벡터(예: AAV9)를 주입하여 역행 추적법을 수행하는 것입니다. 또는 척추 운동 뉴런에 의해 발현되는 항원을 면역염색할 수 있습니다. 콜린 아세틸트랜스퍼라제(ChAT), 소포체 아세틸콜린 수송체(VAChT), 매트릭스 메탈로프로테이나제-9(MMP-9), 그리고 3형 소전도성 칼슘 활성화 칼륨 채널(SK3) 등이 일반적인 표적입니다.
디지털화된 조직 섹션에서 다양한 양적 측정값을 도출할 수 있습니다. 세포체와 축삭의 수와 크기는 ChAT 또는 VAChT 염색 조직을 사용하여 측정할 수 있으며, 말단 부분은 VAChT 또는 다른 표지자(예: SV2)의 염색을 통해 정량화할 수 있습니다. MMP-9와 SK3는 각각 빠른 운동 뉴런과 느린 운동 뉴런을 평가하는 데 사용할 수 있습니다. 조직 표면적, 다양한 수지상 구조의 특성(예: 전체 수지상 길이, 평균 수지상 길이, 최대 수지상 도달 거리, 수지상 구조의 복잡성)과 같은 형태학적 측정값도 고급 이미지 처리 방법을 사용하여 염색된 조직 단면 이미지로 얻을 수 있습니다 (Fogarty, 2020).
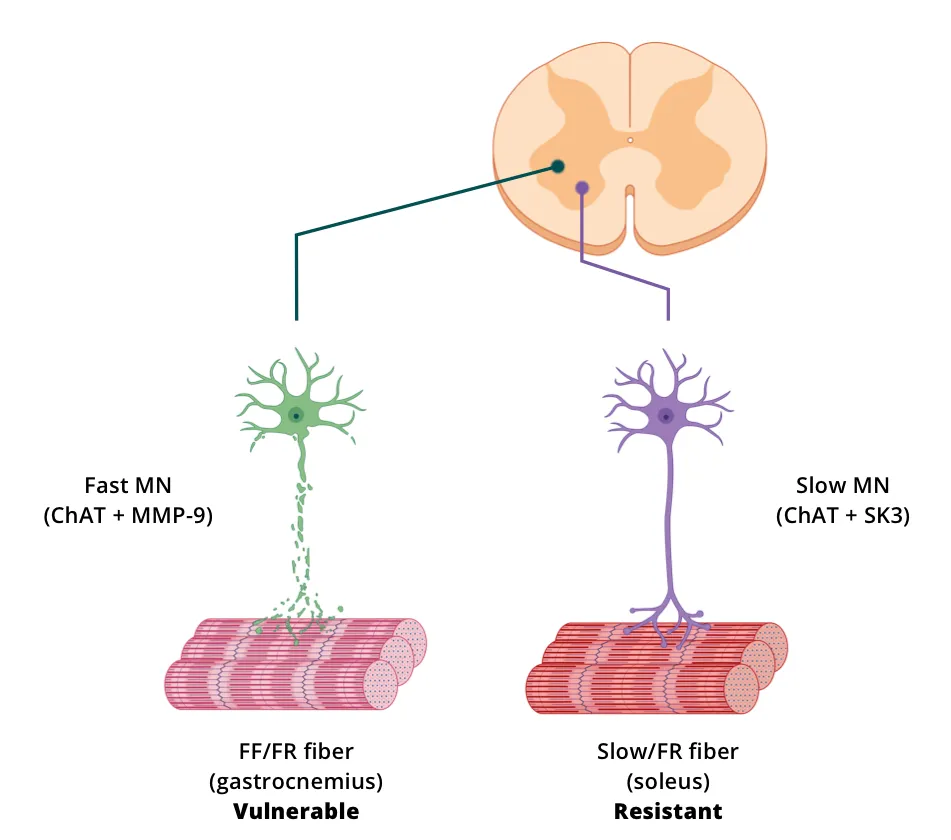
동물 모델에서 척수 운동 뉴런을 라벨링하는 전략의 예시(그림은 Hur, 2022 에서 크리에이티브 커먼즈 저작자표시 라이선스에 따라 복제 및 수정됨).
Spiller et al. (Spiller, 2016)은 hTDP-43ΔNLS 마우스의 척수에서 VAChT IF를 사용하여 운동 뉴런의 수와 체세포 크기를 측정하고, VAChT와 MMP-9의 공동 국소화를 통해 빠른 운동 뉴런의 수를 측정했습니다. 이 그룹은 rNLS8 마우스의 척수 내에서 "느린 운동 뉴런"은 말기까지 생존한 반면, "빠르게 피로해지는 운동 뉴런"은 소실되었다고 보고했습니다. 또한, 축삭의 퇴행이 빠른 트위치 근육 섬유에서 먼저 발생하고, 느린 트위치 섬유는 신경 분포가 유지된다는 사실도 밝혀냈습니다. 유전자 변형 억제 후, 저항성 운동 신경 세포는 이전에 탈신경화된 신경근 접합부(NMJ)에 재신경화를 위한 측지를 뻗어 뻗어 나갔습니다. 운동 신경 세포의 선택적 취약성/저항성은 섬유 유형의 분포에 따라 다양한 근육 그룹의 차별적 위축 또는 전기 생리학을 초래할 수 있습니다. 예를 들어, 표면 비복근은 주로 제2형(빠른 트위치) 섬유로 구성되어 있는 반면, 가자미근은 주로 제1형(느린 트위치) 섬유로 구성되어 있습니다 (Rosser, 1992).
저희 팀은 TDP-43 ΔNLS ALS 마우스 모델에 대한 질문에 기꺼이 답변해 드리고, 치료 효능 연구에 사용하는 모델에 대한 구체적인 정보를 제공해 드릴 수 있습니다.
ALS 모델에 대해 자세히 알아보기
관련 콘텐츠
근위축성 측삭 경화증에 대한 최신 정보와 ALS 동물 모델에서 치료제 평가와 관련된 모범 사례.
자가포식 및 신경퇴행성 질환
세포 자가포식이 뇌 건강과 신경 퇴화에 어떤 역할을 하는지에 대한 개요.
신경근 접합부(NMJ) 형태학 및 ALS 모델
신경근 접합부(NMJ)에 대한 통찰, 근위축성 측삭 경화증(ALS)에서의 그 역할, 그리고 NMJ의 형태학적 변화를 연구하는 데 사용되는 도구와 방법.
ALS 마우스 모델의 신약 개발
근위축성 측삭 경화증(ALS) 치료제의 전임상 시험을 위한 연구용 동물 모델(마우스 및 랫드 모델)의 가장 효과적인 사용에 대한 안내서.
ALS, 알츠하이머병, 파킨슨병의 미세아교세포 형태학
미세아교세포 형태학적 분석의 개요와 신경퇴행성 질환 연구 및 신약 개발에 대한 응용.
ALS 신약 개발을 위한 TDP-43 ΔNLS (rNLS8) 마우스
이 자료는 임상 전 치료 연구를 위한 ΔNLS(deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) TDP-43 ALS 유전자 변형 마우스 모델의 사용에 대한 정보를 제공합니다.