ALSのマウスモデルは、ヒトの疾患で観察される脊髄運動ニューロンの病理を再現しているのでしょうか?
ALSの有用な動物モデルの重要な特徴は、ヒトの疾患の複数の側面を再現し、容易に測定できることです(「ALSの薬剤開発のためのマウスモデル」を参照)。運動ニューロンの損失と軸索、樹状突起およびシナプスの変性は、ALSの主な特徴です(Salzinger, 2024)。運動ニューロンの変性は、骨格筋の衰弱と消耗、最終的には死につながり、通常は呼吸不全が原因です(Hardiman, 2011)。家族性ALSは症例の約10%を占め、最も一般的な変異はC9ORF72 、SOD1、FUS、TARDBP遺伝子で発生しています(Hardiman、2017)。TARDBP遺伝子で観察される変異はまれ(1%未満)ですが、TARDBP遺伝子によってコードされるタンパク質(TDP-43)は、ALS患者の約97%で細胞質凝集体を形成します(Shatunov, 2021)。そのため、これらの遺伝子やその他の遺伝子に基づいて、遺伝子組み換え動物モデルのALSが開発されています。
ALSのヒト疾患の神経運動学的特徴を再現するマウスモデルの例として、hTDP-43ΔNLS (rNLS8) トランスジェニックマウスモデル(Walker, 2015)があります(ALS治療薬開発のためのTDP-43ΔNLS (rNLS8) マウスを参照)。これらのマウスは、核局在シグナル(NLS)に欠陥のあるヒトTDP-43を過剰発現しており、その結果、局在異常(核内TDP-43発現レベルの低下)と細胞質凝集体の形成が起こります。脊髄運動ニューロンに関しては、このマウスモデルでは、ヒトのALSで見られるような、速筋疲労性(FF)運動ニューロンの損失と遅筋運動ニューロンの相対的な温存、および神経筋接合部(NMJ)の脱神経と再神経の証拠が示されています(Spiller, 2016;Hur, 2022)。
脊髄運動ニューロンの関与を評価するために、どのような生体内測定法が使用できるでしょうか?
前臨床治療効果研究のインライフ段階において、脊髄運動ニューロンへの疾患進行の影響を評価できる能力は、非常に大きな利点があります。脊髄の直接的な視覚化や関連する定量的画像測定、標的筋肉の脱神経による下流測定など、いくつかのアプローチが利用可能です。
生体内脊髄イメージング
生体内磁気共鳴画像法(MRI)などの非侵襲的イメージングでは、脊髄運動ニューロンの状態を反映する定量的測定が可能です。Grolez ら(Grolez, 2018)は、SOD186R トランスジェニックマウスにおいて、頸部脊髄の厚さが徐々に減少することを示しました。Marcuzzo ら(Marcuzzo, 2017 )は、G93A-SOD1 マウスにおける縦断的in vivo拡散テンソル画像(DTI)により、脊髄の白質および灰白質における時間依存性の変化を発見しました。Figini ら(Figini, 2016 )は、G93A-SOD1 マウスと野生型マウスの脊髄の違いを確実に検出できるように DTI パラメータを最適化しました。Gatto 氏らは(Gatto, 2018)、YFP,G93A-SOD1 マウスでin vivoDTI を実施し、生後80日(P80)の動物において、異方性度(FA)、軸方向拡散(AD)、放射状拡散(RD)に有意な変化があることを発見しました。G93A-SOD1マウスと対照マウスの生体内画像におけるこれらの違いは、軸索の蛍光強度と細胞膜マーカーの変化と相関していました。Underwood 氏ら(Underwood, 2011)は拡散テンソル画像(DTI)によって生体内での軸索損傷を検出できることを発見しました。G93A-SOD1マウスの腰椎脊髄の前角白質線維において、FA値が野生型同腹仔と比較して特異的に減少しており、この効果は病気の進行とともに顕著になり、病気の重症度と相関していました。減少したFA値は、運動ニューロンから生じる白質線維に限られており、感覚白質線維は保たれていました。さらに、軸方向および半径方向の拡散性の著しい変化は、電子顕微鏡(EM)で測定した軸索変性と関連していました。
非侵襲的筋萎縮イメージング
マウスモデルでは困難な場合がある脊髄自体の拡散特性の評価に代わる方法として、軸索変性/脊髄運動ニューロン損失による脱神経に起因する筋萎縮を非侵襲的イメージングで測定する方法は、より容易であり、臨床応用が可能です。臨床的な観点では、ウィルコックス氏ら(Wilcox, 2021)は、体積MRIが筋機能の臨床評価における再現性、時間的反応性、相関性を示すことを示し、体積MRIが筋再支配の潜在的な結果測定法となり得る可能性を示唆しました。Jenkins 氏とその同僚(Jenkins, 2013;Jenkins, 2018)は、MRI を使用して ALS における筋肉の体積変化やその他の画像パラメータ(T2 信号など)を測定しています。このグループはパイロット研究において、臨床的筋力低下が進行した ALS 患者の特定の筋肉で、進行性の筋肉体積減少を発見しました(Jenkins, 2013)。Klickovic ら(Klickovic, 2024)は、最長観察期間において、利き手および頭部と首の筋肉の容積、ならびに下肢の断面積(CSA)が著しく減少したことを報告しています。
MRIやCTなどのモダリティを使用した動物モデルにおける筋萎縮の縦断的、生体内測定は可能です。Marcuzzo氏とその共同研究者(Marcuzzo, 2011)は、G93A-SOD1マウスにおける縦断的定量的MRI分析を行い、生後8週目から後肢の筋肉量が著しく減少することを実証しました。Pasetto ら (Pasetto, 2018)およびvan der Heyden ら(van der Heyden, 2020)は、MRI の代替法として、マウスの後肢下部のマイクロCT測定の実現可能性を報告しています。
当社のBiospectiveチームでは、ALSのTDP-43モデルにおける筋萎縮の評価に前臨床マイクロCTイメージングを活用しています。TDP-43 ΔNLS (rNLS) マウスの後肢の低解像度画像を短時間で取得することができました。下の図は、私たちの「ロー・ドックス」マウスモデルにおける疾患誘発から10週間後のベースラインに対する筋肉容積の変化率を示しています。
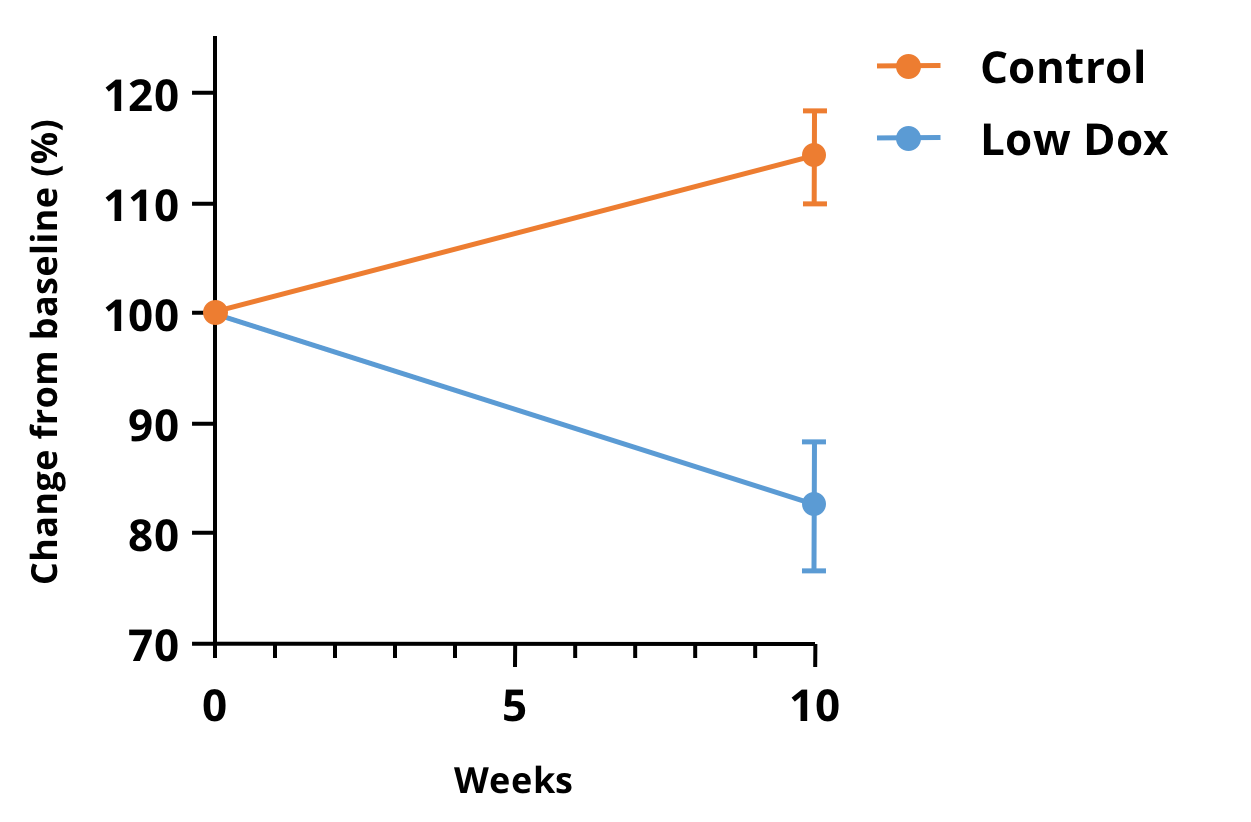
「低Dox」hTDP-43ΔNLSマウスモデルにおける、マイクロCT画像から得られた後肢下部筋肉の容積の変化率。10週間にわたるコントロール(tTA)マウスとロー・ドックスマウスとの間には、非常に有意な差(p <0.0001)が認められ、このモデルにおける治療効果の研究における生体内での測定値として魅力的です。
神経筋電気生理学
電気生理学(例えば筋電図検査[EMG])は、ALS患者の診断および病状のモニタリングに用いられる標準的な検査です。この技術は、神経筋機能の状態を評価するために、ALSの動物モデルにも適用することができます。
Spiller ら(Spiller, 2016)は、高用量のドキシサイクリン食を数週間摂取していない(遺伝子導入発現を可能にするため)非遺伝子導入(nTg)および rNLS8 マウスの坐骨神経を刺激した後の腓腹筋における誘発複合筋活動電位(CMAP)振幅を測定しました。このグループは、hTDP-43ΔNLSの発現によりCMAP測定値が著しく減少することを発見しました。
Biospectiveの私たちのグループは、rNLS8モデルの「低ドキシサイクリン」バージョンを使用して同様の研究を行いました。「オフ・ドキシサイクリン」モデルでの観察結果と一致して、「低ドキシサイクリン」モデルでもCMAP振幅の統計的に非常に有意な減少が認められました。この試験は複数の時点で行うことができ、このモデルにおける実験的治療薬の効果を評価するのに適しています。さらに、CMAPの評価は、マイクロCT画像に基づく筋萎縮の測定を補完し、治療介入による疾患の進行と潜在的な疾患修飾の機能として、構造的および機能的神経筋変化の包括的な全体像を提供します。
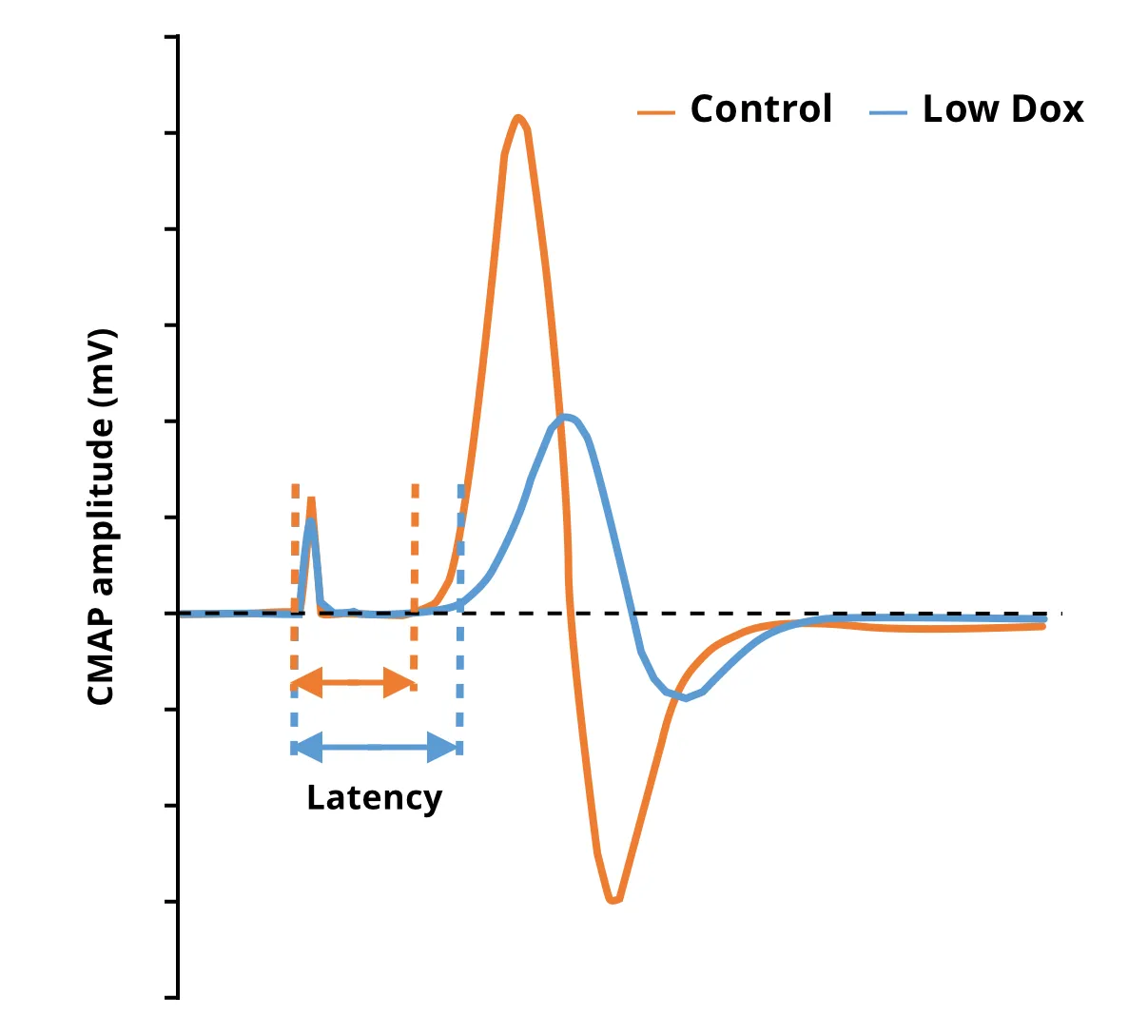
コントロールマウスと比較したLow Dox hTDP-43ΔNLSマウスにおけるCMAP振幅の減少と待ち時間の増加を示す個々のトレース。
また、CMAPは、変異型SOD1マウスおよびラットALSモデルにおける運動系機能の評価にも使用されています。例えば、SOD1G93Aマウスでは、CMAPは時間とともに低下します(Mancuso, 2011;Mancuso, 2014)。McCampbell ら(McCampbell, 2018)は、5週齢時にアンチセンスオリゴヌクレオチド(ASO)を投与したSOD1G93Aマウスでは、その後の12週間でCMAPが維持された一方で、対照マウスのCMAPは同じ期間で半分以下に減少したことを示しました。
ALSモデルにおける脊髄運動ニューロンの関与は、組織切片でどのように評価できますか?
脊髄運動ニューロン(細胞体および突起)の直接的な可視化、特性評価、定量化は、免疫組織化学(IHC)および免疫蛍光(IF)法を用いて死後組織切片で実施することができます。多重免疫蛍光(mIF)法は、複数のマーカーを同一の組織切片で評価でき、特定のマーカーの共局在を評価できるため、特に有用です。組織切片上の脊髄運動ニューロンを画像化する一つの方法として、レポーター遺伝子(例えば、GFP、mCherry)を発現する蛍光分子(コレラ毒素Bサブユニット、Alexa Fluor® 594 結合体;CTB-594)またはベクター(AAV9)である逆行性トレーサーを注入して神経細胞の追跡を行う方法があります。 また、脊髄運動ニューロンによって発現される抗原を免疫染色することもできます。一般的な標的としては、コリンアセチルトランスフェラーゼ(ChAT)、アセチルコリン輸送体(VAChT)、マトリックスメタロプロテアーゼ-9(MMP-9)、およびタイプ3小コンダクタンスカルシウム活性化カリウムチャネル(SK3)などがあります。
デジタル化された組織切片から、さまざまな定量的測定値を導き出すことができます。ChATまたはVAChTで染色した組織を使用して、細胞体および軸索の数とサイズを測定することができます。一方、VAChTまたは他のマーカー(例:SV2)で染色することにより、終末を定量化することができます。MMP-9およびSK3は、それぞれ速い運動ニューロンおよび遅い運動ニューロンを評価するために使用することができます。高度な画像処理方法を用いれば、染色した組織切片の画像から、細胞体表面積やさまざまな樹状突起特性(例えば、総分枝長、平均樹長、最大樹状突起到達距離、樹状突起の複雑性)などの形態学的測定値も取得できます(Fogarty, 2020)。
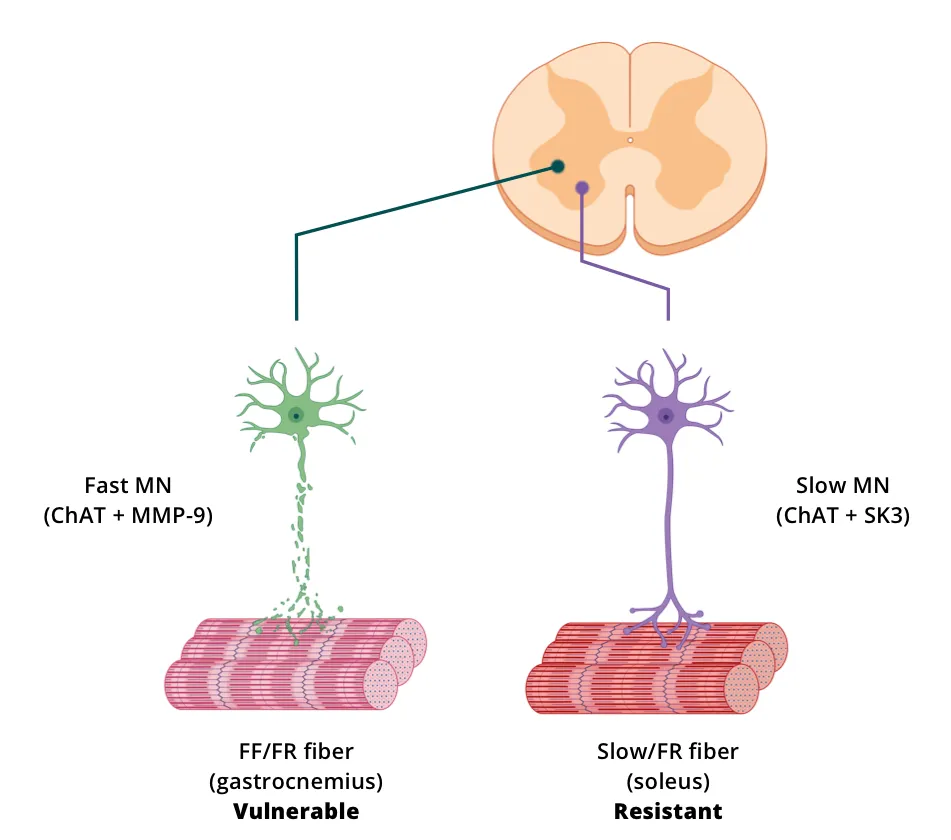
動物モデルにおける脊髄運動ニューロン標識化の戦略の図解(図はHur, 2022より、クリエイティブ・コモンズ表示ライセンスに基づき転載・改変)。
Spiller ら(Spiller, 2016)は、hTDP-43ΔNLS マウスの脊髄において、VAChT IF を用いて運動ニューロン数と細胞体サイズを測定し、VAChT と MMP-9 の共局在化により高速運動ニューロン数を測定しました。このグループは、rNLS8マウスの脊髄では、「遅筋運動ニューロン」が末期まで生き残った一方で、「疲労しやすい速筋運動ニューロン」が失われたと報告しています。また、軸索の退縮は速筋線維から最初に起こり、遅筋線維は神経支配されたままであったことも示しています。遺伝子抑制の後、耐性のある運動ニューロンは、以前に神経支配が失われた神経筋接合(NMJ)を再び神経支配するために、側枝を発生させました。運動ニューロンの選択的な脆弱性/耐性は、線維タイプの分布に基づいて、さまざまな筋肉群の萎縮や電気生理学的な違いをもたらす可能性があります。例えば、腓腹筋の浅層は主にタイプII(速筋線維)で構成されているのに対し、ヒラメ筋は主にタイプI(遅筋線維)で構成されています(Rosser, 1992)。
TDP-43 ΔNLS ALS マウスモデルに関するご質問や、治療効果研究で使用するモデルに関する特定の情報提供など、どのようなご質問にも喜んでお答えいたします。
ALSモデルについてさらに詳しく知る
関連コンテンツ
筋萎縮性側索硬化症に関する最新情報と、ALS動物モデルにおける治療薬の評価に関するベストプラクティス。
オートファジーと神経変性疾患
細胞性オートファジーが脳の健康と神経変性において果たす役割についての概要。
神経筋接合部(NMJ)の形態と筋萎縮性側索硬化症(ALS)モデル
神経筋接合部(NMJ)の構造、筋萎縮性側索硬化症(ALS)におけるその役割、NMJの形態学的変化の研究に使用されるツールと方法についての洞察。
ALSマウスモデルを用いた創薬
治療薬の前臨床試験における筋萎縮性側索硬化症(ALS)の研究用動物モデル(マウスおよびラットモデル)の最も効果的な使用方法についてのガイド。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。
TDP-43 ΔNLS (rNLS8) ALS 治療薬開発用マウス
このリソースは、ALSのΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43トランスジェニックマウスモデルの使用に関する情報を提供しており、前臨床治療研究に役立てることができます。