このリソースでは、以下について説明しています。
なぜミクログリアの形態を数値化するのでしょうか?
ミクログリアは、筋萎縮性側索硬化症(ALS)、アルツハイマー病(AD)、パーキンソン病(PD)など、多くの神経変性疾患において重要な役割を果たしています(Salter, 2017;Hickman, 2018)。神経変性疾患の治療薬候補の多くは、ミクログリアを標的としており、例えば、その表現型を調節したり、Aβプラークの除去を促進したりしています(Gao, 2023)。単一細胞「オミックス」技術によって示されているように、ミクログリアは非常に動的な細胞であり、さまざまな表現型をとることができます。最近、約100人の科学者が共著者として執筆した論文(Paolicelli, 2022)では、これらの表現型の用語を明確にし、コンセンサスを構築することを目的として、ホメオスタシスシグネチャー、白質関連ミクログリア、疾患関連ミクログリア(DAM)などの用語が使用されています。
また、反応性状態にあるミクログリアは、劇的な形態変化を示します。本リソースでは、一般的に定量化される形態学的表現型に焦点を当てます(Savage, 2020)。恒常性維持状態にあるミクログリアは、一般的に、細長く伸びた突起が特徴の分枝状の形態を示します。肥大性ミクログリアは、反応性状態と関連することが多く、細胞体は肥大し、突起は短く太く、より分枝状になります。アメーバ様ミクログリアは細胞体が肥大化し、突起がほとんどないため、形態的にはマクロファージと類似しています。異栄養性ミクログリアは、突起が球状に膨らんだビーズ状の特徴があり、断片化して見えることもあります。 最後に、ロッド細胞は 単一方向に高度に伸長し 、放射状の突起は最小限です。機能的表現型と独特な形態は、ミクログリアの2つの補完的な特徴ですが、形態変化(分岐)と機能(サイトカイン放出)の間のメカニズム的な関連性が確認されています(Madry, 2018)。さらに、形態学的測定基準は、個々のミクログリアにおける機能的マーカーと相関していることが分かっています(Kozlowski, 2012;Fernández-Arjona, 2019)。
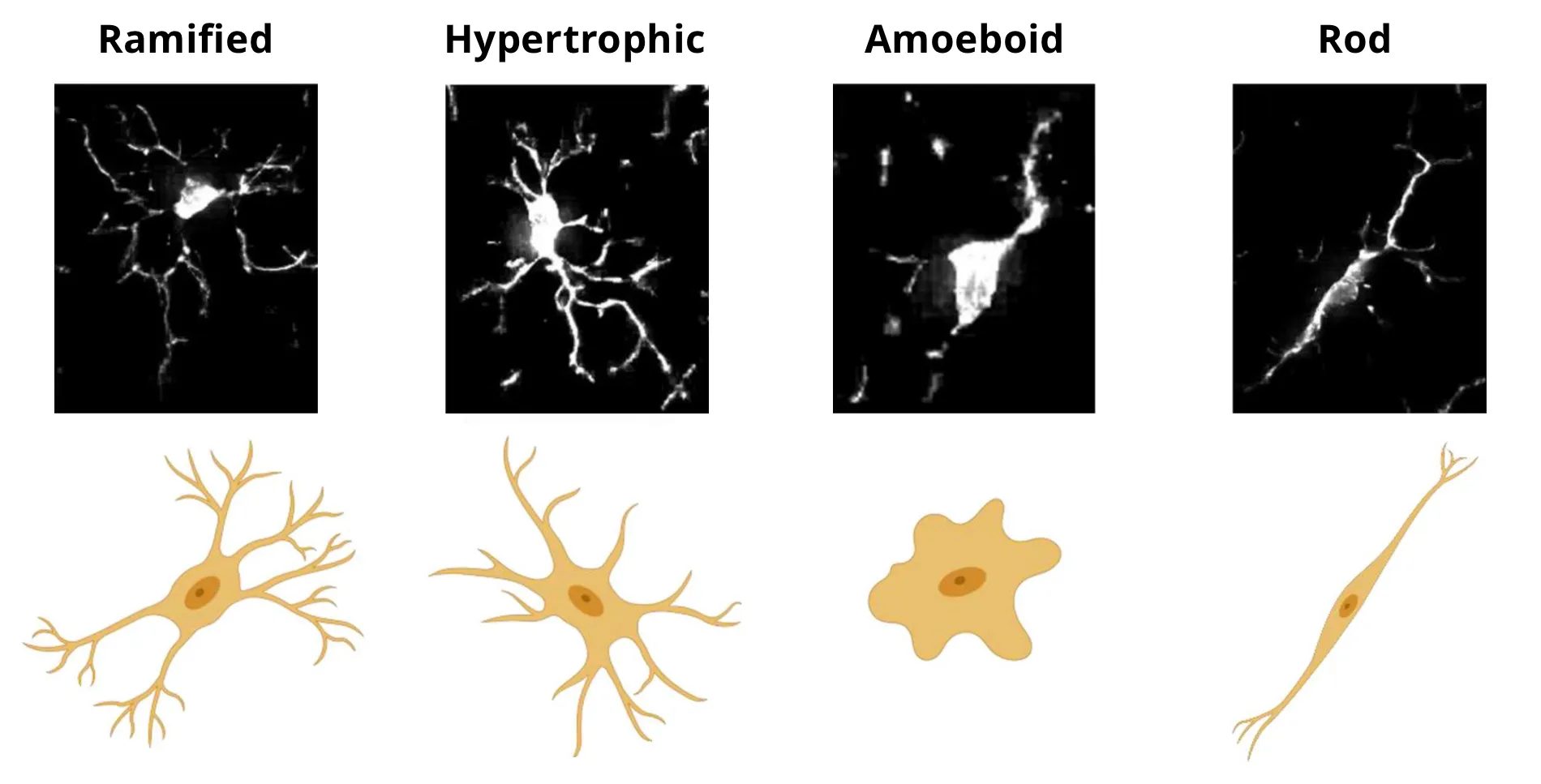
ミクログリアの4つの選択された形態の顕微鏡画像の例と模式図。図は、(Savage, 2019)の定義に基づく形態を(Reddaway, 2023)から複製・改変したもので、クリエイティブ・コモンズ・ライセンスに基づき使用しています。
組織切片におけるミクログリアの形態を定量化するにはどうすればよいでしょうか?
実験条件:染色、切片の厚さ、および顕微鏡
マイクログリアの形態を定量化するには、その突起と細胞体(体部)の両方に特異的で高感度であり、かつあらゆる表現型で発現する(通常は Iba-1)染色剤でマイクログリアを標識する必要があります。 最大 150 μm の厚い組織切片は、共焦点顕微鏡を使用して z 軸方向に画像化することで、マイクログリアの形態を完全に 3D で特徴づけることができます。2Dでのハイスループット定量分析には、より薄い切片(5-20μm)をデジタルスライドスキャナー(Franco-Bocanegra, 2021;Leyh, 2021)で画像化することができます。スループットと3D画像化のトレードオフは、研究の目的によって異なります。例えば、高スループットの2Dイメージングは、前臨床治療効果研究に適しており、数百万の細胞にまで拡大することができます。反応条件下で常に変化する細胞体サイズなどの単純な測定基準(Kozlowski, 2012;Verdonk, 2016;Davis, 2017;Fletcher, 2020;Silburt, 2022)は、2Dで正確に定量化することができます。例えば、細胞体形態のみに焦点を当てたある研究では、老齢マウスの網膜において、分枝状から肥大性のミクログリアへの変化が認められました(Choi, 2022)。
形態の定量化の手順
ほとんどのアプローチに共通する自動定量化に必要な手順は、以下の図に示されています。 さまざまなアプローチは、Reddaway らによってレビューされています(Reddaway, 2023)。まず、ミクログリアを個別に検出し、分離する必要があります。これは、コンピュータビジョンにおける物体検出タスクです。各細胞の細胞体と細胞質を背景から分離します。プロセスの骨格はアルゴリズムによって取得されます。最後に、細胞面積、周囲長、細胞体面積、骨格の枝数など、異なる形態学的測定値(すなわち形態計測学)が各細胞で測定されます。
ミクログリアの形態分析プロセスの概略図。ミクログリアは免疫組織化学(ここではIba-1で染色)または免疫蛍光組織切片で特定されます。特定された各細胞について、細胞体と突起がセグメント化され、突起の骨格が取得されます。その後、細胞体や細胞体サイズなど、多くの形態学的測定基準が取得されます。その後、オプションとして、機械学習モデルを使用して細胞を特定の形態として分類することができます。図の例では、青いボックスは分枝した形態を表し、赤いボックスは分枝していない形態を表しています。その後、細胞に関するさまざまな統計情報を関心領域(ROI)、被験者(動物など)、グループごとに集計することができます。形態測定の概略図は、クリエイティブ・コモンズ表示ライセンスに基づき、(Leyh, 2021) より複製・改変しています。
グループ間の定量分析
細胞形態計測値は、関心領域(ROI)、動物、グループごとに集計されます。 グループを比較するには、主に以下の3つのアプローチがあります。
1.グループの形態計測分布を比較します。最も単純なアプローチ は、グループ間で体細胞サイズなどの特定の測定値の分布を比較することです。 例 :(Kozlowski, 2012; Heindl, 2018)。
2.異なるクラスターにわたる細胞の分布を比較します。 機械学習の手法により、類似した形態の細胞のクラスターを特定することができます。 これらのクラスターにわたる細胞の分布を、次にグループ間で比較することができます。 例: (Fernández-Arjona, 2017; Heindl, 2018; Salamanca, 2019).
3.分類された形態における細胞の分布を比較します。機械学習モデルは、ユーザーが指定した形態(例えば、分枝状、肥大性、アメーバ状など)を認識するように訓練することができます。次に、これらの形態を持つ細胞の分布と数をグループ間で比較することができます。例: (Leyh, 2021; Choi, 2022).
神経変性疾患において、ミクログリアの形態にどのような変化が観察されているのでしょうか?
ここでは、ALS、AD、PDという3つの神経変性疾患における共通の知見に焦点を当てます。
筋萎縮性側索硬化症(ALS)
3種類の異なるALSのマウスモデルにおいて、ミクログリアの形態変化が観察されています。 SOD1-G93Aモデルでは、病気の進行に伴い、肥大に似た形態(より大きな細胞体、より短い突起)への進行的な変化が観察されています(Ohgomori, 2016)。誘導性hTDP43ΔNLSモデルでは、病態TDP-43の発現が停止された後の疾患「回復」中に、同様の変化が観察されました(Spiller, 2018)。C9orf72モデル(GAリピート)では、ミクログリアの数の増加と肥大化への変化が観察されました。この影響は、マウスにGA-repeatsを免疫するとほぼ解消されました(Zhou, 2020)。Biospectiveでは、TDP-43 ΔNLSマウスモデルを使用して、「オフDox」および「低Dox」モデルの両方で形態学的変化を発見しました。非分枝ミクログリアの密度は、臨床複合運動スコアと高い相関関係がありました。
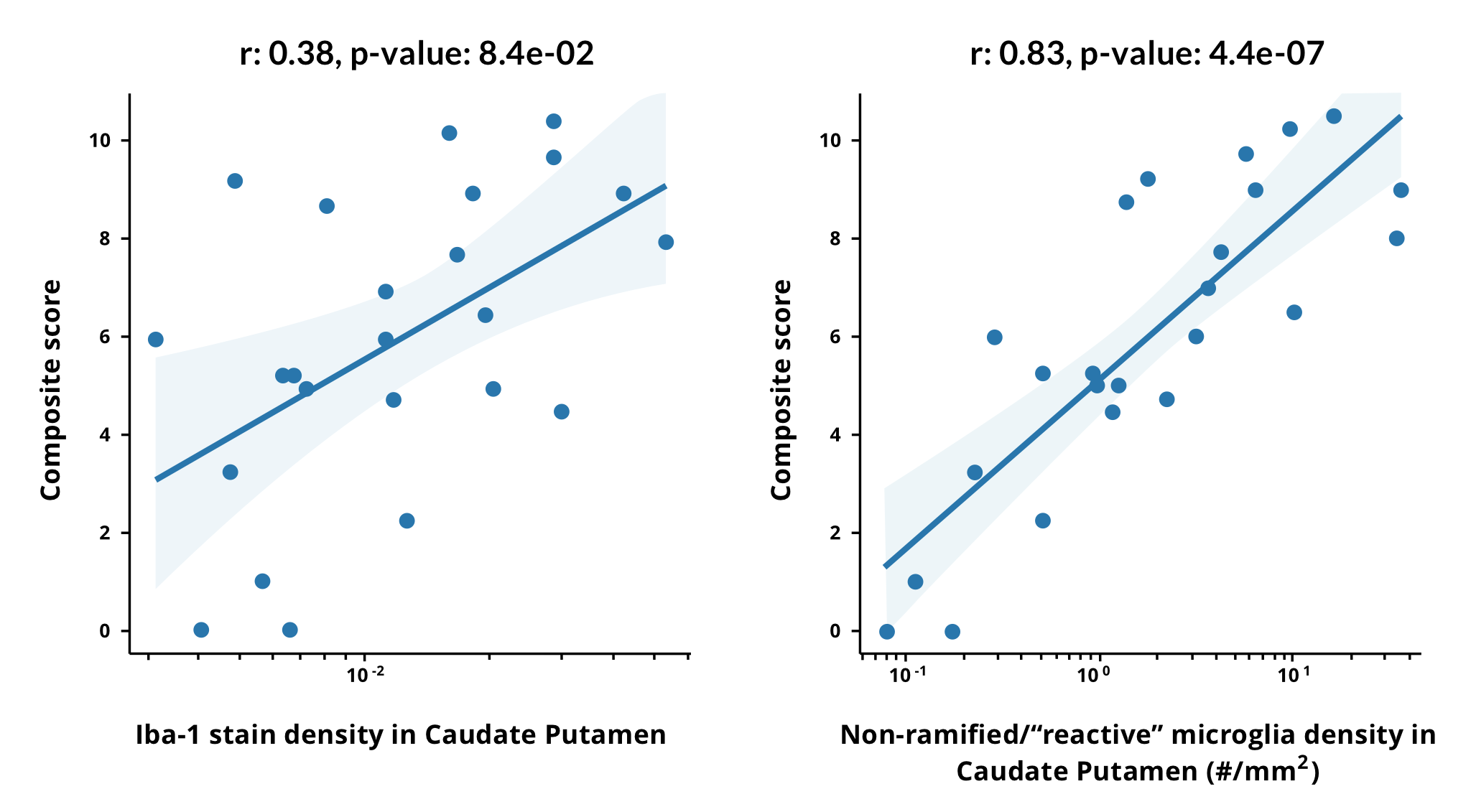
マウスのTDP-43 ΔNLSモデルにおけるミクログリアの形態学的変化は、臨床運動スコアと高い相関関係があります。複合運動スコアは、異なる重症度レベルのグループにおける線条体(CP)のIba-1染色密度(セグメント化されたピクセルの割合、左)と非分枝(「反応性」)形態のミクログリア密度(右)の関数として示されています。x軸の対数に線形近似した結果を示しています。ピアソンの相関係数は、Iba-1染色密度では0.38から、非分枝型ミクログリア密度では0.83まで増加しています。線形近似には、異なる疾患重症度グループが示されています。「オン・ドックス(コントロール)」、「4週間低ドックス」、「6週間低ドックス」、「3週間オフ・ドックス」などです。4つのROI(尾状核被殻、運動皮質、非運動皮質、および皮質脊髄路)における非分枝微小血管の対数密度を組み合わせた線形近似の結果、相関係数は0.93±0.06(5重交差検証の標準偏差から得られた範囲)となりました。
アルツハイマー病
ヒト組織の研究では、一般的に、ADと年齢をマッチさせた対照群のミクログリアの総数に有意な変化は見られませんでした(Davies, 2017;Heindl, 2018;Paasila, 2019;Martini, 2020;Franco-Bocanegra, 2021)。しかし、ホメオスタシスを維持する分枝形態からの変化が観察されています。ジストロフィー性形態を持つミクログリアの数の増加が報告されています(Bachstetter, 2015;Davies, 2017;Martini, 2020)。総突起長などの複数の形態学的測定基準が、Aβおよび/またはタウ病理学的負荷と相関することが分かっています(Heindl, 2018;Paasila, 2019;Franco-Bocanegra, 2021)。興味深いことに、Franco-Bocanegra ら(Franco-Bocanegra, 2021)は治療効果を観察しました。すなわち、Aβ42に対して免疫した患者では、治療を受けていないアルツハイマー病患者や健常者と比較して、分枝形態を持つミクログリアの割合が増加していました。我々の研究では、APP/PS1マウスモデルのアルツハイマー病において、ベータアミロイド斑の近傍に高度に局在するミクログリアの形態変化が認められ、Iba-1染色密度よりも病気の進行を評価する上で感度が高いことが分かりました。
パーキンソン病とシヌクレオパチー
ラットおよびマーモセットのパーキンソン病モデルでは、分枝形態から肥大およびアメーバ状形態への変化が観察されています(Sanchez-Guajardo, 2010;Barkholt, 2012)。同様に、多系統萎縮症(MSA;PLP-α-シヌクレイン)のマウスモデルでも、ミクログリアの総数が増加することなく、分枝形態から肥大形態への変化が観察されています(Refolo, 2018)。PDのラットモデルでは、治療効果が見られました。すなわち、肥厚形態への移行に典型的な変化(細胞体のサイズや密度の増加など)がレボドパを投与したラットの線条体で観察されましたが、生理食塩水を投与したラットでは観察されませんでした(Fletcher, 2020)。Biospective社のパーキンソン病モデルマウス(M83ヘミ接合体マウスの前嗅覚核へのヒト前駆線維の注入)を使用したところ、総ミクログリアの増加と肥大形態への変化が認められ、これらは病気の進行と相関していました。非分枝ミクログリアの密度は、Iba-1染色密度よりも病状をより敏感に反映する指標でした。
ALS、アルツハイマー病、パーキンソン病におけるミクログリアの形態に関するご質問や、治療効果研究で使用するモデルに関する具体的な情報など、どのようなご質問にも喜んでお答えいたします。
神経変性疾患モデルについてさらに詳しく知る
関連コンテンツ
神経変性疾患に関する最新情報と、神経変性疾患モデルにおける治療薬の評価に関するベストプラクティス。
ミクログリアとニューロンの相互作用と神経変性疾患
ミクログリアとニューロンの直接的な相互作用、およびこれらの細胞間相互作用が神経変性疾患においてどのように影響を受けるかについて簡潔にレビューします。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。
ミクログリアの老化と神経変性疾患
本リソースでは、アルツハイマー病(AD)やパーキンソン病(PD)などの神経変性疾患におけるミクログリアの老化とその役割について概説します。
オートファジー、パーキンソン病、ドーパミン作動性ニューロン
パーキンソン病における障害のあるオートファジーが、ドーパミン作動性ニューロンにおける病理学的変化と神経変性につながる仕組みの概要。
オートファジーと神経変性疾患
細胞性オートファジーが脳の健康と神経変性において果たす役割についての概要。
神経筋接合部(NMJ)の形態と筋萎縮性側索硬化症(ALS)モデル
神経筋接合部(NMJ)の構造、筋萎縮性側索硬化症(ALS)におけるその役割、NMJの形態学的変化の研究に使用されるツールと方法についての洞察。
アルツハイマー病におけるアストロサイトの形態
アストロサイトの形態解析の概要と、神経変性疾患の研究および創薬・薬剤開発への応用。
ALSマウスモデルと脊髄運動ニューロン
筋萎縮性側索硬化症(ALS)のマウスモデルにおける脊髄運動ニューロンと疾患進行の関わりについての概要。
アルツハイマー病におけるアミロイドβプラーク分析
ヒトおよびアルツハイマー病動物モデル(トランスジェニックマウスおよびラット)の脳組織切片におけるAβプラークの分類および定量化方法の概要。
TDP-43 ΔNLS (rNLS8) ALS 治療薬開発用マウス
このリソースは、ALSのΔNLS(deltaNLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、dNLS、TDP43 NLS、rNLS8)TDP-43トランスジェニックマウスモデルの使用に関する情報を提供しており、前臨床治療研究に役立てることができます。