Pourquoi quantifier la morphologie de la microglie?
La microglie joue un rôle crucial dans de nombreuses maladies neurodégénératives, notamment la sclérose latérale amyotrophique (SLA), la maladie d'Alzheimer (MA) et la maladie de Parkinson (MP) (Salter, 2017; Hickman, 2018). De nombreuses thérapeutiques potentielles pour les maladies neurodégénératives ciblent la microglie, par exemple en modulant leur phénotype ou en favorisant la clairance des plaques Aβ (Gao, 2023).
La microglie est une cellule très dynamique, capable d'adopter différents phénotypes, comme le démontrent les technologies 'omiques' à cellule unique. Récemment, une centaine de scientifiques ont cosigné une publication (Paolicelli, 2022) visant à clarifier et à établir un consensus autour de la terminologie de ces phénotypes, en utilisant des termes tels que signature homéostatique, microglie associée à la matière blanche et microglie associée à la maladie (DAM).
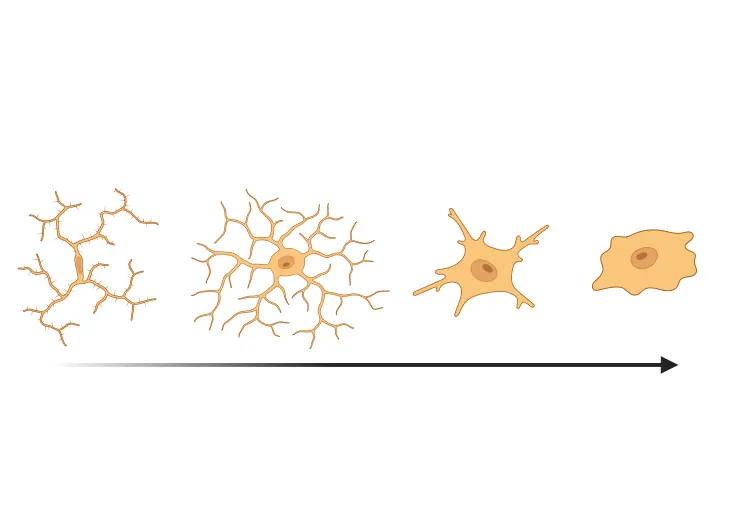
La microglie présente également des changements morphologiques drastiques dans des conditions réactives. Dans cette ressource, nous mettons en évidence les phénotypes morphologiques couramment quantifiés (Savage, 2020):
- La microglie ramifiée, typiquement associée aux conditions homéostatiques, la microglie présente typiquement une morphologie ramifiée caractérisée par des processus longs, fins et étendus.
- La microglie hypertrophique, typiquement associée aux conditions réactives, a un soma élargi avec des processus plus courts, plus épais et plus ramifiés.
- La microglie amiboïde a un soma élargi et est presque dépourvue de processus, ce qui la rend morphologiquement similaire aux macrophages.
- La microglie dystrophique présente des renflements perlés et sphériques de ses processus, qui peuvent apparaître fragmentés.
- Les cellules des bâtonnets sont très allongées, avec une orientation unique et des processus radiaux minimaux.
Alors que les phénotypes fonctionnels et les morphologies distinctes sont deux caractérisations complémentaires de la microglie, un lien mécaniste entre les changements morphologiques (ramification) et la fonction (libération de cytokines) a été identifié (Madry, 2018). En outre, il a été constaté que les métriques morphologiques étaient corrélées à des marqueurs fonctionnels dans des microglies individuelles (Kozlowski, 2012; Fernández-Arjona, 2019).
Pour plus d'informations sur le rôle des cytokines pro-inflammatoires dans les maladies neurodégénératives, voir: Interleukine-1 bêta (IL-1β) et maladies neurodégénératives & TNF-α & Microglia dans les maladies neurodégénératives
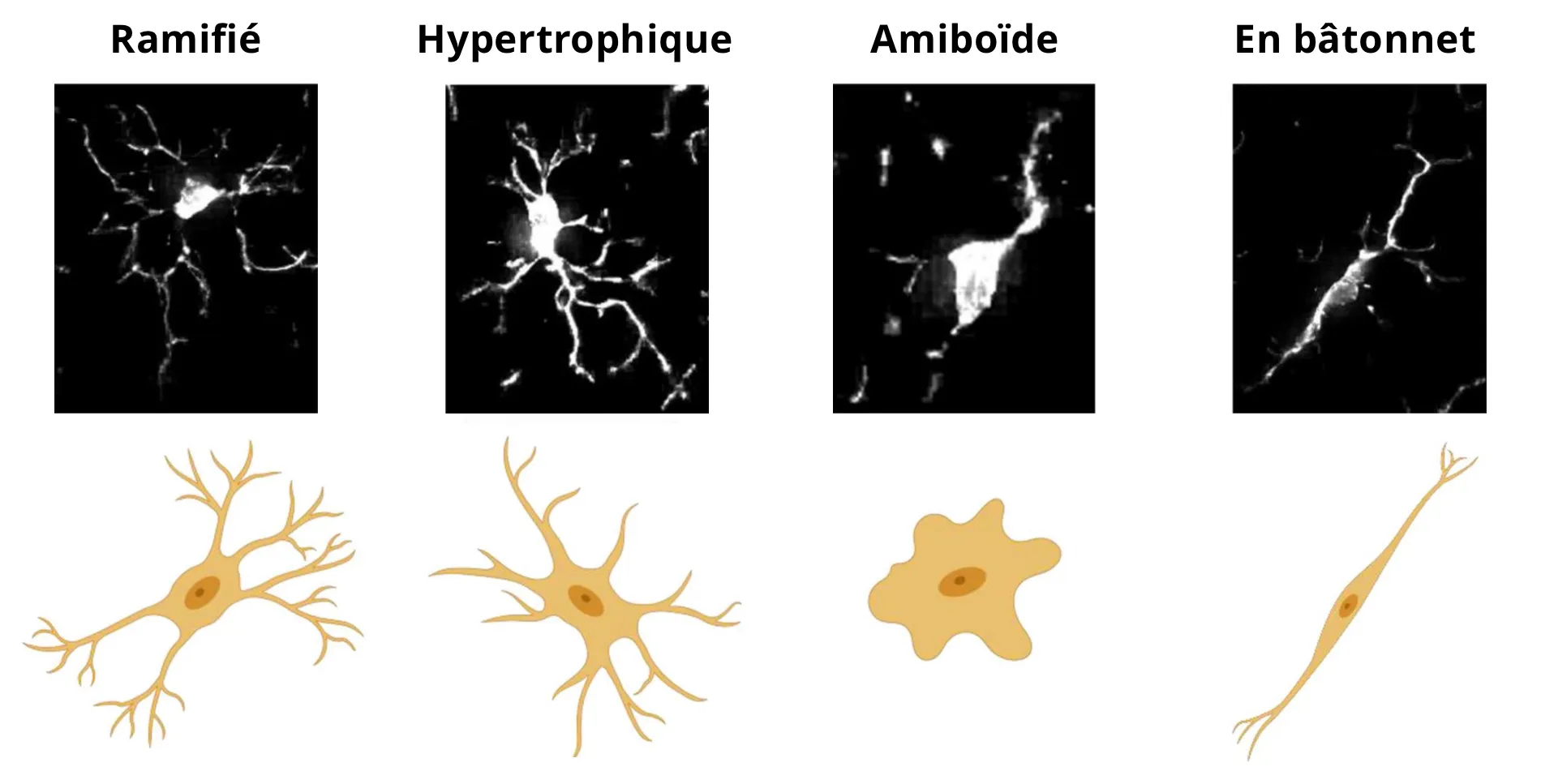
Images de microscopie et de représentations schématiques de quatre morphologies sélectionnées de la microglie. Figure reproduite et adaptée de (Reddaway, 2023), basée sur les définitions des morphologies de (Savage, 2019), sous la licence Creative Commons Attribution.
Chez Biospective, nous avons émis l'hypothèse que la quantification à haut débit de la morphologie microgliale pourrait améliorer la compréhension de leur état dans les études précliniques. Dans les modèles murins de la maladie d'Alzheimer, de la maladie de Parkinson et de la SLA, nous avons constaté que l'analyse de la morphologie microgliale fournissait une mesure plus sensible de l'état de la maladie que la simple mesure de la microgliose par la densité de la coloration Iba-1.
Comment quantifier la morphologie de la microglie dans les coupes de tissus?
Conditions expérimentales : Coloration, épaisseur de la coupe et microscopie
Pour quantifier la morphologie microgliale, les microglies doivent être marquées avec un colorant spécifique et sensible à la fois à leurs processus et à leur soma, et qui est exprimé dans tous les phénotypes (typiquement Iba-1). Des coupes de tissus épaisses allant jusqu'à 150 µm peuvent être imagées en z-stack en utilisant la microscopie confocale pour une caractérisation 3D complète de la morphologie de la microglie. Pour une quantification à haut débit en 2D, des sections plus fines (5-20 µm) peuvent être imagées à l'aide d'un scanner numérique (Franco-Bocanegra, 2021; Leyh, 2021). Le compromis entre le débit et l'imagerie 3D dépend de l'objectif de l'étude. Par exemple, l'imagerie 2D à haut débit convient aux études précliniques d'efficacité thérapeutique et peut s'étendre à des millions de cellules. Une mesure simple comme la taille du soma, qui change constamment dans des conditions réactives (Kozlowski, 2012; Verdonk, 2016; Davis, 2017; Fletcher, 2020; Silburt, 2022), peut être quantifiée avec précision en 2D. Par exemple, une étude s'est concentrée uniquement sur la morphologie du soma et a constaté un passage de la microglie ramifiée à la microglie hypertrophique dans la rétine de souris âgées (Choi, 2022).
Étapes de la quantification morphologique
Les étapes nécessaires à la quantification automatisée, communes à la plupart des approches, sont décrites dans la figure ci-dessous.
- La microglie doit être détectée et séparée individuellement (tâche de détection d'objet en vision par ordinateur).
- La cellule et le soma de chaque cellule sont segmentés à partir de l'arrière-plan.
- Le squelette des processus est obtenu de manière algorithmique.
- Différentes mesures morphologiques (i.e. morphométriques), telles que la surface de la cellule, le périmètre, la surface du soma, le nombre de branches dans le squelette, etc. sont mesurées dans chaque cellule.
Diverses approches ont été examinées par Reddaway et al. (Reddaway, 2023).
Représentation schématique du processus d'analyse de la morphologie de la microglie. Les microglies sont identifiées sur une coupe de tissu en immunohistochimie (ici colorée avec Iba-1) ou en immunofluorescence. Pour chaque cellule identifiée, le soma et les processus sont segmentés et le squelette des processus est obtenu. De nombreuses mesures morphologiques, telles que la taille de la cellule et du soma, sont alors obtenues. La cellule peut ensuite être classée dans une morphologie spécifique à l'aide d'un modèle d'apprentissage automatique. Dans l'exemple présenté, les cases bleues représentent la morphologie ramifiée et les cases rouges la morphologie non ramifiée. Différentes statistiques sur la cellule peuvent ensuite être agrégées par ROI, souris et groupe. Schéma de la métrique morphologique reproduit et adapté de (Leyh, 2021) sous la licence Creative Commons Attribution License).
Analyse quantitative entre les groupes
Enfin, les morphométries cellulaires sont agrégées par région d'intérêt (ROI), par animal et par groupe. Pour comparer les groupes, il existe trois approches principales:
1. Comparer la distribution morphométrique des groupes. L'approche la plus simple consiste à comparer la distribution d'une mesure particulière, telle que la taille du soma, entre les groupes. Exemples : (Kozlowski, 2012; Heindl, 2018).
2. Comparer la distribution des cellules dans des groupes distincts. Les méthodes d'apprentissage automatique peuvent identifier des groupes de cellules présentant des morphologies similaires. La distribution des cellules dans ces groupes peut ensuite être comparée entre les groupes. Exemples : (Fernández-Arjona, 2017; Heindl, 2018; Salamanca, 2019).
3. Comparer la distribution des cellules entre les morphologies classées. Les modèles d'apprentissage automatique peuvent être formés pour reconnaître les morphologies spécifiées par l'utilisateur (par exemple, ramifié, hypertrophique, amiboïde, etc.). La distribution et le nombre de cellules présentant ces morphologies peuvent ensuite être comparés d'un groupe à l'autre. Exemples: (Leyh, 2021; Choi, 2022).
Quelles modifications de la morphologie de la microglie ont été observées dans les maladies neurodégénératives?
Dans cette section, nous mettons en évidence les résultats communs à trois maladies neurodégénératives, à savoir la SLA, la MA et la MP.
Sclérose latérale amyotrophique (SLA)
Des modifications morphologiques de la microglie ont été observées dans trois modèles murins différents de SLA.
- Modèle SOD1G93A: une évolution progressive vers une morphologie proche de l'hypertrophie (corps cellulaire plus grand, processus plus courts) a été observée au cours de la progression de la maladie (Ohgomori, 2016).
- Modèle inductible hTDP43ΔNLS: un changement similaire a été observé pendant la " récupération " de la maladie après l'arrêt de l'expression de TDP-43 pathologique (Spiller, 2018).
- Modèle C9orf72 (GA-répétitions): une augmentation du nombre de microglies et une évolution vers l'hypertrophie ont été observées. Cet effet a été largement éliminé lorsque les souris ont été immunisées contre les GA-repeats (Zhou, 2020).
Chez Biospective, en utilisant le modèle de souris TDP-43 ΔNLS, nous avons constaté des changements morphologiques à la fois dans les modèles "Off Dox" et "Low Dox". La densité de microglies non ramifiées était fortement corrélée aux scores moteurs composites cliniques.
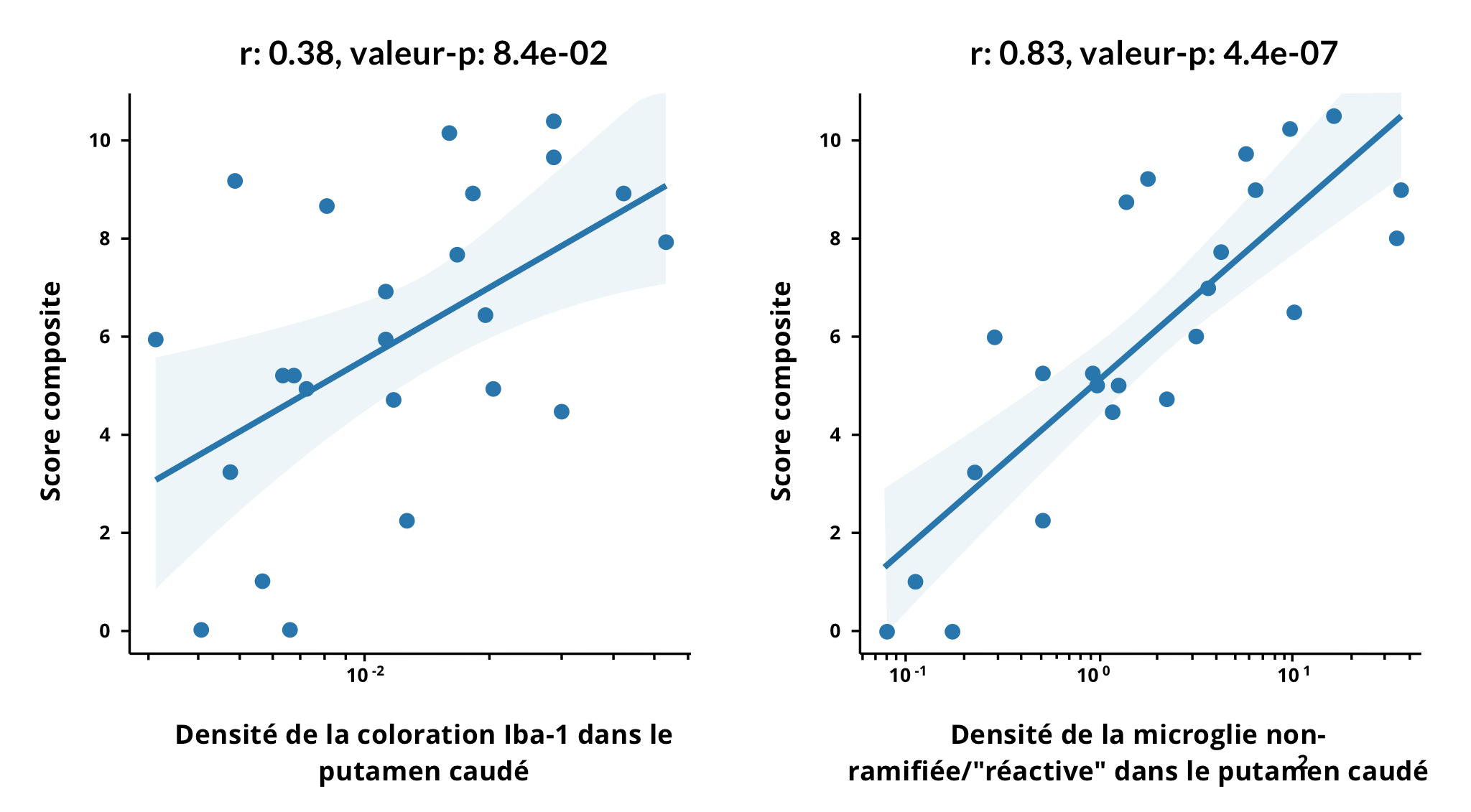
Les changements morphologiques de la microglie sont fortement corrélés avec le score moteur clinique dans un modèle de souris TDP-43 ΔNLS. Le score moteur composite est représenté en fonction de la densité de la coloration Iba-1 (fraction des pixels segmentés, à gauche) et de la densité de la microglie avec une morphologie non modifiée ("réactive") (à droite) dans le putamen caudé (CP) à travers les groupes de traitement. Un ajustement linéaire au logarithme de l'axe des x est présenté, et le coefficient de corrélation de Pearson passe de 0,38 avec la densité de la coloration Iba-1 à 0,83 pour la densité de la microglie non modifiée. Différents groupes de traitement sont représentés dans l'ajustement linéaire, tels que "On Dox", "4 semaines Low Dox", "6 semaines Low Dox" et "3 semaines Off Dox". Un ajustement linéaire combinant la densité logarithmique de la microglie non fragmentée dans quatre zones d'intérêt (CP, tractus corticospinal, cortex moteur et cortex non moteur) donne un coefficient de corrélation de 0,93 +/- 0,06 (plage obtenue à partir de l'écart type d'une validation croisée 5 fois).
La maladie d'Alzheimer
Les études menées sur des tissus humains n'ont généralement pas montré de changements significatifs dans le nombre total de microglies dans la maladie d'Alzheimer par rapport à un groupe témoin apparié en âge (Davies, 2017; Heindl, 2018; Paasila, 2019; Martini, 2020; Franco-Bocanegra, 2021). Cependant, un éloignement de la morphologie ramifiée homéostatique a été observé. Une augmentation du nombre de microglies présentant une morphologie dystrophique a été signalée (Bachstetter, 2015; Davies, 2017; Martini, 2020). De multiples métriques morphologiques, telles que la longueur totale du processus, se sont avérées corrélées à la charge pathologique Aβ et/ou tau (Heindl, 2018; Paasila, 2019; Franco-Bocanegra, 2021). De manière intéressante, Franco-Bocanegra et al. (Franco-Bocanegra, 2021) ont observé un effet de traitement - les patients immunisés contre Aβ42 présentaient une fraction accrue de microglies à morphologie ramifiée par rapport aux patients atteints de la maladie d'Alzheimer non traités et aux témoins sains.
Nos études sur un modèle rongeur APP/PS1 de la maladie d'Alzheimer ont révélé des changements morphologiques dans la microglie qui étaient fortement localisés à proximité des plaques Aβ et étaient plus sensibles que la densité de la coloration Iba-1 pour évaluer la progression de la maladie.
Maladie de Parkinson et synucléinopathies
Dans les modèles de la maladie de Parkinson chez le rat et le marmouset, un passage de la morphologie ramifiée à la forme hypertrophique et amiboïde a été observé (Sanchez-Guajardo, 2010; Barkholt, 2012). De même, dans un modèle murin d'atrophie du système multiple (MSA ; PLP-alpha-syn), un passage de la morphologie ramifiée à la morphologie hypertrophique a été observé sans augmentation du nombre total de microglies (Refolo, 2018). Un effet de traitement a été observé dans un modèle de PD chez le rat - des changements typiques d'une transition vers la morphologie hypertrophique (augmentation de la taille du soma, de la densité, etc.) ont été observés dans le striatum de rats traités à la lévodopa, mais pas chez les rats traités à la solution saline (Fletcher, 2020).
En utilisant le modèle rongeur de maladie de Parkinson de Biospective (injection de fibrilles préformées humaines dans le noyau olfactif antérieur de souris hémizygotes M83), nous avons constaté une augmentation du nombre total de microglies et une évolution vers une morphologie hypertrophique, en corrélation avec la progression de la maladie. La densité de la microglie non ramifiée était une mesure plus sensible de l'état de la maladie que la densité de la coloration Iba-1.
Notre équipe se fera un plaisir de répondre à vos questions sur la morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur les maladies neurodégénératives et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles de maladies neurodégénératives.
Interactions entre les microglies et les neurones et maladies neurodégénératives
Une revue concise des interactions directes entre les microglies et les neurones, et de la manière dont ces interactions intercellulaires peuvent être affectées dans les maladies neurodégénératives.
TNF-α et microglie dans les maladies neurodégénératives
Un aperçu de la fonction du facteur de nécrose tumorale alpha (TNF-α) dans la microglie et de sa contribution à la progression de la neurodégénérescence.
Sénescence microgliale et maladies neurodégénératives
Cette ressource fournit un aperçu de la sénescence microgliale et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA) et la maladie de Parkinson (MP).
Autophagie, maladie de Parkinson et neurones dopaminergiques
Une vue d'ensemble de la façon dont une autophagie déficiente peut conduire à des changements pathologiques et à la neurodégénérescence des neurones dopaminergiques dans la maladie de Parkinson.
Autophagie et maladies neurodégénératives
An overview of how cellular autophagy plays a role in brain health and neurodegeneration.
Morphologie de la jonction neuromusculaire (JNM) dans les modèles de SLA
Aperçu de la jonction neuromusculaire (JNM), de son rôle dans la sclérose latérale amyotrophique (SLA) et des outils et méthodes utilisés pour étudier les changements morphologiques dans les JNM.
Morphologie des astrocytes dans la maladie d'Alzheimer
Une vue d'ensemble de l'analyse morphologique des astrocytes et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Modèles de souris SLA et neurones moteurs spinaux
Aperçu de l'implication des motoneurones spinaux dans la progression de la maladie dans les modèles murins de sclérose latérale amyotrophique (SLA).
Analyse des plaques amyloïdes-β dans la maladie d'Alzheimer
Aperçu des méthodes de classification et de quantification des plaques Aβ dans les coupes de tissus cérébraux provenant d'humains et de modèles animaux de la maladie d'Alzheimer (souris et rats transgéniques).
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
Souris TDP-43 ΔNLS (rNLS8) pour le développement de médicaments contre la SLA
Cette ressource fournit des informations sur l'utilisation du modèle de souris transgénique TDP-43 ΔNLS (deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) de la SLA pour des études thérapeutiques précliniques.