このリソースでは、以下の内容について説明しています。
なぜアストロサイトの形態を数値化するのでしょうか?
アストロサイトはグリア細胞の一種で、脳細胞の約20~40%を占め、シナプス制御、脂質およびイオン恒常性、神経伝達物質の除去など、多くのプロセスにおいて重要な役割を果たしています(Baldwin, 2024 )。その突起の主枝は星のような形態を形成しており、これが名前の由来となっています。これらの主枝はさらに細かい枝に分かれ、シナプスと接触する小葉へと分かれます。アストロサイトの領域は、隣接する細胞間の重複がほとんどない状態で、中枢神経系全体を完全に覆っています。
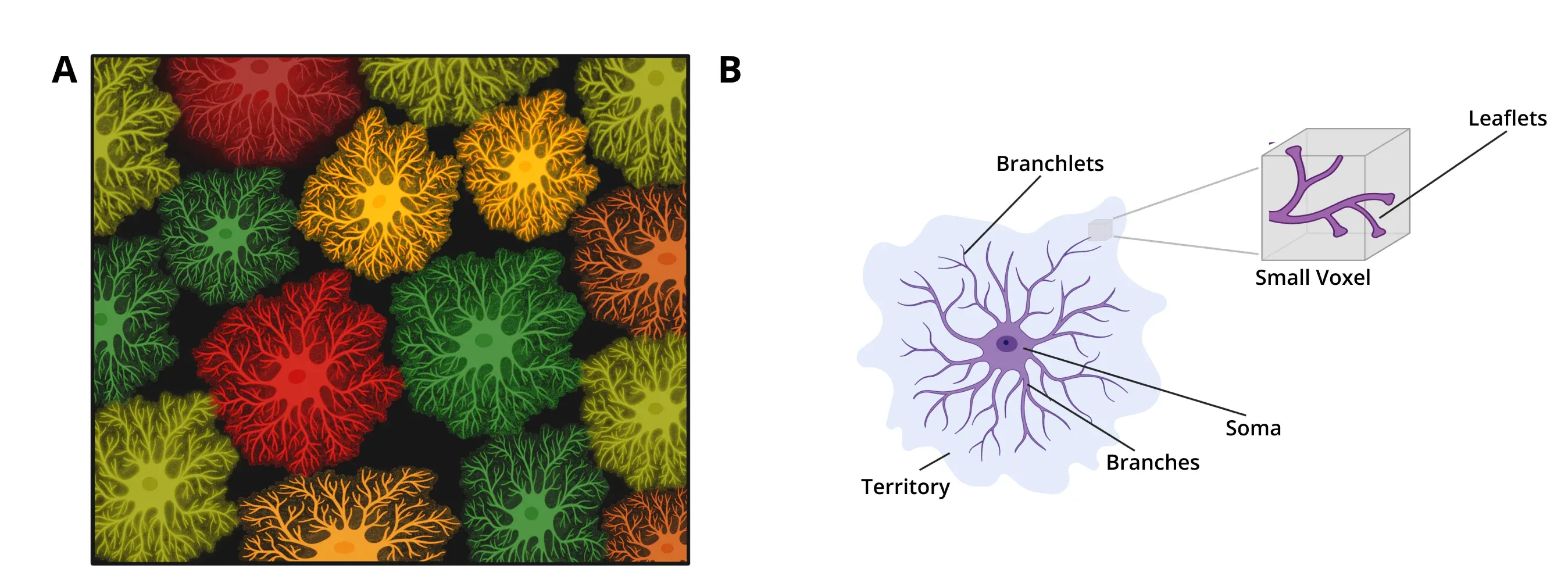
アストロサイトの形態。 (A) アストロサイトは中枢神経系全体を覆い、重複部分はほとんどなく、明確な三次元領域に分かれています。 (B) アストロサイトの形態を表す模式図。 突起は細胞体から主枝として発し、さらに分枝、小枝へと分かれます。 アストロサイトの突起の三次元的な全体範囲は、領域と呼ばれます。
アストロサイトは、アルツハイマー病(AD)、筋萎縮性側索硬化症(ALS)、ハンチントン病(HD)、パーキンソン病(PD)など、多くの神経疾患において重要な役割を果たしていると考えられています(Pekny, 2016 ;Booth, 2017 ;Yun, 2018 ;Lee, 2022 ;Lawrence, 2023 )。多くのストレス条件下では、アストロサイトは「反応性」になり(Pekny, 2014 ;Escartin, 2021 ;Patani, 2023 )、神経解剖学者によって早期に観察された異なる遺伝子発現プロファイルと劇的な形態変化が起こります(Andriezen, 1893 )。この文脈における「肥大」は、主枝や小枝が太く短くなり、分岐が多くなるという形でしばしば観察されます。
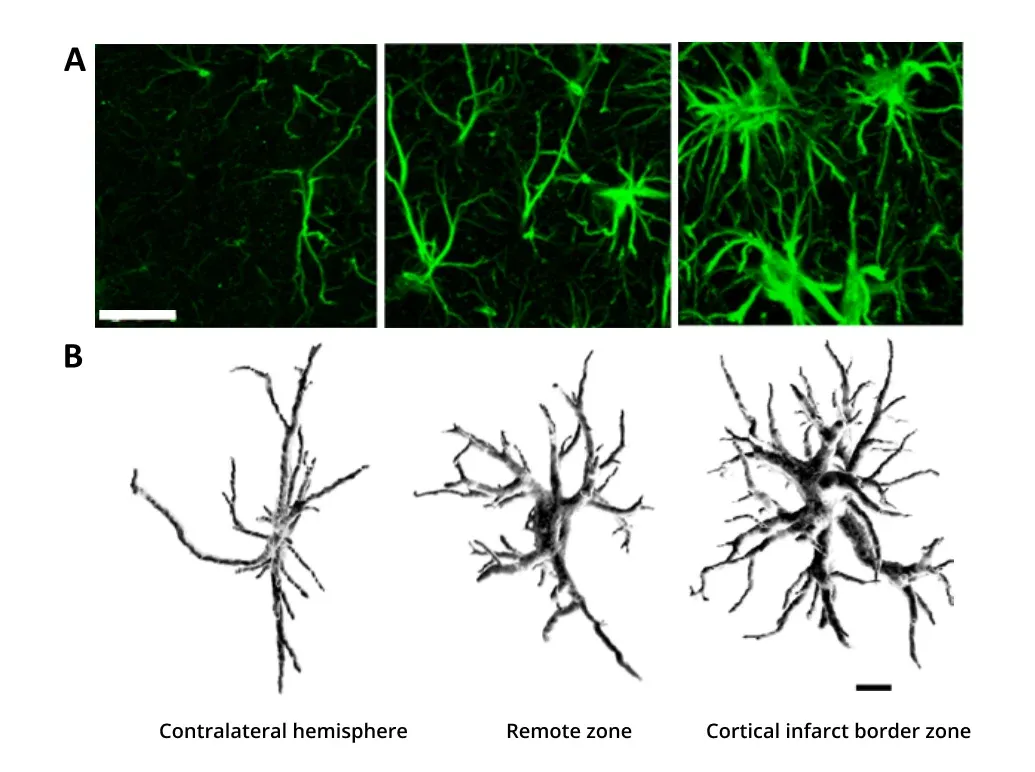
脳虚血によるアストロサイトの肥大。アストロサイトは3つの領域で示されています。すなわち、脳卒中に影響を受けていない反対側の半球、影響を受けた半球だが損傷部位から離れた場所、皮質梗塞境界領域です。 (A) GFAP免疫染色法により、反応性アストログリアが観察されています。染色密度と強度は損傷部位に近いほど高くなります。スケールバー = 20 μm。(B)共焦点顕微鏡で撮影したGFAP標識アストロサイトの3D再構成画像。分岐点の増加、プロセスの肥厚、容積の増加が示されています。スケールバー = 10 μm。図は、クリエイティブ・コモンズ表示ライセンスに基づき、Wagner et al. (Wagner, 2013).より転載したものです。
アストロサイトの形態に関連する遺伝子は、アルツハイマー病、筋萎縮性側索硬化症、多発性硬化症(MS)を含む多くの神経疾患で豊富であることが分かっています(Endo, 2022)。 アルツハイマー病のマウスモデルでは、アミロイドベータプラークの著しい沈着に先立って形態変化が検出されています(Yeh, 2011 ;Beauquis, 2013 )。バイオスプクティブでは、前臨床研究においてアストロサイトの形態を定量化することが、疾患進行の早期かつ高感度な指標となり得ると仮説を立てました。APP/PS1トランスジェニックマウスモデルを用いた研究により、アストロサイトの形態を定量化することは、疾患状態を測定する上でGFAP染色密度よりも高感度であることが示されました。
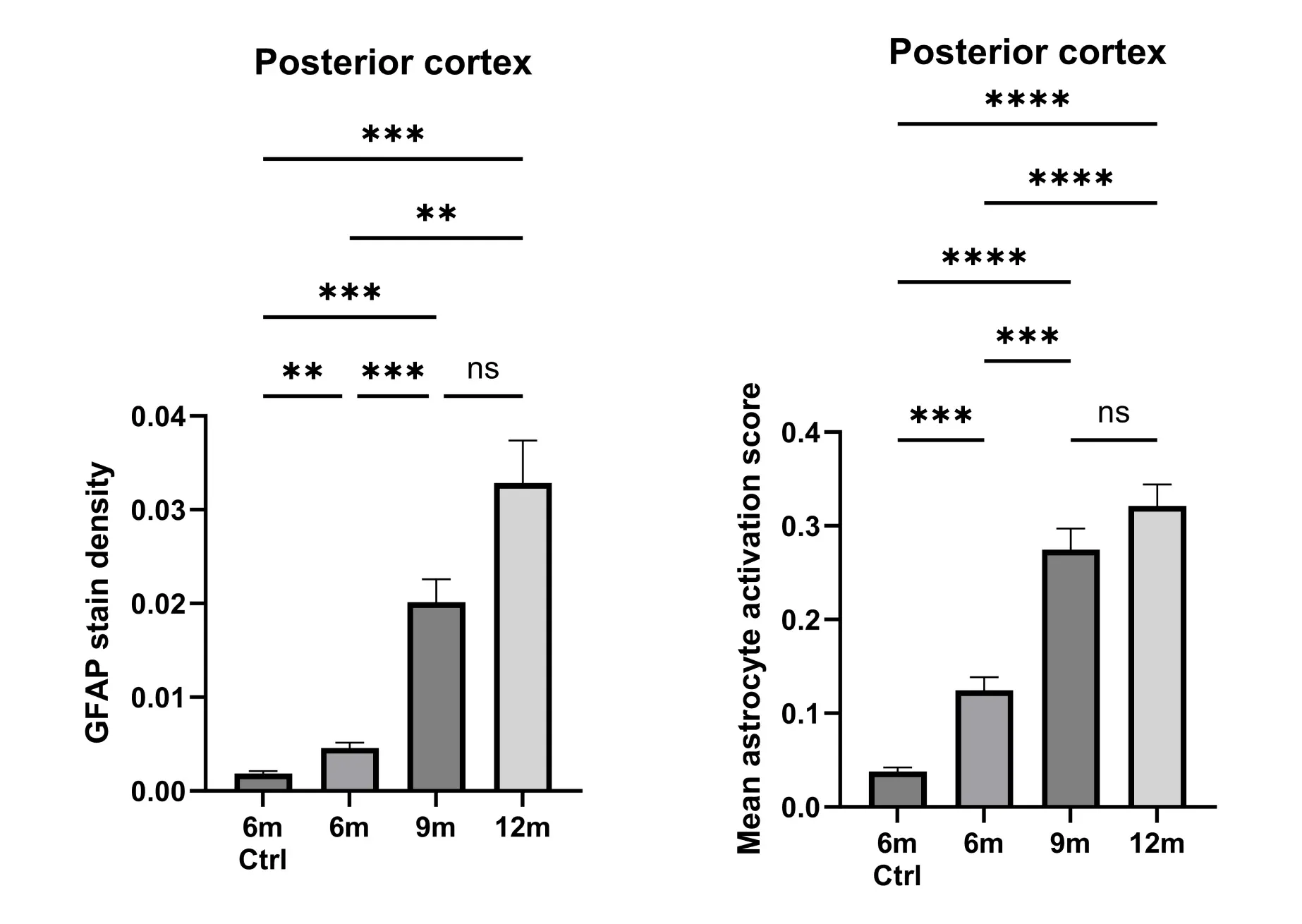
アストロサイトの形態を定量化することで、病状を敏感に測定することができます。アストログリア症は、6、9、12ヶ月齢のAPP/PS1マウスの後部皮質で定量化され、6ヶ月齢のコントロール(野生型)マウスと比較されます。GFAP 染色の密度(すなわち、GFAP 陽性ピクセルの割合)は、病気の進行に伴い徐々に増加します(左)。 形態分析から得られた、各マウスにおける ROI ごとの平均アストロサイト活性スコアも、病気の進行に伴い増加しますが、変化にはより高い統計的有意性があります(右)。 エラーバーは平均値の標準誤差(SEM)を表します。P値はDunnettのT3多重比較検定により算出したもので、** p <0.01、*** p <0.001、**** p <0.0001です。
組織切片におけるアストロサイトの形態を定量化するにはどうすればよいでしょうか?
実験条件
アストロサイトの形態を定量化するには、特定の標識が必要です。 古典的な方法としては、アストロサイトのミドルフィラメントを標識し、一次プロセスの画像化を可能にするグリア線維性酸性タンパク質(GFAP)に対する免疫染色を行う方法があります。 しかし、GFAPの発現は脳の領域によって大きく異なり(Endo, 2022)、アストロサイトの形態を完全に捉えることはできません(Baldwin, 2024 )。枝、小葉、細胞領域などのより微細な構造を可視化するには、蛍光タンパク質(FP)の発現または色素注入技術が必要です(Bushong, 2002 ;Reeves, 2011 )。一方、これらの方法では、まばらな標識付けか、近接する細胞を区別するための複数の蛍光体の使用が必要となります。広範なアストロサイトの形態の高処理定量と、まばらに標識付けされた細胞の詳細な特性評価のどちらがより感度が高いかは、まだ明らかになっていません。
アストロサイトの画像は、スライドスキャナーを使用して薄切切片で2Dの高スループットで、またはより厚い切片(40-100μm)で共焦点顕微鏡を使用して3Dで取得できます。 重要なのは、共焦点顕微鏡を使用しても軸方向の解像度は側方解像度よりもはるかに低く、3D再構成の解釈には注意が必要であるということです(Baldwin, 2024 )。スループットと詳細な3D形態学的評価の間の同様のトレードオフは、研究の目的に応じて考慮する必要があります。例えば、スライドスキャナーで撮影したアストロサイトの形態の自動定量化は、仮説上の治療薬の前臨床研究で使用でき、何百万もの細胞に拡大して、病状を敏感に測定することができます。
形態学的特性評価の一般的な手順
アストロサイトの形態解析の計算パイプラインはミクログリアのものと類似していますが、これまで発表されたツールのほとんどは、これらのステップすべてを実行できるわけではありません(Labate, 2023 )。主なステップには、細胞の識別と分離(オブジェクト検出)、アストロサイトのセグメント化、分岐分析のための骨格化処理などがあります。 その後、各細胞について、細胞面積、細胞体面積、骨格内の分岐点の数など、複数の形態学的測定基準(形態計測学)を取得することができます。アストロサイトにFPで標識を施した場合、領域の大きさや重なり(複数のマーカーを使用した場合)などの追加の測定基準を算出することができます。アストロサイトは、その形態計測に基づいて特定の形態タイプに分類することができますが、ミクログリアの形態分析とは対照的に、このステップは一般的に実行されていません。
グループ間の定量的分析
形態計測値は、関心領域(ROI)、動物、グループごとに集計し、グループ間のアストロサイトの形態の変化を検出することができます。ただし、このアプローチを使用する際には、同一の動物から採取した複数の細胞は独立したサンプルではないため、グループ内のばらつきを慎重に考慮する必要があります。ブートストラップ法などの技術は、形態計測の分布を比較しながら、このグループ内変動を推定するために使用することができます。一方、ミクログリア分析で行われたように、特定の形質クラスターまたは形態タイプに属する細胞の密度を定量化すれば、この課題を回避することができます。
アルツハイマー病の治療薬開発において、アストロサイトの形態の定量化はどのように役立つのでしょうか?
ADマウスモデルにおける形態学的変化
複数のADマウスモデルにおいて、アストロサイトの形態変化が観察されています。例えば、脳アミロイド血管症(CAA)マウスモデル(Tg-FDD、家族性デンマーク認知症)では、GFAPで染色したアストロサイトにおいて、分岐の増加および反応性マーカー(C3)の発現増加が観察されました(Taylor, 2020 )。このモデルでは、ミクログリアの増加は観察されず、アストログリアの著しい増加が観察されました。
Endo 氏ら (Endo, 2022)は、AD の APP/PS1 マウスモデルを使用して、皮質アストロサイトの形態変化を観察しました。この研究では、アストロサイトを FP で標識し、その他の形態計測に加えて、その領域サイズを定量化しました。健康な脳では、バルクおよびシングルセルトランスクリプトミクスによって得られた、領域間の遺伝子発現の変動と、形態計測の変化を相関させ、推定される形態遺伝子モジュールを特定しました。これらのモジュールから抽出された2つの遺伝子、EzrinとFermt2は、遺伝子ノックアウトにより検証され、その結果、アストロサイトの領域サイズが縮小し、影響を受けたマウスの認知タスクに変化が見られました。 彼らのマウスモデルとヒトのAD組織の両方において、著しくダウンレギュレーションされた遺伝子は、領域サイズと正の相関関係にあることが分かりました。 彼らのマウスモデルでは、顕微鏡により皮質アストロサイトの領域サイズが縮小していることが観察されました。最後に、同定されたアストロサイトの領域サイズに関連する遺伝子は、アルツハイマー病、多発性硬化症、筋萎縮性側索硬化症を含む複数の神経疾患において、その発現が増加していることが分かりました。
Yeh 氏ら(Yeh, 2011 )は、進行の遅い AD マウスモデル(3xTg-AD)のアストロサイトの形態を定量化しました。アミロイド斑や細胞外凝集体が検出される(12ヶ月齢)よりもかなり前の生後1ヶ月齢の時点で、GFAPに対する免疫染色を行ったアストロサイトにおいて、表面積と体積の著しい萎縮が観察されました。
アストロサイトの形態に影響を与える治療法
別のアルツハイマー病のマウスモデル(PDAPP-J20トランスジェニックマウス)において、Beauquis氏らは(Beauquis, 2013 )、環境エンリッチメント(EE)がアミロイドβ負荷と海馬のアストロサイト形態に及ぼす治療効果について研究しました。 EEを施したマウスでは、未処置のトランスジェニックマウスと比較して、アミロイドプラーク負荷が大幅に減少しました。著者らは、プラーク関連アストロサイト(PAA、その研究ではプラークの厚さが50μm未満と定義)と非プラーク関連アストロサイトの形態を個別に分析しました。その結果、未処置のトランスジェニックマウスでは、プラークから離れたアストロサイトが著しく萎縮している一方で、PAAの体積は増加していることが分かりました。EEは、PAAとプラークから離れたアストロサイトの両方において、形態変化を減少させました。また、アストロサイトの分岐の増加も、プラークの著しい蓄積の前に観察されました。
Chandra 氏らは、アルツハイマー病のAPP/PS1マウスモデルを使用 し、雄マウスにおける抗生物質治療による腸内微生物叢の変化の影響について研究しました。 その結果、治療により、未治療の動物と比較してアストロサイトとPAAの数が減少することが分かりました。GFAPで染色したPAAの形態も、この治療の影響を受け、細胞体領域の割合が減少し、平均の突起の長さが増加しました(すなわち、肥大化の減少を示唆)。機能マーカーも変化し、治療によりC3が減少し、ビヒクルと比較してエズリンが増加しました。エズリンの発現は、複数の形態計測とよく相関していました。糞便移植により微生物叢を再導入すると、これらの効果は消失しました。一方、無菌マウスでは、抗生物質投与マウスと同様の変化が見られました。CSF1R阻害剤を用いてミクログリアを減少させることで、著者らは、抗生物質投与によるPAA形態への影響はミクログリアの存在に依存しているが、アストロサイトの数の減少は独立して起こることを示しました。
Canepa 氏ら(Canepa, 2023 )は、アルツハイマー病の TgSwDI マウスモデルにおいて、2 種類の炭酸脱水酵素阻害剤であるメサゾラミドとアセタゾラミドを治療薬として試験しました。 その結果、この治療によりアミロイド斑の負荷が減少し、アストロサイトの肥大化が抑制されることが分かりました。 また、ミクログリアの形態も、ビヒクルと比較して、治療群では影響が少なかったことが分かりました。
アストロサイトの新しい形態
Sokolova 氏ら(Sokolova, 2024) は、アルツハイマー病のマウスモデルおよびヒトのアルツハイマー病組織において、新しいタイプの細胞形態を持つアストロサイトを特定しました。FP 発現を用いてアストロサイトの形態を可視化し、アストロサイトを特定しました。「球状」の突起と p62 の高レベル発現は、プラークが大量に蓄積する前に存在していました。この形態は主に海馬に存在し、GFAP染色では可視化できませんでしたが、S100βを使用しても観察されました。また、これらのアストロサイトは、近隣のアストロサイトと比較して領域サイズが小さく、アミロイド斑とは空間的に相関していませんでした。著者らは、アミロイドーシスの初期段階において、これらの「球状」アストロサイトが MFG-E8(糖タンパク質ミルクファットグロビュール-EGF因子8)を分泌することでミクログリアのシナプス包摂を促進していることを発見しました。これは、治療介入の可能性を開く新たな発見です。
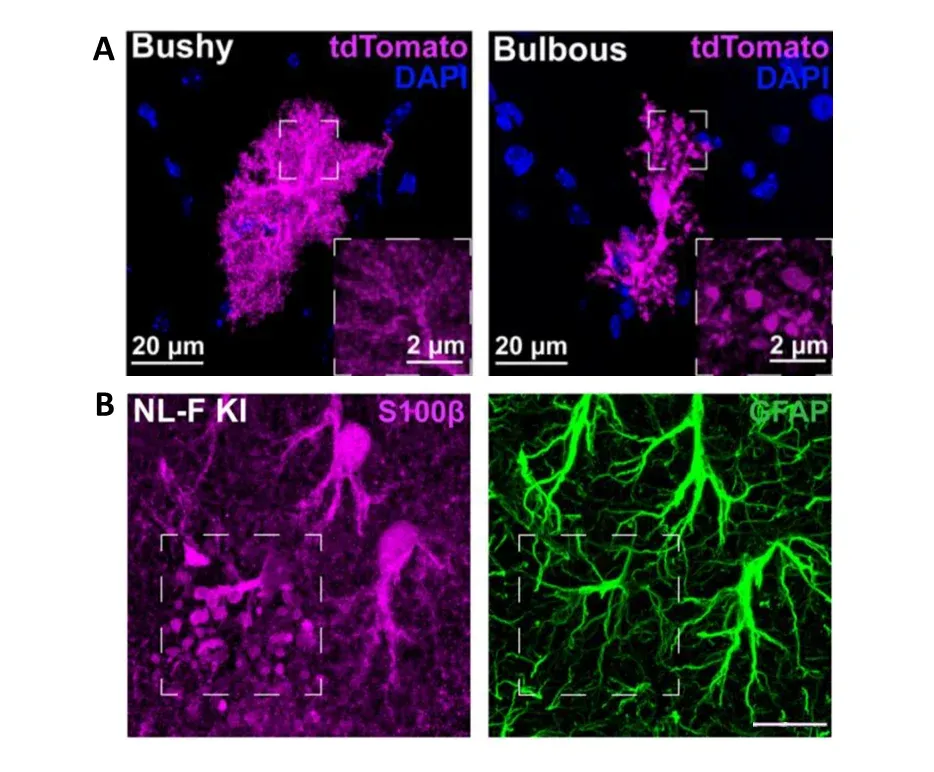
「球状」と名付けられた新しいアストロサイトの形態の特定。 (A) アルツハイマー病のNL-Fノックインマウスモデルにおける典型的なふさふさしたアストロサイトの形態と「球状」の形態を比較した顕微鏡画像。アストロサイトはFP(tdTomato)で標識され、その完全な形態が示されています。球状の突起は、「球状」アストロサイトの突起で観察することができます。(B)これらの突起は、GFAP免疫染色では観察できませんが、S100βでは観察できます。スケールバー = 15μm。図は、クリエイティブ・コモンズ帰属ライセンスに基づき、Sokolova et al.(Sokolova, 2024) より転載したものです。
当社のチームは、アストロサイトの形態に関するご質問にお答えしたり、治療効果の研究に使用しているADモデルに関する特定の情報を提供したりいたします。
ADモデルについてもっと知ろう
関連コンテンツ
神経変性疾患の動物モデルにおける治療薬の評価に関する最新情報とベストプラクティス。
アルツハイマー病におけるアストロサイトの形態
アストロサイトの形態解析の概要と、神経変性疾患の研究および創薬・薬剤開発への応用。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。
アルツハイマー病におけるアミロイドβプラーク分析
ヒトおよびアルツハイマー病動物モデル(トランスジェニックマウスおよびラット)の脳組織切片におけるAβプラークの分類および定量化方法の概要。