왜 미세아교세포 형태를 정량화해야 할까요?
미세아교세포는 근위축성 측삭 경화증(ALS), 알츠하이머병(AD), 파킨슨병(PD)을 포함한 많은 신경 퇴행성 질환에서 중요한 역할을 합니다 (Salter, 2017; Hickman, 2018). 예를 들어, 신경 퇴행성 질환에 대한 많은 잠재적 치료법은 미세아교세포의 표현형을 조절하거나 Aβ 플라크의 제거를 촉진하는 등 미세아교세포를 표적으로 합니다 (Gao, 2023). 미세아교세포는 매우 역동적인 세포로서, 단일세포 '옴니믹스' 기술로 입증된 바와 같이 다양한 표현형을 가질 수 있습니다. 최근 약 100명의 과학자들이 공동 저술한 논문 (Paolicelli, 2022)에서는 이러한 표현형에 대한 용어를 명확히 하고 이에 대한 합의를 이끌어내기 위해 노력하고 있습니다. 이 논문에서는 항상성 특징, 백질 관련 미세아교세포, 질병 관련 미세아교세포(DAM)와 같은 용어를 사용합니다.
미세아교세포는 반응성 조건에서 급격한 형태학적 변화를 보입니다. 이 자료에서는 일반적으로 정량화된 형태학적 표현형 (Savage, 2020)을 강조합니다. 항상성 조건에서 미세아교세포는 일반적으로 길고 가늘고 확장된 과정을 특징으로 하는 가지가 많은 형태를 나타냅니다. 비대성 미세아교세포는 일반적으로 반응성 조건과 관련이 있으며, 더 짧고 두껍고 더 가지가 많은 과정을 가진 확대된 체체를 가지고 있습니다. 아메오이드성 미세아교세포는 체세포가 커졌고, 돌기가 거의 없어 대식세포와 형태학적으로 유사합니다. 영양장애성 미세아교세포는 돌기의 구형으로 부풀어오른 부분이 특징이며, 조각난 것처럼 보일 수 있습니다. 마지막으로, 막대세포는 한 방향으로 길게 뻗어 있으며, 방사형 돌기가 거의 없습니다. 기능적 표현형과 뚜렷한 형태는 미세아교세포의 두 가지 상호 보완적인 특징이지만, 형태적 변화(분지)와 기능(사이토카인 방출) 사이의 기계적 연관성이 확인되었습니다 (Madry, 2018). 또한, 형태적 지표가 개별 미세아교세포의 기능적 표지와 상관관계가 있는 것으로 밝혀졌습니다 (Kozlowski, 2012; Fernández-Arjona, 2019).
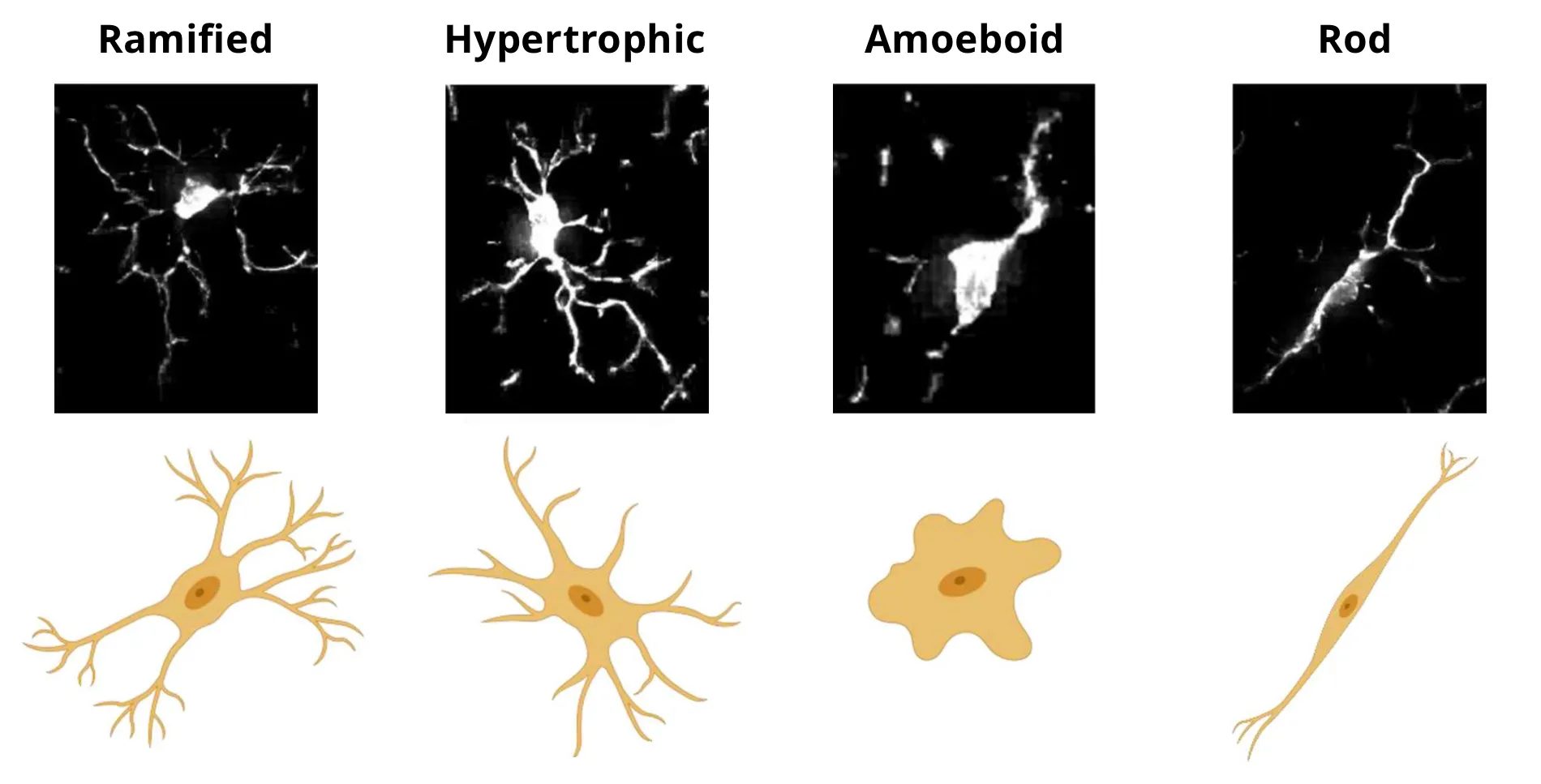
현미경 사진과 미세아교세포의 4가지 형태에 대한 도식적 표현의 예. (Savage, 2019)의 형태학 정의에 기초하여 (Reddaway, 2023)에서 복제 및 수정된 그림, 크리에이티브 커먼즈 저작자표시 라이선스 적용.
조직 단면도에서 미세아교세포의 형태를 어떻게 정량화할 수 있을까요?
실험 조건: 염색, 조직 두께, 현미경검사
미세아교세포의 형태를 정량화하기 위해서는 미세아교세포의 돌출부와 체세포 모두에 특이적이고 민감하며 모든 표현형(일반적으로 Iba-1)에서 발현되는 염색으로 미세아교세포를 표지해야 합니다. 최대 150μm 두께의 조직 단면은 미세아교세포의 형태를 완전히 3D로 특성화하기 위해 공초점 현미경을 사용하여 Z-스택으로 촬영할 수 있습니다. 2D에서 높은 처리량을 가진 정량화를 위해, 더 얇은 단면(5-20 마이크로미터)을 디지털 슬라이스 스캐너로 촬영할 수 있습니다 (Franco-Bocanegra, 2021; Leyh, 2021). 처리량과 3D 촬영 사이의 균형은 연구의 목적에 따라 달라집니다. 예를 들어, 처리량이 많은 2D 이미징은 전임상 치료 효능 연구에 적합하며 수백만 개의 세포로 확장할 수 있습니다. 반응 조건에서 일관되게 변화하는 체세포 크기 (Kozlowski, 2012; Verdonk, 2016; Davis, 2017; Fletcher, 2020; Silburt, 2022)와 같은 간단한 측정 기준은 2D에서 정확하게 정량화할 수 있습니다. 예를 들어, 한 연구는 소마 형태학에만 초점을 맞추어 노화된 생쥐의 망막에서 분지형에서 비대성 소교세포로 변화하는 것을 발견했습니다 (Choi, 2022).
형태적 정량화를 위한 단계
대부분의 접근 방식에 공통적으로 적용되는 자동 정량화에 필요한단계는 아래 그림에 나와 있습니다. 다양한 접근 방식이 Reddaway et al. (Reddaway, 2023 ) 에 의해 검토되었습니다. 먼저, 미세아교세포를 개별적으로 감지하고 분리해야 합니다. 컴퓨터 비전에서 객체 감지 작업이 이루어집니다. 각 세포의 세포와 체세포는 배경에서 분리됩니다. 프로세스의 골격은 알고리즘을 통해 얻어집니다. 마지막으로, 세포 면적, 둘레, 체세포 면적, 골격의 가지 수 등과 같은 다양한 형태학적 지표(즉, 형태 측정)가 각 세포에서 측정됩니다.
미세아교세포 형태 분석 과정의 도식적 표현. 미세아교세포는 면역조직화학(여기에서는 Iba-1로 염색된 상태) 또는 면역형광 조직 단면으로 식별됩니다. 식별된 각 세포의 체세포와 돌기는 분할되고, 돌기의 골격이 얻어집니다. 그런 다음 세포와 체세포 크기 등 여러 가지 형태적 지표가 얻어집니다. 그런 다음, 셀을 기계 학습 모델을 사용하여 특정 형태학으로 분류할 수 있습니다. 표시된 예에서 파란색 상자는 분지형 형태를 나타내고, 빨간색 상자는 비분지형 형태를 나타냅니다. 그런 다음, 셀에 대한 다양한 통계를 관심 영역(ROI), 주제(예: 동물), 그룹별로 집계할 수 있습니다. 형태학 지표 도식화는 크리에이티브 커먼즈 저작자 표시 라이선스에 따라(Leyh, 2021) 에서 복제 및 수정되었습니다.
그룹 간 양적 분석
셀 형태 측정법은 관심 영역(ROI), 동물, 그룹별로 집계됩니다. 그룹을 비교하는 세 가지 주요 접근 방식이 있습니다.
1.그룹의 형태 측정 분포를 비교합니다. 가장 간단한 접근 방식 은 단순히 그룹 전체의 체질량과 같은 특정 지표의 분포를 비교하는 것입니다. 예: (Kozlowski, 2012; Heindl, 2018).
2.서로 다른 클러스터에 걸쳐 세포의 분포를 비교합니다. 기계 학습 방법은 유사한 형태를 가진 세포의 클러스터를 식별할 수 있습니다. 그런 다음, 이 클러스터에 걸쳐 세포의 분포를 그룹별로 비교할 수 있습니다. 예: (Fernández-Arjona, 2017; Heindl, 2018; Salamanca, 2019).
3.분류된 형태에 따른 세포 분포를 비교합니다. 머신 러닝 모델을 훈련시켜 사용자 지정 형태(예: 분지형, 비대형, 아메바형 등)를 인식하도록 할 수 있습니다. 그런 다음 이러한 형태를 가진 세포의 분포와 수를 그룹별로 비교할 수 있습니다. 예: (Leyh, 2021; Choi, 2022).
신경 퇴행성 질환에서 관찰된 미세 아교 세포의 형태 변화는 무엇입니까?
이 섹션에서는 ALS, AD, PD 등 세 가지 신경 퇴행성 질환의 공통적인 발견 사항을 강조합니다.
근위축성 측삭 경화증(ALS)
세 가지 다른 ALS 마우스 모델에서 미세아교세포의 형태학적 변화가 관찰되었습니다. SOD1-G93A 모델에서, 질병 진행 동안 비대(더 큰 세포체, 더 짧은 돌기)와 유사한 형태로의 점진적인 변화가 관찰되었습니다 (Ohgomori, 2016). 유도 가능한 hTDP43ΔNLS 모델에서, 병리학적 TDP-43의 발현이 중단된 후 질병 "회복" 과정에서 유사한 변화가 관찰되었습니다 (Spiller, 2018). C9orf72 모델(GA 반복)에서 미세아교세포의 수가 증가하고 비대화로 전환되는 현상이 관찰되었습니다. 이 효과는 마우스가 GA 반복에 면역되었을 때 대부분 사라졌습니다 (Zhou, 2020). Biospective에서 TDP-43 ΔNLS 마우스 모델을 사용하여, 우리는 "Off Dox"와 "Low Dox" 모델 모두에서 형태학적 변화를 발견했습니다. 비분화성 소교세포의 밀도는 임상 복합 운동 점수와 높은 상관관계가 있었습니다.
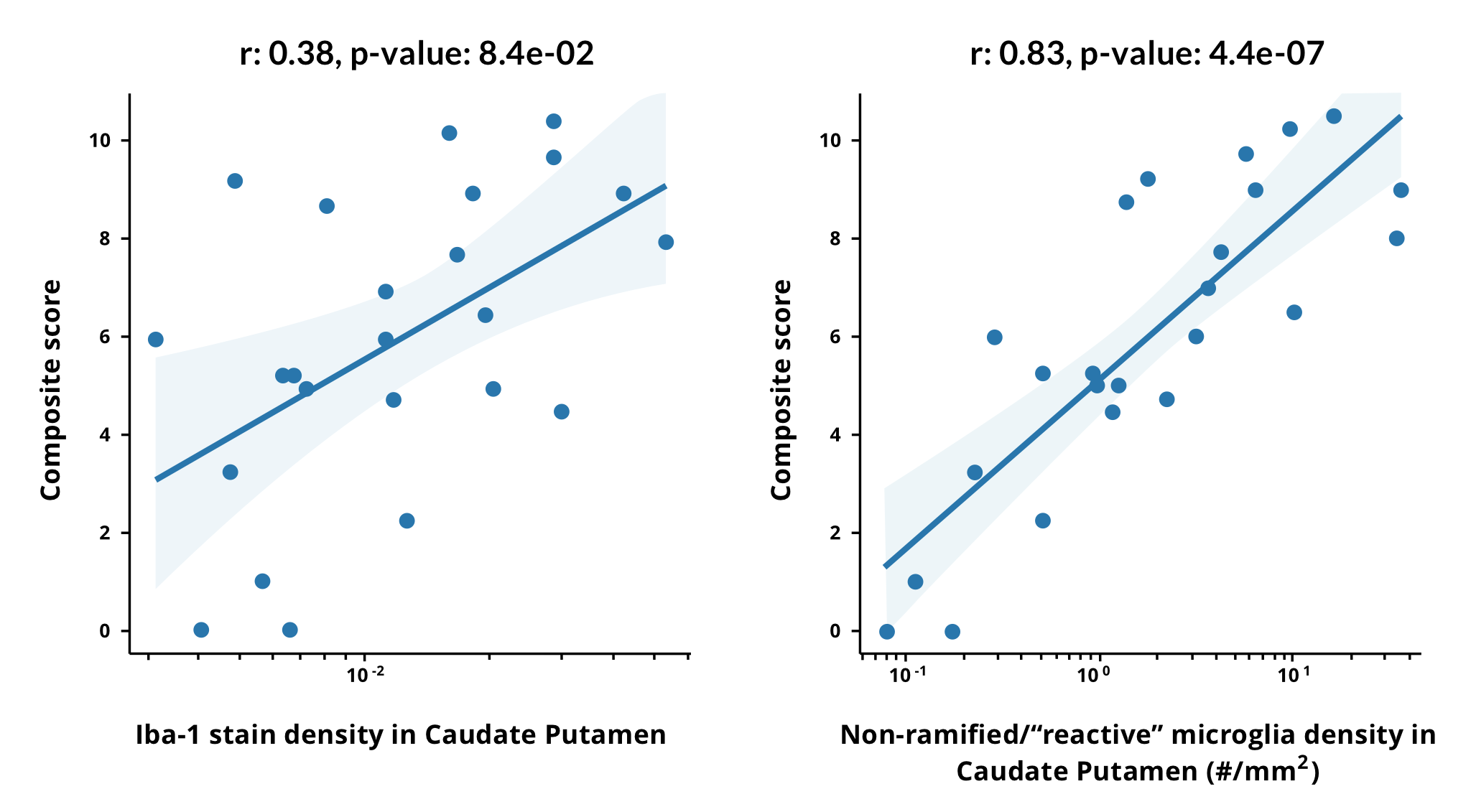
마우스 TDP-43 ΔNLS 모델에서 미세아교세포의 형태학적 변화는 임상적 운동 점수와 높은 상관관계가 있습니다. 복합 운동 점수는 Iba-1 염색 밀도(분할된 픽셀의 비율, 왼쪽)와 질병의 심각도 수준이 다른 그룹에 걸쳐 꼬리핵(CP)에서 비분화("반응성") 형태를 가진 미세아교세포의 밀도(오른쪽)의 함수로 표시됩니다. X축의 로그에 선형으로 맞는 것이 표시되고, Pearson 상관 계수는 Iba-1 염색 밀도에서 0.38에서 비분지성 소교세포 밀도에서 0.83으로 증가합니다. 선형 맞춤에서 "On Dox (control)", "4 weeks Low Dox", "6 weeks Low Dox", "3 weeks Off Dox"와 같은 다양한 질병 심각도 그룹이 표시됩니다. 4개의 ROI(꼬리핵, 운동피질, 비운동피질, 피질척수관)에서 비분지성 소교세포의 로그 밀도를 결합한 선형적 적합은 0.93 +/- 0.06의 상관 계수를 산출합니다(5회 교차 검증의 표준 편차에서 얻은 범위).
알츠하이머병(Alzheimer's Disease)
인간 조직에 대한 연구에 따르면, 일반적으로 AD 환자의 미세아교세포 총 수는 연령이 비슷한 대조군과 비교했을 때 큰 차이가 없는 것으로 나타났습니다 (Davies, 2017; Heindl, 2018; Paasila, 2019; Martini, 2020; Franco-Bocanegra, 2021). 그러나, 항상성 유지에 중요한 역할을 하는 가지 모양의 형태에서 변화가 관찰되었습니다. 영양 장애 형태를 가진 소교세포의 수가 증가하는 것으로 보고되었습니다 (Bachstetter, 2015; Davies, 2017; Martini, 2020). 총 프로세스 길이 등 여러 형태적 지표가 Aβ 및/또는 타우 병리학적 부하와 상관관계가 있는 것으로 밝혀졌습니다 (Heindl, 2018; Paasila, 2019; Franco-Bocanegra, 2021). 흥미롭게도, Franco-Bocanegra et al. (Franco-Bocanegra, 2021)은 치료 효과를 관찰했습니다. Aβ42에 대해 면역화된 환자는 치료받지 않은 AD 환자 및 건강한 대조군에 비해 분지형 형태를 가진 미세아교세포의 비율이 증가했습니다. AD의 APP/PS1 마우스 모델에 대한 연구에서, Aβ 플라크 근처에 국한되어 있는 미세아교세포의 형태학적 변화가 발견되었으며, 이는 질병 진행을 평가하는 데 있어 Iba-1 염색 밀도보다 더 민감했습니다.
파킨슨병과 시누클레노파티스
쥐와 마모셋을 대상으로 한 파킨슨병 모델에서, 가지가 많은 형태에서 비대성 및 아메바형 형태로 변화하는 것이 관찰되었습니다 (Sanchez-Guajardo, 2010; Barkholt, 2012). 마찬가지로, 다발성 경화증(MSA; PLP-알파-시누클레인)의 마우스 모델에서, 전체적인 미세아교세포 수의 증가 없이 분지형 형태에서 비대형 형태로 변화하는 것이 관찰되었습니다 (Refolo, 2018). 파킨슨병 쥐 모델에서 치료 효과가 관찰되었습니다. 레보도파를 투여한 쥐의 선조체에서 비대성 형태로의 전이(체질량, 밀도 증가 등)의 전형적인 변화가 관찰되었지만, 식염수를 투여한 쥐에서는 관찰되지 않았습니다 (Fletcher, 2020). Biospective의 PD 마우스 모델 (반수체 M83 마우스의 전방 후각핵에 인간 프리폼드 피브릴 주입)을 사용하여, 우리는 전체 미세아교세포의 증가와 비대성 형태로의 변화를 발견했으며, 이는 질병의 진행과 관련이 있었습니다. 비분지형 미세아교세포의 밀도는 Iba-1 염색 밀도보다 질병 상태를 더 민감하게 측정하는 지표였습니다.
저희 팀은 ALS, 알츠하이머병, 파킨슨병에 대한 미세아교세포 형태학에 관한 질문이나 치료 효능 연구에 사용하는 모델에 관한 구체적인 정보를 제공해 드릴 수 있습니다.
관련 콘텐츠
신경 퇴행성 질환에 대한 최신 정보와 신경 퇴행성 질환 모델에서 치료제 평가와 관련된 모범 사례.
미세아교세포-신경세포 상호작용 및 신경퇴행성 질환
미세아교세포와 신경세포 간의 직접적인 상호작용에 대한 간결한 검토, 그리고 이러한 세포 간 상호작용이 신경퇴행성 질환에서 어떻게 영향을 받을 수 있는지.
신경 퇴행성 질환의 TNF-α & 미세 아교 세포
미세아교세포에서 종양괴사인자-알파(TNF-α)의 기능과 신경퇴행의 진행에 대한 기여에 대한 개요.
미세아교세포 노화 및 신경퇴행성 질환
이 자료는 미세아교세포 노화와 알츠하이머병(AD)과 파킨슨병(PD)을 포함한 신경퇴행성 질환에서의 그 역할에 대한 개요를 제공합니다.
자가포식, 파킨슨병, 도파민성 신경세포
파킨슨병에서 손상된 자가포식 작용이 어떻게 도파민성 뉴런의 병리학적 변화와 신경 퇴화로 이어질 수 있는지에 대한 개요.
자가포식 및 신경퇴행성 질환
세포 자가포식이 뇌 건강과 신경 퇴화에 어떤 역할을 하는지에 대한 개요.
신경근 접합부(NMJ) 형태학 및 ALS 모델
신경근 접합부(NMJ)에 대한 통찰, 근위축성 측삭 경화증(ALS)에서의 그 역할, 그리고 NMJ의 형태학적 변화를 연구하는 데 사용되는 도구와 방법.
알츠하이머병의 성상교세포 형태
성상교세포 형태학적 분석의 개요와 신경 퇴행성 질환 연구 및 신약 개발에 대한 응용.
루게릭병 마우스 모델과 척수 운동 뉴런
근위축성 측삭 경화증(ALS)의 마우스 모델에서 척수 운동 신경 세포가 질병 진행에 관여하는 것에 대한 개요.
알츠하이머병의 아밀로이드-베타 플라크 분석
인간과 알츠하이머병 동물 모델(유전자 변형 쥐와 랫트)의 뇌 조직 섹션에서 Aβ 플라크를 분류하고 정량화하는 방법의 개요.
ALS 신약 개발을 위한 TDP-43 ΔNLS (rNLS8) 마우스
이 자료는 임상 전 치료 연구를 위한 ΔNLS(deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) TDP-43 ALS 유전자 변형 마우스 모델의 사용에 대한 정보를 제공합니다.