このリソースでは、以下の内容について説明しています。
オートファジーとは何でしょうか?
オートファジーという用語は、自らを食べるという意味のギリシャ語に由来し、真核細胞内のリソソーム媒介の分解プロセスを説明する目的で、1966年にベルギーの生化学者クリスチャン・ド・デューブによって作られた造語です。このプロセスでは、細菌やウイルスから異常なタンパク質や損傷した細胞小器官に至るまで、細胞の残骸が除去され、再利用されます(Cai, 2022)。これらの構成要素は、新しい分子の合成に使用され、細胞が自らを修復し再構築して生き残り、より効率的に機能することを可能にします(Nixon, 2013)。
真核細胞では、主に3つのオートファジー経路が確認されています。マクロオートファジー、ミクロオートファジー、およびシャペロン媒介性オートファジーです。これらの経路はリソソーム分解に集約されますが、標的とする細胞内物質の種類や、このプロセスで使用される基本的なメカニズムが異なります(Nakatogawa, 2009;Kesidou, 2013)。
ミクログリアとアストロサイトにおけるリソソーム機能障害が神経変性疾患に与える影響に関する詳細は、以下のリンクを参照してください:ミクログリアとアストロサイトにおけるリソソーム機能障害
神経細胞は分裂後も生存し続けるため、オートファジーは神経細胞の恒常性と完全性を維持する保護的な役割を果たしているようです(Bhukel, 2019;Stavoe, 2019)。 オートファジーには、神経細胞に内在する経路とストレス誘発性の経路の両方が存在し、後者は低酸素状態、有害なフリーラジカルの過剰、ミトコンドリアの損傷によって引き起こされます(Lee, 2011;Stavoe, 2019)。これらの経路以外にも、オートファジーには中枢神経系における特殊な役割があります。すなわち、神経細胞のシグナル伝達に不可欠なミエリン化プロセスを促進し、ミクログリアの炎症反応を制御します。これらのプロセスの制御が乱れると、中枢神経系に不可逆的な損傷が生じ、神経細胞が死滅する可能性があります(Su, 2016)。
ミクログリアのオートファジー障害が神経変性疾患にどのように寄与するかの詳細は、以下のリンクを参照してください:神経変性疾患におけるミクログリアのオートファジー障害
神経細胞におけるオートファジーの役割を調査するために、研究者たちは電子顕微鏡(EM)などの技術を用いて、細胞構成成分をリソソームに輸送する膜結合小胞などのオートファジー区画を可視化しています。微小管結合タンパク質 LC3、特に LC3-II のウェスタンブロット分析は、オートファゴソームの形成とレベルが相関することから(Klionsky, 2016)、細胞内のオートファジーを定量化するための別の広く使用されているアプローチです。また、GFP-LC3 トランスジェニックマウスを用いた生体内研究では、オートファジーのプロセスを系統的に観察および分析することが可能です(Mizushima, 2004)。
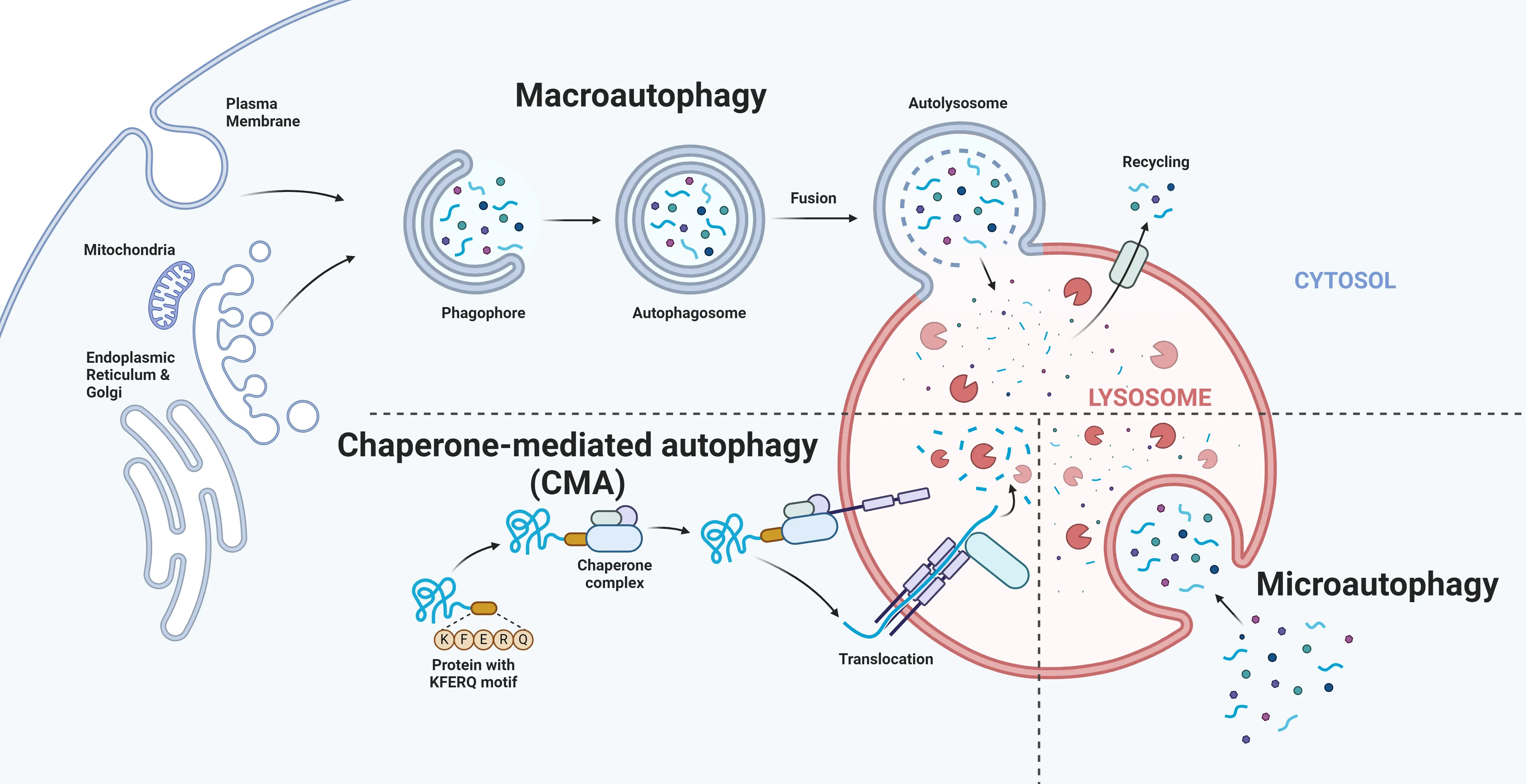
真核細胞では、マクロオートファジー、ミクロオートファジー、シャペロン媒介性オートファジーという3つの主要なオートファジー経路が、細胞残屑の除去と再利用を担っています。 それぞれ異なるメカニズムが関与していますが、これらの経路はリソソームで収束します。
どのような神経変性疾患がオートファジーの障害と関連しているのでしょうか?
オートファジーの障害は、ニューロン内の異常なタンパク質の凝集を特徴とするいくつかの神経変性疾患の病理と密接に関連しています(Kesidou, 2013)。オートファジー経路に重要なタンパク質をコードするオートファジー関連遺伝子の変異は、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、ハンチントン病(HD)に関与していることが示唆されています(Nah, 2015;Deng, 2017;Menzies, 2017)。
マウスモデルは、この関連性についてより深い洞察をもたらしました。例えば、 Hara ら(Hara, 2006)が、神経細胞特異的Atg5 ノックアウトマウスを用いて、疾患関連変異タンパク質が存在しない場合の神経細胞におけるオートファジーの役割を研究したところ、これらのマウスの脳の組織学的分析により、神経細胞の損失、小脳プルキンエ細胞の変性、およびユビキチン陽性封入体の蓄積が明らかになりました。
オートファジーの制御因子としてよく知られているBeclin-1は、いくつかの神経変性疾患に関与していることが示唆されています(Pickford, 2008; Son 2012)。アルツハイマー病では、発症初期に脳内のBeclin-1レベルが低下し、オートファジーのフローが阻害されます(Pickford, 2008)。HDでは、変異したハンチントン遺伝子がBeclin-1と結合し、その機能を損傷します(Shibata 2006;Wu, 2012)。また、Beclin-1は、パーキンソン病のニューロン内で有毒な凝集体を形成するα-シヌクレインの変性も促進します。Spencer 氏らの研究チーム(Spencer, 2009)は、α-シヌクレイン遺伝子導入マウスの脳内にレンチウイルスで発現させたBeclin-1を投与したところ、シナプスおよび樹状突起の病理の改善と、辺縁系におけるα-シヌクレインの蓄積の減少が観察されました。
ALSに関連する遺伝子であるSOD1とTDP-43の変異は、オートファジープロセスのさまざまな段階における障害と関連していることが分かっています(Lee, 2015)。 Rudnick 氏らは 、ALS の病気の進行の異なる段階における運動ニューロンにおけるオートファジーの役割について、 、Atg7 ノックアウトマウスと ALS マウスモデルを交配させることで研究しました(Rudnick, 2017)。SOD1-G93A マウスにおける運動ニューロンオートファジーの阻害は、速筋線維の脱神経と振戦の発症を加速させ、ALS の初期段階において、オートファジーが筋肉と神経の接続を維持する保護的な役割を果たしていることを示唆しています。
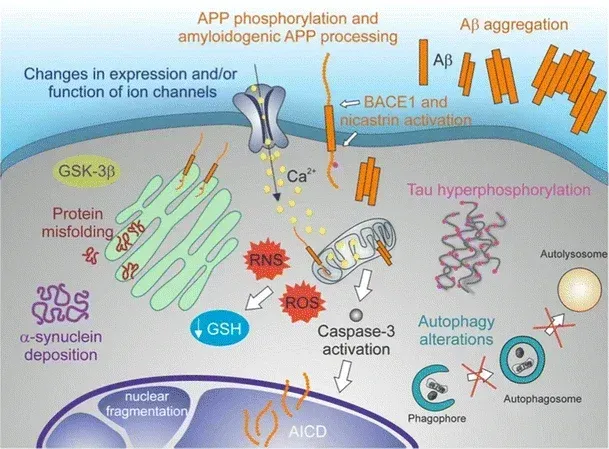
神経変性の分子学的特徴:タンパク質のミスフォールディング、タンパク質凝集体、オートファジーの障害、酸化ストレス、神経細胞の機能不全、アポトーシス細胞死。図とキャプションはDe Chiara et al. (De Chiara, 2012) より、 クリエイティブ・コモンズ表示ライセンスに基づき転載しています。
オートファジーと異常タンパク質の関係はどのようなものでしょうか?
オートファジーは、プロテアソームが誤って折りたたまれたタンパク質を分解するのを補う役割を果たしています。 オートファジーの活動が阻害されると、神経細胞内に有毒なタンパク質凝集体が蓄積し、神経変性につながります(Nixon, 2006;Williams, 2006;Zhang, 2007;Son 2012)。神経変性疾患のマウスモデルを用いた研究では、ラパマイシンによるオートファジー活性の促進が、これらの病理学的タンパク質凝集体の除去を促進することが示されています(Caccamo, 2010)。しかし、折り畳み異常タンパク質とオートファジーの関係は双方向であることに留意することが重要です。折り畳み異常タンパク質はオートファジー経路を妨害し、病気の進行を悪化させるフィードバックループを作り出す可能性があります(Cuervo, 2004;Orenstein, 2013)。
アミロイドベータ
オートファジーは、細胞内アミロイドベータの生成、分泌、除去において重要な役割を果たしています。アミロイドベータペプチドは、ゴルジ体由来の小胞やエンドソームなどのアミロイド前駆体タンパク質(APP)を豊富に含むオルガネラの分解中に、オートファゴソーム内で生成されます(Nixon, 2007)。マウスモデルを用いた研究では、これらのペプチドのニューロンからの分泌はオートファジーによって促進されることが示唆されています。Nillson 氏らの研究チーム(Nillson, 2013)は、APP トランスジェニックマウスと前脳の重要なオートファジー機構を欠くマウスを交配させました。その結果、オートファジーが機能しているマウスと比較して、アミロイドベータプラークが少ないマウスが得られました。この減少は、オートファジーが欠如しているためにニューロンがアミロイドベータを分泌できないことが原因であると研究チームは報告しています。
タウ
この微小管結合タンパク質は、アルツハイマー病に関与しており、オートファジーの重要な調節因子です。 タウのリン酸化が増加すると、微小管が不安定化し、オートファジーによる分解のための細胞内物質の輸送能力が損なわれます(Esteves, 2019)。 さらに、タウの蓄積は、オートファゴソームとリソソームの融合を阻害し、オートファジーの流れを阻害し、自身の蓄積を永続化させます。これはアルツハイマー病における悪循環です(Feng, 2019)。
α-シヌクレイン
アルファ・シヌクレインはプロテアソームだけでなく、シャペロン媒介性オートファジーやマクロオートファジーによっても分解されます(Vogiatzi, 2008;Vidal, 2014; Frake, 2015)。LRRK2、PINK1、PARKINなどのオートファジーを制御するタンパク質の変異は、α-シヌクレインのミスフォールディングと蓄積を促進します(Beilina, 2015;Hou, 2021;Zhang, 2022)。
パーキンソン病におけるオートファジーの役割に関する詳細は、以下のリンクを参照してください:オートファジー、パーキンソン病、およびドーパミン神経細胞
TDP-43
TAR DNA結合タンパク質43(TDP-43)は、RNA/DNA結合タンパク質です。神経細胞におけるオートファジーを刺激すると、TDP-43のターンオーバーが増加し、神経細胞やミクログリアにおける核から細胞質への局在異常が減少します。これは、ALSやFTDの病理学的な特徴です(Barmada, 2014)。
神経変性疾患におけるオートファジーに関するご質問や、治療効果の研究に使用しているAD、ALS、PDモデルに関する特定の情報提供など、どのようなことでもお気軽にお問い合わせください。
神経変性疾患モデルについてさらに詳しく知る
関連コンテンツ
神経変性疾患におけるオートファジーに関する最新情報と、神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
神経変性疾患におけるミクログリアオートファジーの障害
ミクログリアのオートファジーの障害が神経変性疾患の進行にどのように関与しているか。
ミクログリアとアストロサイトのライソゾーム機能不全
ミクログリアとアストロサイトのライソゾーム機能不全の概要と、神経変性疾患におけるその役割。
オートファジーと転写因子EB(TFEB)
転写因子TFEB(Transcription Factor EB)の概要と、オートファジーおよび神経変性疾患における役割について。
オートファジー、パーキンソン病、ドーパミン作動性ニューロン
パーキンソン病における障害のあるオートファジーが、ドーパミン作動性ニューロンにおける病理学的変化と神経変性につながる仕組みの概要。