TDP-43ΔNLSトランスジェニックマウスモデルとは何ですか?
TDP-43 ΔNLS モデルは、deltaNLS、delta NLS、hTDP-43ΔNLS、hTDP-43DeltaNLS、NEFH-hTDP-43ΔNLS、dNLS、TDP43 NLS、rNLS、rNLS8 としても知られており、2015年にWalker氏らによって最初に報告されたトランスジェニックマウスです。このモデルの重要な独特な特徴は、発現されたヒトTDP-43タンパク質が、核局在シグナル(NLS)に欠陥があるため、核への移行が妨げられる(通常は核に局在し機能する)ことです。その結果、神経細胞の細胞質に蓄積し、ALS患者で観察されるものと同様の、リン酸化TDP-43凝集体を含む凝集体の形成につながります。
このモデルでは、hTDP-43ΔNLSの発現はニューロフィラメント重鎖(NEFH)プロモーターによって制御されており、これにより発現は神経細胞に限定されています。Igaz氏らによって報告された先行モデルでは、発現はCamk2aプロモーター下にあり、脳内に細胞質TDP-43が蓄積していましたが、病理学的TDP-43凝集体は最小限で、ALS様表現型は認められませんでした。この発現は、テトラサイクリン類似体であるドキシサイクリン(Dox)によって「調節可能」(したがって「rNLS」)です。hTDP-43ΔNLSを脳と脊髄の両方で発現するrNLS8二重トランスジェニック系統は、個々のトランスジェニック系統を交配させることで作製されました。NEFH-tTA(ライン8;NEFHプロモーターがテトラサイクリン制御トランス活性化因子タンパク質[tTA]の発現を誘導)およびtetO-hTDP-43ΔNLS(ライン4;テトラサイクリンオペレータープロモーター[tetO]がhTDP-43ΔNLSの発現を誘導)。この二重トランスジェニックマウスは、繁殖中および生後数週間(通常は生後5~12週間)はDox食で飼育し、hTDP-43ΔNLSの発現を抑制します。疾患の誘発は、標準的な餌に切り替えることで開始されます(「Doxオフ」モデル)。Dox食で維持されたマウス(「Doxオン」マウス)は疾患の兆候を示さないため、対照群として使用することができます。
このモデルの主な特徴は、Dox食を再導入することで病理学的および機能的回復が得られることです。このモデルでは病気の進行が停止し、元に戻るため、TDP-43発現と病理学的凝集体の調停を通じて病気の修飾が可能であることが示され、ALSの薬剤開発に魅力的なモデルとなっています。
オリジナルのΔNLSモデルは急速に進行し、体重減少と運動症状が典型的にはDox除去から約1週間以内に現れ、数週間以内に死に至ります。ほとんどの治療効果研究により適した代替案として、当社のチームは別のDoxプロトコルを使用した進行の遅いバージョンを開発しました。「低用量ドキソルビシン」モデルでは、同様の表現型が現れますが、モデル誘導後少なくとも3ヶ月間生存するマウスもおり、より長い期間で進化します。
TDP-43 ΔNLS マウスに見られるヒトのALSの主な特徴は何ですか?
ALSは、中枢神経系(CNS)、末梢神経系(PNS)、自律神経系(ANS)、筋肉、免疫系など、人体の多くのシステムに影響を及ぼす致死性の神経変性疾患です。 下のインフォグラフィックにまとめられているように、ΔNLSモデルは、これらの特徴の多くを再現することが実証されていますが、他の特徴(例えば、自律神経系 や免疫系)についてはまだ研究中です。
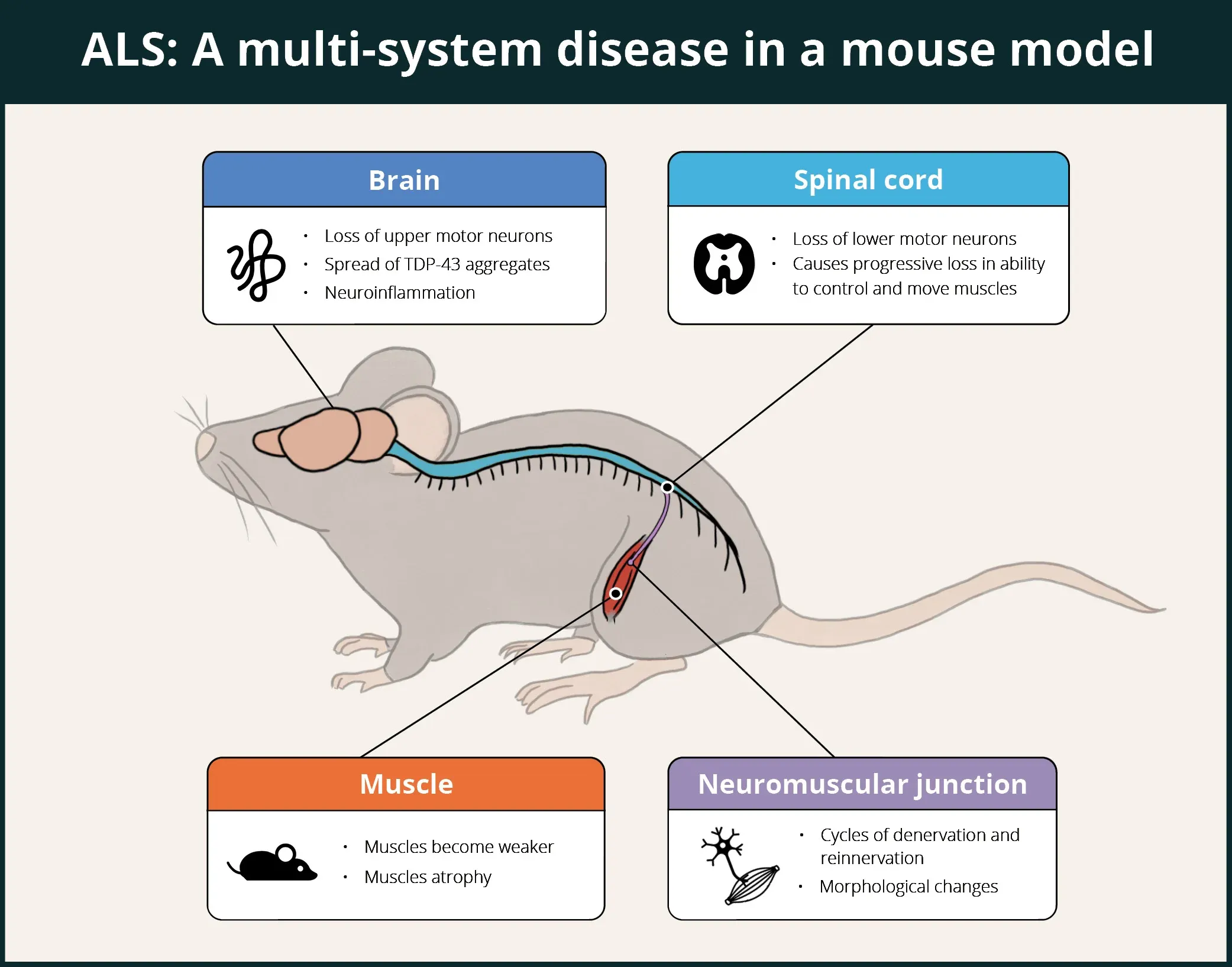
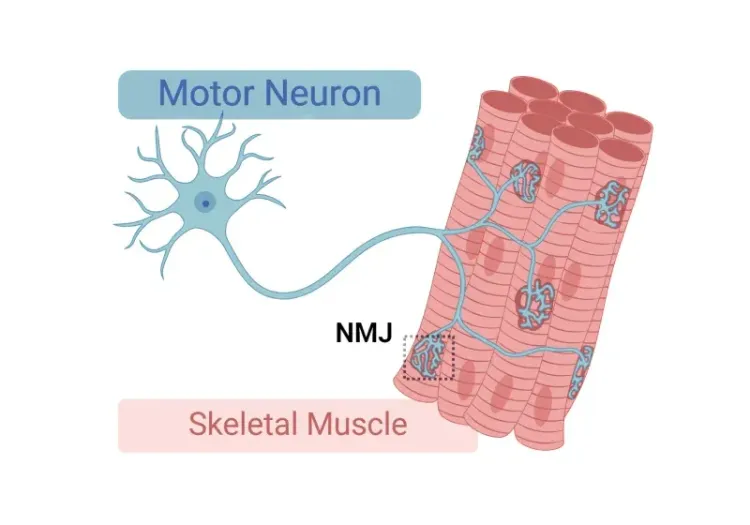
TDP-43ΔNLSマウスは、脳、脊髄、神経筋接合部(NMJ)、筋肉など、複数の系が関与していることを示しており、それにより、ALSの治療薬候補の評価に適したモデルとなっています。
クリックしてリンクをコピー
ΔNLSマウスの脳では、細胞質におけるTDP-43凝集体(リン酸化TDP-43を含む)、神経変性、グリムファージ機能障害、神経炎症(ミクログリアおよびアストログリアの活性化)、およびTDP-43タンパク質異常症患者の死後脳組織と相関するプロテオミクスシグネチャーが観察されています。
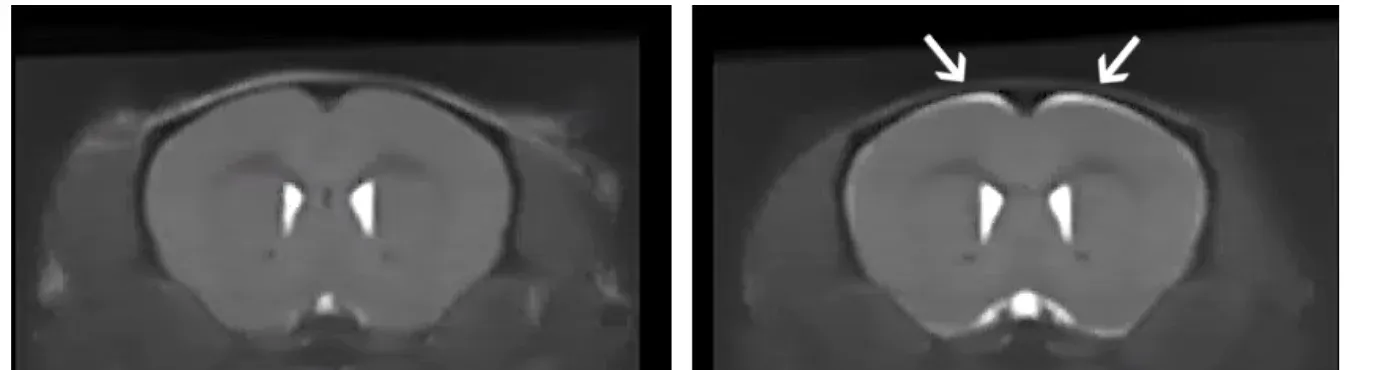
コントロール(左)と3週間Doxを投与したΔNLSマウス(右)の解剖学的MRI。ΔNLSマウスの脳萎縮を示す特定の領域における明るいシグナルに注目してください。
神経炎症という観点では、このモデルにおいてミクログリアが興味深い役割を果たしています 。Spiller 氏らは、Dox を投与して TDP-43 の発現を停止させたところ、ミクログリアが一時的に増殖し、形態と遺伝子発現が変化し、細胞質の TDP-43 の除去が促進されることを発見しました。ミクログリアが減少すると、回復は弱まりました。 Hunter 氏らは、進行期と回復期におけるトランスクリプトーム解析を行い、発現量が変化した遺伝子が走化性、貪食、炎症、神経保護因子の産生に関連していることを発見しました 。Swanson 氏らは、ミクログリアは病気の初期段階では貪食性であり、後期には機能不全の状態へと移行し、これらの機能状態はリン酸化 TDP-43 の凝集によって引き起こされることを発見しました。
脊髄では、 Spiller 氏らは、遅筋ニューロンは回復力がある一方で、速筋疲労性ニューロンは失われ、軸索の委縮は速筋線維から最初に起こり、遅筋線維は神経支配されたままであることを発見しました。 マウスモデルにおけるこれらの発見は、ヒトの疾患における運動ニューロン変性の選択的パターンを反映しています。
Walker 氏らは、早期から進行性の神経筋接合部(NMJ)の著しい脱神経を報告しています 。Hur 氏らは、運動ニューロンの特異性が、NMJ の TDP-43 病理に対する感受性を左右すること、また、遅筋運動ニューロンは、TDP-43 関連神経変性に対する回復力として、運動系の回復を促進することを証明しました 。Spiller 氏らの論文を含む複数の論文では、複合筋活動電位(CMAP)振幅の減少が報告されています。
筋障害に関しては、筋線維における筋力低下、線維束性萎縮、中心核の存在が確認されており、また、Walker氏らにより腓腹筋および前脛骨筋における筋肉量の減少が報告されています。 Tsitkanou らは、前脛骨筋、大腿四頭筋、横隔膜の神経が遮断された筋線維において、TDP-43 の細胞質への蓄積とオリゴ A11 およびベータ・アミロイドを発見しました。また、前脛骨筋、大腿四頭筋、および腓腹筋の萎縮、筋原性および神経筋接合部(NMJ)ストレスのマーカーの上昇、運動機能および筋力の低下、ミトコンドリア複合体に関連するいくつかのタンパク質の機能異常も確認されました。
私たちのグループは、非侵襲的なコンピュータ断層撮影(CT)画像を用いて、私たちの「低用量ドキソルビシン」マウスモデルにおける後肢の腓腹筋に最も顕著な選択的筋萎縮を明らかにしました。
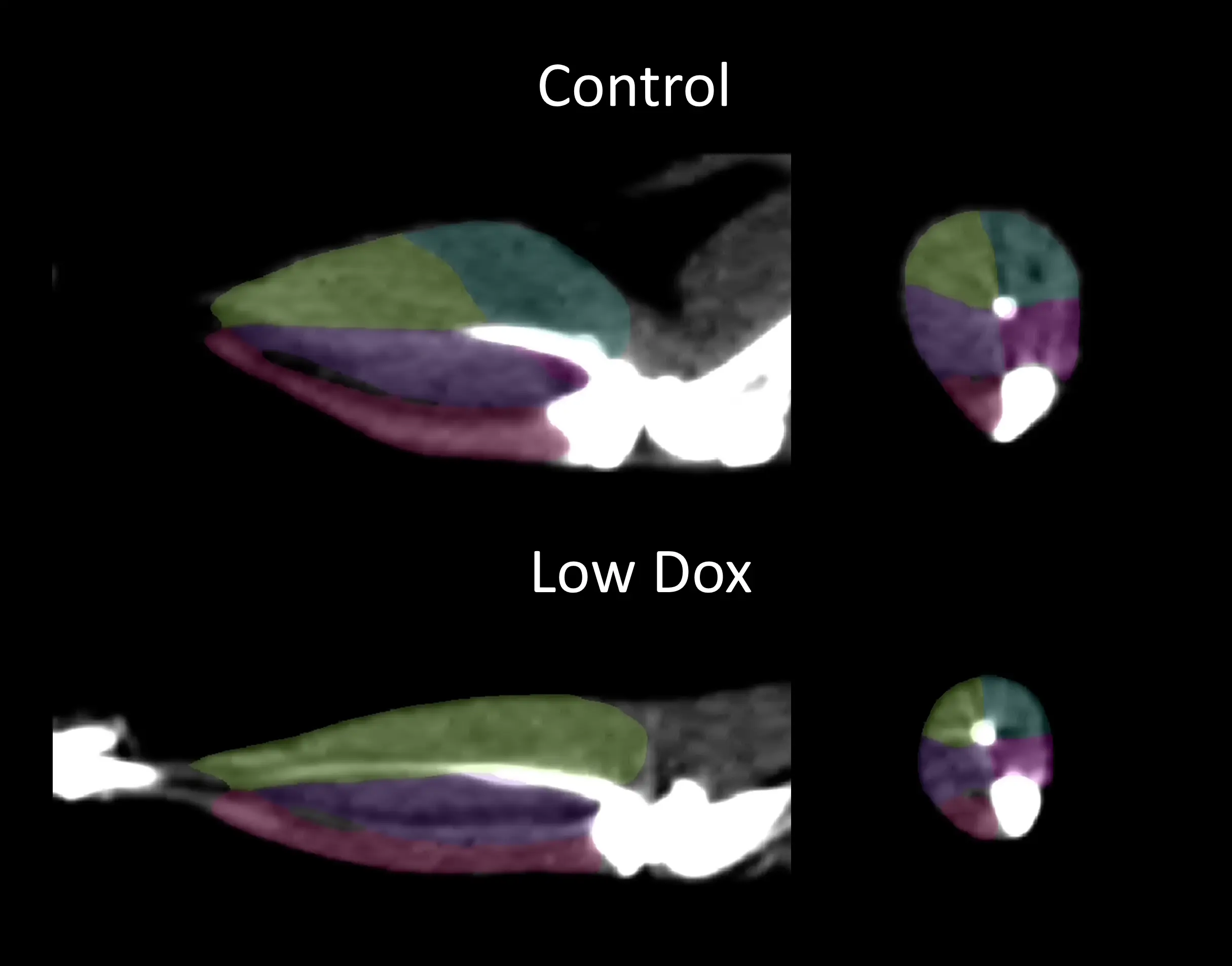
コントロール(Dox投与)および「低Dox」TDP-43 ΔNLSマウスの後肢筋のセグメンテーションによるCT画像。内側腓腹筋=青、外側腓腹筋=黄、後脛骨筋=紫、前脛骨筋=ピンク、ヒラメ筋=マゼンタ。
コントロールおよび「低Dox」TDP-43 ΔNLSマウスの内側(青)および外側(黄色)の腓腹筋の3Dボリュームレンダリング。
TDP-43ΔNLS ALS マウスモデルにおける治療効果の評価にはどのような方法が用いられてきましたか?
このマウスモデルにおいて、治療介入による疾患修飾を示した研究グループがいくつかあります 。Young 氏らは、低分子の PIKfyve 阻害剤である AIT-101(INN:アピリモド、別名 LAM-002A)が、Biospective社のrNLS8モデルのLow Doxバージョンにおいて、体重減少の抑制、運動障害(後肢の抱え込み、後肢の麻痺、グリル敏捷性を含む)の軽減、それに伴う血漿および脳脊髄液中の神経フィラメント軽鎖(NfL)レベル、TDP-43凝集体(免疫組織化学法)、神経炎症(GFAP免疫組織化学法)の低下が認められました。
Stomakhina 氏らは、VRG50304 を 28 日間投与した rNLS8 マウスの尾状皮質において、血漿および脳脊髄液中の軽鎖ニューロフィラメント(NfL)レベルの低下、および酸性スフィンゴミエリナーゼ(ASM)活性の低下を認めました。 ドロップマンらは、rNLS8モデルにAAV9/NF242のrhoグアニンヌクレオチド交換因子(RGNEF)のN末端フラグメントを脳室内に注入したところ、寿命と運動表現型(後肢の抱え込み、オープンフィールド、歩行(CatWalk))が改善し、神経炎症マーカー(GFAPおよびIba-1)が減少したことを発見しました。
TDP-43 ΔNLS ALS マウスモデルに関するご質問や、治療効果研究で使用するモデルに関する特定の情報提供など、ご要望がございましたら、当社のチームが喜んで対応させていただきます。
ALSモデルについてさらに詳しく知る
関連コンテンツ
筋萎縮性側索硬化症に関する最新情報と、ALS動物モデルにおける治療薬の評価に関するベストプラクティス。
神経筋接合部(NMJ)の形態と筋萎縮性側索硬化症(ALS)モデル
神経筋接合部(NMJ)の構造、筋萎縮性側索硬化症(ALS)におけるその役割、NMJの形態学的変化の研究に使用されるツールと方法についての洞察。
ALSマウスモデルと脊髄運動ニューロン
筋萎縮性側索硬化症(ALS)のマウスモデルにおける脊髄運動ニューロンと疾患進行の関わりについての概要。
ALSマウスモデルを用いた創薬
治療薬の前臨床試験における筋萎縮性側索硬化症(ALS)の研究用動物モデル(マウスおよびラットモデル)の最も効果的な使用方法についてのガイド。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。