什么是EAE?
实验性自身免疫性脑脊髓炎(EAE)是一种主要由T辅助细胞侵入中枢神经系统(CNS)引发的自身免疫性疾病。该病症导致中枢神经系统发生炎症、脱髓鞘及神经退行性病变,并伴随血脑屏障(BBB)的早期破坏(Robinson, 2014;Terry, 2016;Dhaiban, 2021)。
EAE是研究多发性硬化症(MS)的关键动物模型之一。我们对MS的多数认知源于EAE相关研究,该模型探索的治疗方案常能转化应用于人类。值得注意的是,EAE在病理表现上与人类MS进展存在相似性,其组织病理学损伤特征包括神经炎症、胶质细胞增生、脱髓鞘及轴突损伤(Robinson, 2014;Terry, 2016;Hasselmann, 2017)。
参见资源库:轴突损伤 & 实验性自身免疫性脑脊髓炎 & 脱髓鞘 & 杯状吡啶模型中的再髓鞘化
除EAE外,研究者还采用多种其他模型研究MS,例如由胭脂红和溶脂质等毒素诱发的脱髓鞘模型。由于MS的复杂性,目前尚无单一模型能全面涵盖其所有特征(Robinson, 2014;Melamed, 2022)。
EAE模型
EAE模型的靶点是少突胶质细胞表达的蛋白质,这些细胞负责中枢神经系统(CNS)的髓鞘生成。该模型可导致轴突束原发性脱髓鞘、轴突传导受损及后肢进行性瘫痪。
EAE主要通过两种途径诱导(Constantinescu, 2011;Khan, 2014;Robinson, 2014;Terry, 2016;Hasselmann, 2017):
- 主动免疫接种髓鞘衍生的蛋白质或肽段。主动EAE免疫接种可采用多种致脑炎表位,包括:
- 脑脂蛋白致脑炎表位(PLP139-151,PLP178-191,PLP56-70)
- 髓鞘基本蛋白(MBP84-104,MBP12-26)
- 髓鞘少突胶质细胞糖蛋白(MOG92-106、MOG35-55、MOG1-20、MOG1-125)
- 这些蛋白质/肽可与完全弗氏佐剂(CFA)乳化,以增强免疫反应。
- 被动转移活化的CD4+ T细胞。
- 从免疫供体小鼠中收集靶向髓鞘抗原的致脑炎性CD4+ T细胞,在培养中激活后注入受体小鼠体内。该方法有助于开发针对特定T细胞群(如Th1、Th17)的治疗方案。
根据动物物种或品系、靶向蛋白及免疫途径的不同,EAE可呈现多种病理形态。小鼠模型常用品系包括SJL(瑞士吉姆·兰伯特)(H-2s)、C57BL/6(H-2b)、PL/J及B10.PL(H-2u)。大鼠模型常选用Lewis系和大鼠暗色系。灵长类动物(如松鼠猴)因与人类亲缘关系密切亦被用作模型(Linker, 2009;Khan, 2014;Robinson, 2014;Terry, 2016;Melamed, 2022)。
小鼠EAE的典型临床进程如下(Robinson, 2014;Hasselmann, 2017):
- 持续10-15天的前驱期。
- 自尾部及后肢开始的上升性麻痹。
- 瘫痪进展蔓延至前肢。
- 急性期体重减轻15-20%。
- 慢性期通常在诱导后约30天开始。
- 不同动物模型呈现独特的疾病特征。例如:
- SJL小鼠(PLP139-151,MOG92-106)呈现复发缓解型(RR)病程。
- C57BL/6小鼠(MOG35-55)多呈慢性进行性病程。
- PL/J与B10.PL小鼠均呈现急性复发缓解型病程。
- 为监测神经损伤的发生、进展及恢复情况,研究人员采用EAE评分量表——该临床评分系统针对EAE诱导动物,采用0至5分的量化标准。
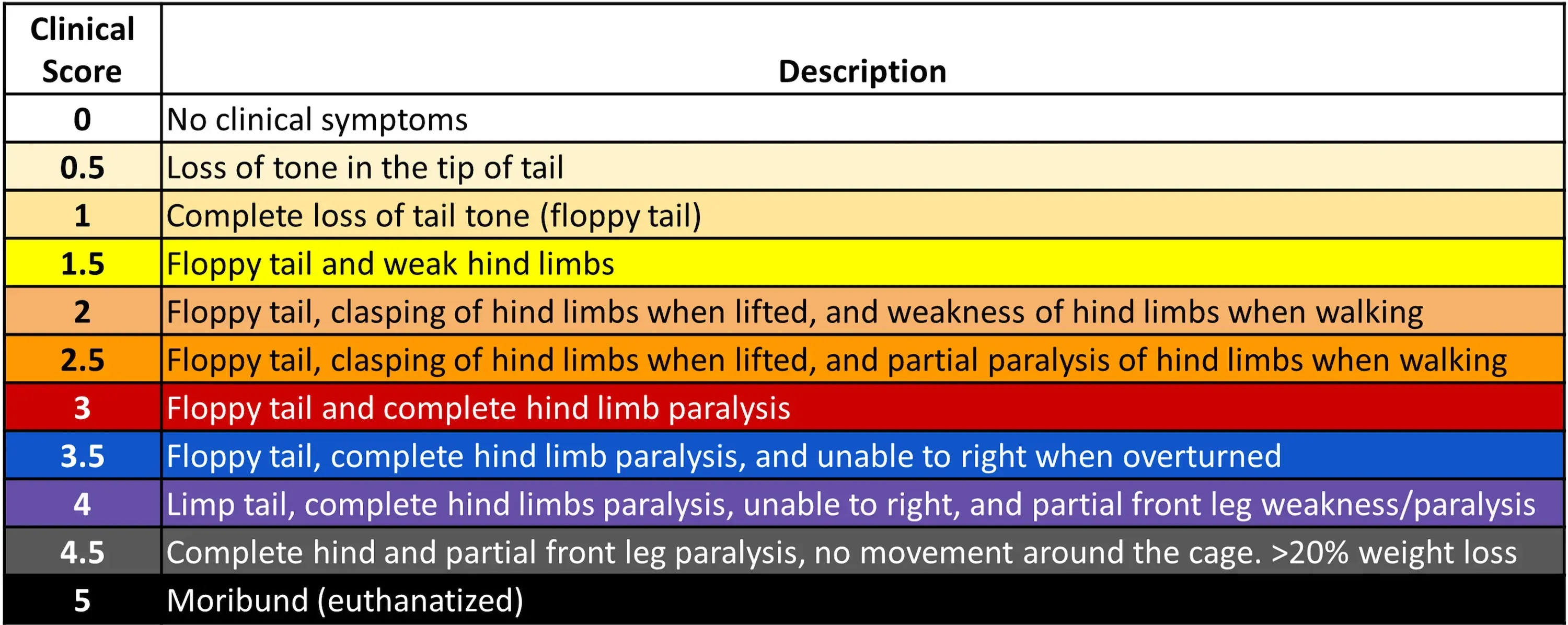
EAE评分系统
EAE涉及哪些病理生理学机制?
免疫组织化学和免疫荧光技术为疾病的病理特征和进展提供了宝贵的见解。EAE的病理生理学涉及多种免疫细胞和胶质细胞之间的复杂相互作用。
CD4+ T淋巴细胞(Linker, 2009;Shin, 2012;Duffy, 2014;Robinson, 2014)
- 最初认为Th1细胞是引发炎症的唯一因素。
- 在EAE模型中,中枢神经系统病变区域同时存在Th1和Th17细胞。由IL-23驱动的Th17细胞与Th1细胞共同参与EAE的发病过程,尽管其产生的细胞因子并非疾病发作的必要条件(Th1:IFN-γ和TNF-α;Th17:IL-17-A、IL-17-F、IL-22)。
- Th1和Th17细胞通过脱髓鞘和炎症机制导致轴突损伤,其具体作用机制因动物品系和免疫方法而异。
- Th1细胞确实具有致病性,而Th2细胞则参与免疫调节。
- 分泌TGF-β和IL-10的调节性T细胞(Tregs)维持着自身耐受性。其功能障碍与MS的进展有关,而其活性在特定EAE模型中可能支持自发性恢复。
CD8+ T淋巴细胞( Linker, 2009;Duffy, 2014;Robinson, 2014)
- 尽管EAE主要作为CD4+ T细胞模型,但CD8+ T细胞和B细胞也参与该病理过程。
- CD8+ T细胞与小胶质细胞、巨噬细胞共同存在于MS病灶中,兼具致病性与调节性功能。
- CD8+细胞毒性淋巴细胞可能直接损伤髓鞘和轴突。虽然它们可能通过中枢神经系统浸润诱导EAE,但其确切作用尚不完全明确。
B细胞( Robinson, 2014;Dedoni, 2023)
- B细胞通过作为抗原呈递细胞并产生抗髓鞘抗体,促进病灶形成。
- 当接种MOG1-125抗原时,B细胞对EAE的发生至关重要
- B细胞还与树突状细胞共同参与T细胞活化,并能在RR型EAE小鼠中枢神经系统内形成异位生发中心。
- 分化的B细胞可能释放促进T细胞分化的细胞因子。
- 在脑脊液(CSF)中检测到免疫球蛋白的产生。
病理学结果
- 血脑屏障破坏:Th17细胞产生的IL-17作用于内皮细胞,导致维持屏障完整性的紧密连接破坏。这种通透性增加使T细胞、B细胞和巨噬细胞得以渗入(Shin, 2012;Duffy, 2014;Dhaiban, 2021)。
- 炎症与脱髓鞘:免疫细胞向中枢神经系统的浸润引发局部炎症和水肿,导致轴突周围的髓鞘结构破坏(Robinson, 2014;Toader, 2018)。
- 轴突损伤:脱髓鞘病变伴随广泛轴突损伤,显著加剧神经功能缺损的进展(Robinson, 2014;Hasselmann, 2017)。
- 胶质细胞增生:星形胶质细胞对炎症和组织损伤作出反应性激活,最终形成胶质瘢痕(Toader, 2018)。
- 线粒体功能障碍:线粒体功能异常促进一氧化氮自由基生成,影响实验性自身免疫性脑脊髓炎(EAE)发病机制。部分多发性硬化症(MS)患者的线粒体功能障碍与皮质病变存在相关性(Dutta, 2006)。
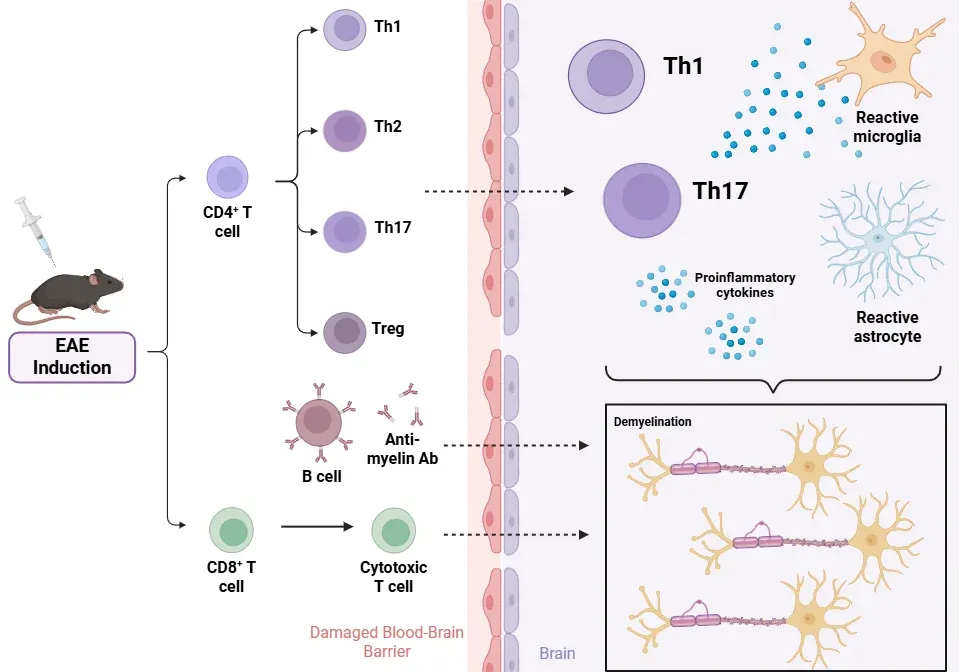
实验性自身免疫性脑脊髓炎的病理生理学
阳性对照在采用EAE模型的临床前研究中发挥什么作用?
阳性对照在EAE研究中不可或缺,既能验证实验模型对已知有效治疗手段的响应能力,又能为新型治疗药物提供可靠的对照基准(Robinson, 2014;Melamed, 2022)。以下是EAE研究中常用的关键阳性对照:
慢性与复发缓解型实验性自身免疫性脑脊髓炎的临床病程及阳性对照的影响
地塞米松( Donia, 2010;Nam, 2021)
- 一种糖皮质激素,用于治疗多发性硬化症(MS)患者的急性复发,并作为标准阳性对照,在实验性自身免疫性脑脊髓炎(EAE)模型中展现出免疫抑制和抗炎作用。
- 该药物与胞浆内糖皮质激素受体结合,受体随后转运至细胞核调节基因表达。此作用可抑制促炎通路(如NF-κB通路),同时激活抗炎基因。
- 该药物能保护髓鞘和轴突,抑制外周免疫细胞(CD45+)的浸润,并延缓疾病早期小胶质细胞和星形胶质细胞的激活。
- 地塞米松显著延迟EAE的临床发病时间,并减轻疾病的峰值严重程度。
- 地塞米松的保护作用具有暂时性,且可能产生糖皮质激素耐受性。
芬戈莫德(Fingolimod)(Webb, 2004;Choi, 2011;Constantinescu, 2011;Robinson, 2014;Melamed, 2022)
- 芬戈莫德是首个获FDA批准的口服多发性硬化症疾病修饰治疗(DMT),在EAE模型中表现出高度有效性。
- 芬戈莫德可作为阳性对照,用于测试针对白细胞迁移、淋巴器官细胞迁移或鞘氨醇-1-磷酸受体1(S1P₁)信号通路的疗法。
- 其主要作用机制涉及FTY720磷酸化转化为活性形式FTY720-P。该分子促使淋巴细胞上的S1P₁受体内化,将其困于次级淋巴器官内,阻止其向中枢神经系统迁移。芬戈莫德同时影响中枢神经系统星形胶质细胞上的S1P₁受体。
- 芬戈莫德几乎完全阻止了Lewis大鼠中EAE的发生。
干扰素-β(IFN-β)(Constantinescu, 2011;Robinson, 2014)
- 作为多发性硬化症的一线注射型疾病修饰治疗药物,IFN-β在EAE模型中充当免疫调节疗法的阳性对照,旨在调节细胞因子平衡(尤其针对Th1和Th17细胞)。
- IFN-β通过限制体内IFN-γ(来自Th1细胞)和IL-17(来自Th17细胞)的促炎反应,减轻EAE的症状、进展和发病。
那他珠单抗( Constantinescu,2011;Robinson,2014)
- 那他珠单抗是一种针对α4β1整合素(VLA-4)的单克隆抗体。它阻断淋巴细胞与血管的粘附,防止其进入中枢神经系统。
- 该药物可作为针对白细胞迁移和中枢神经系统浸润疗法的阳性对照。
醋酸格拉替雷( Schrempf, 2007;Constantinescu, 2011;Moore, 2014;Robinson, 2014)
- 醋酸格拉替雷是髓磷脂(MBP)的合成类似物,由多种多肽组成,可调节T细胞的免疫反应并促进少突胶质细胞前体细胞的存活。
- 研究表明该药物可使复发性多发性硬化症(RR-MS)的复发率降低约30%。
富马酸二甲酯(DMF)(Dhaiban, 2021;Melamed, 2022)
- DMF是FDA批准的口服DMT,在EAE模型中显示出疗效。
- 该药物可调节Th1和Th2反应,抑制促炎性细胞因子,并增强自然杀伤细胞功能。
EAE模型为脱髓鞘机制提供了宝贵见解,尤其在脊髓受累方面。尽管其主要关注脊髓脱髓鞘(与MS中更广泛的大脑和小脑病变不同),但仍是理解疾病进展的有效工具。此外,尽管EAE研究重点突出CD4+ T细胞,但最新研究日益认识到CD8+细胞毒性T细胞在MS中的重要性。这种视角的转变表明,通过优化EAE研究衍生的治疗策略,有望实现向MS临床应用的更好转化。神经科学领域持续的探索将推动我们对该疾病的认知深化及治疗方案的拓展。
我们的团队很乐意解答关于EAE模型的任何疑问,或提供我们用于治疗有效性研究的具体模型信息。
相关内容
关于多发性硬化症的最新信息,以及在MS动物模型中评估治疗药物的最佳实践。
Cuprizone模型中的脱髓鞘和髓鞘再生
概述了在多发性硬化症(MS)的铜氰化物脱髓鞘小鼠模型中测量髓磷脂和少突胶质细胞的方法。
实验性自身免疫性脑脊髓炎(EAE)和轴索损伤
本资源描述了在多发性硬化症(MS)EAE模型中测量轴突损伤和轴突变性的可用方法,包括组织标记物以及血浆和脑脊液神经丝轻链(NfL;NF-L)水平。
线粒体功能障碍在小胶质细胞与星形胶质细胞中的作用
线粒体功能障碍在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩侧索硬化症)中对小胶质细胞和星形胶质细胞的作用。