什么是铜绿假单胞菌引起的多发性硬化脱髓鞘模型?
多发性 硬化症(MS)是一种中枢神经系统(CNS)的慢性、自身免疫性脱髓鞘疾病,全球有超过280万人受其影响(Walton,2020)。在多发性硬化症研究中 ,人们使用各种临床前模型来复制 疾病 的不同方面, 包括脱髓鞘模型,例如溶血卵磷脂(LPC)小鼠和大鼠模型以及 铜试剂小鼠模型(Dedoni,2023)。
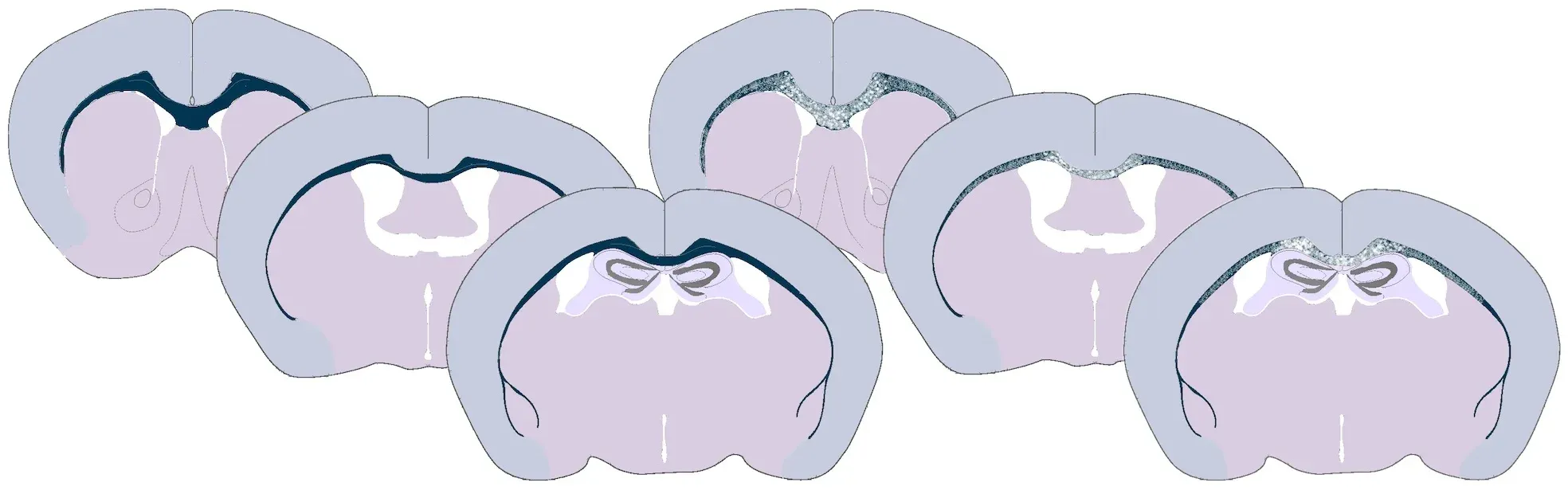
铜氰化物喂养小鼠的胼胝体脱髓鞘示意图。左侧为正常髓鞘化的胼胝体,右侧为部分脱髓鞘的白质束。
铜试剂模型 是一种广泛使用的毒素诱导型多发性硬化模型(Kipp,2024 ;Zhan,2020)。铜试剂 (C14H22N4O2)或 草酸双[环己亚基酰肼] 是一种铜螯合剂,当口服时,可诱导成熟少突胶质细胞死亡,并 随后 导致 啮齿动物大脑 中特定白质束脱髓鞘 (Dedoni,2023)。该模型涉及激活大脑中的先天免疫细胞,但T和B淋巴细胞并不起核心作用(Wolf,2018),因此与其他涉及适应性免疫系统的MS模型 (如 实验性自身免疫性脑脊髓炎(EAE)、泰尔氏小鼠脑病病毒(TMEV) 和其他病毒性MS模型)有所不同 (Dedoni,2023)。铜氰化物诱导的脱髓鞘并不依赖于淋巴细胞,甚至在淋巴细胞缺陷重组激活基因(Rag)敲除小鼠中也会发生(Hiremath,2008)。
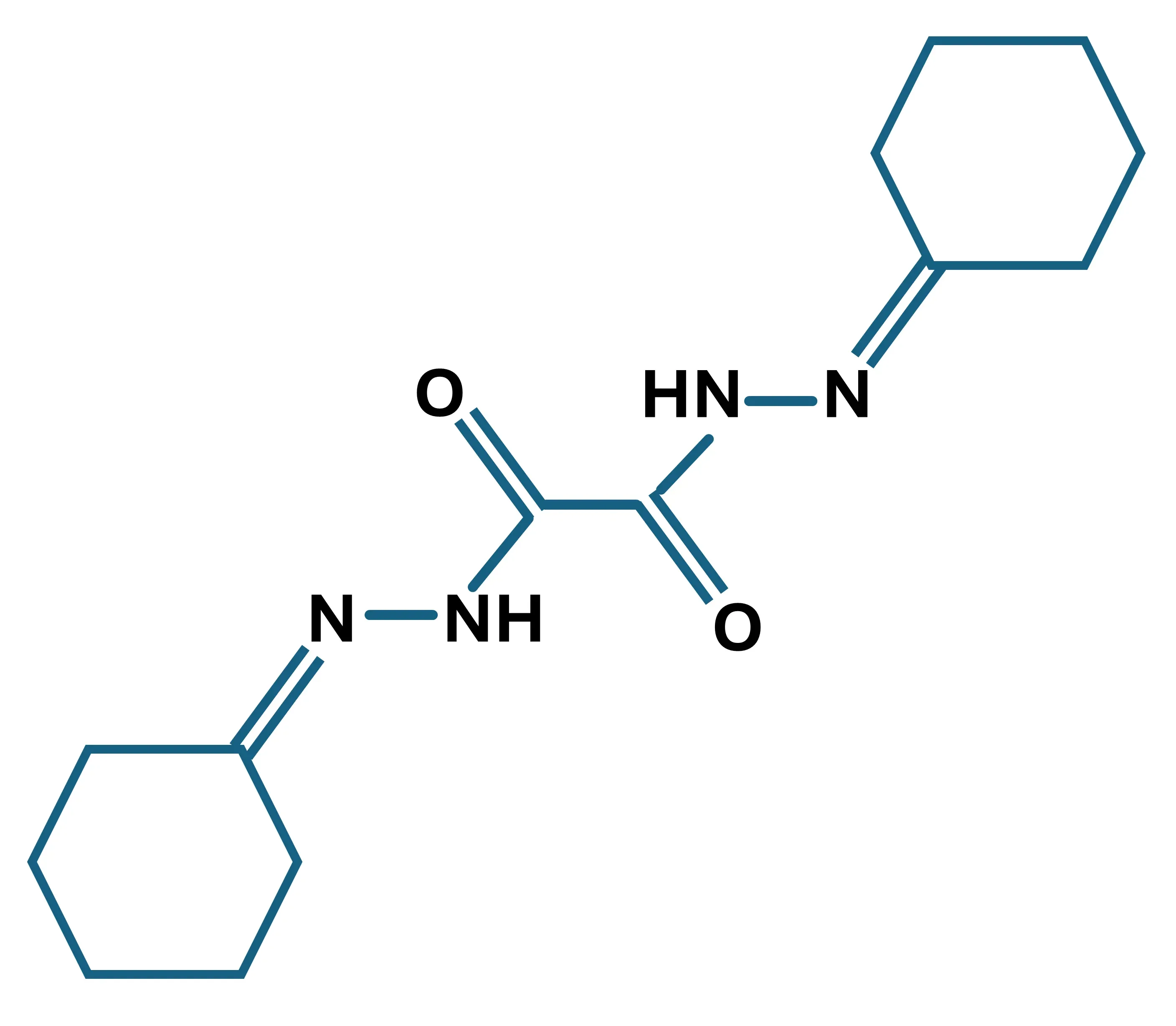
铜试剂的分子结构;C14H22N4O2; 分子量:278.45 g/mol
铜绿模型使研究人员能够剖析和调查MS进展中的特定机制。这种啮齿动物模型可分为两个阶段 : ( 1)胼胝体和其他脑区(如小脑上脚和大脑皮层)的初始脱髓鞘(Vega-Riquer,2019),伴随先天性免疫系统的激活;(2)铜氰酸盐治疗终止后,暴露的轴突发生明显的再髓鞘化(Gharagozloo,2022)。
在实践中,小鼠被喂食铜试剂5-6周。这种方法会导致选择性少突胶质细胞应激和死亡,导致不同脑区的急性脱髓鞘、广泛的小胶质细胞活化和星形胶质细胞增殖、轴突运输机制的崩溃(Rühling,2019),以及在更慢性的模型中,明显的轴突损伤(Lindner,2009)。少突胶质细胞变性的确切机制尚未完全清楚,但可能包括铜绿假单胞菌引起的铜缺乏导致的线粒体破坏、铁死亡(Jhelum,2020)和内质网应激反应。
铜试剂的作用时间轴有据可查。在治疗的第一周内,最早可在治疗开始两天后观察到少突胶质细胞死亡。星形胶质细胞(Kipp,2023)和小胶质细胞(Gudi,2014)会提前激活,随后成熟少突胶质细胞迅速减少,到第二天减少约65%,到第一周末减少约80%(Kipp,2023)。在中间阶段,即1至3周内,少突胶质细胞继续减少,胶质细胞继续激活,脱髓鞘和急性轴突病理的迹象变得明显(Crawford,2009 ;Kipp,2023)。
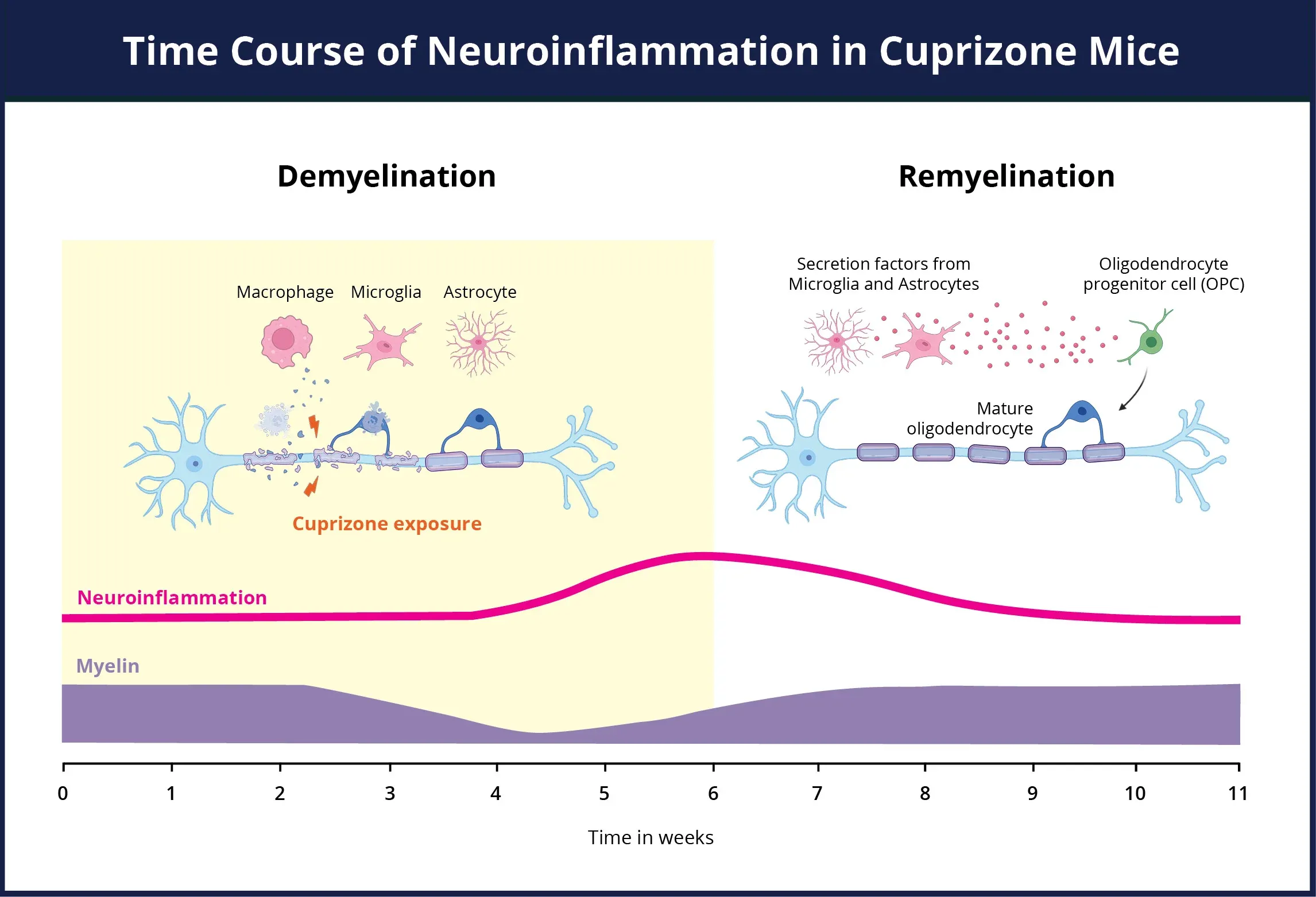
铜汞化合物模型的神经炎症时间进程概述。在铜汞化合物暴露期间,髓鞘(紫色)同时丢失,活化的小胶质细胞和反应性星形胶质细胞(粉色)数量急剧增加,导致神经炎症状态。星形胶质细胞和小胶质细胞在清除髓鞘碎片以及激活少突胶质细胞祖细胞方面发挥着积极作用。 在 铜氰酸盐刺激消除和轴突髓鞘再生后,神经炎症得以缓解。
点击复制链接
3到5周后,脱髓鞘现象变得明显,而少突胶质细胞被激活并募集来替代丢失的少突胶质细胞(Brousse,2015)。运动协调和行为缺陷(主要表现在空间记忆和社会行为方面)变得明显(Franco-Pons,2007)。在此阶段,如果用标准饮食代替含铜试剂饮食,脱髓鞘过程就会停止,并发生髓鞘再生。
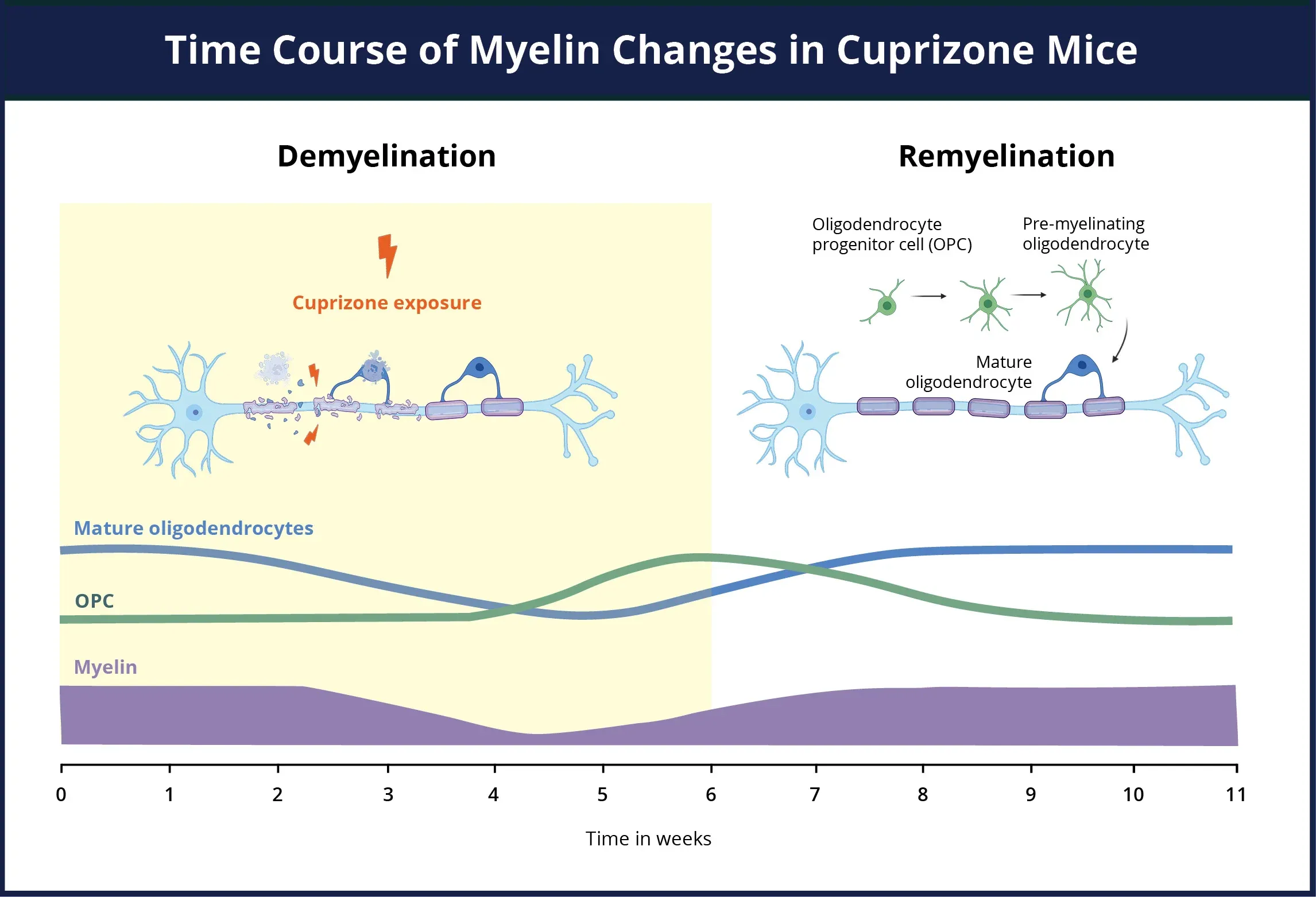
铜汞齐模型脱髓鞘和髓鞘再生的时间轴概览。在铜汞齐暴露期间,髓磷脂(紫色)同时丢失,成熟少突胶质细胞(蓝色)死亡,少突胶质细胞祖细胞(绿色)向髓鞘前体细胞(OPCs)的增殖和分化急剧上升。即使在铜氰酸盐仍然存在的情况下,少突胶质细胞前体细胞也会在组织受损部位迁移并分化。当铜氰酸盐不再产生影响时,少突胶质细胞前体细胞会迅速分化成成熟的少突胶质细胞,开始对暴露的轴突进行髓鞘再生。
点击复制链接
如果治疗时间超过12周,脱髓鞘就会变成慢性,OPC细胞耗竭,髓鞘再生的可能性大大降低(Lindner,2009)。大量研究表明,长期接触 铜氰化物会导致慢性病变,表现出有限的内源性髓鞘再生能力(Leo,2022)、长期星形胶质细胞增生(Hibbits,2012)以及更广泛的轴突损伤(Lindner,2009)。总之,铜氰化物模型是多发性硬化症研究中的关键工具,因为它可以复制疾病的关键方面,特别是少突胶质细胞变性及其导致的脱髓鞘。了解铜氰化物诱导损伤的时间表和机制对于开发多发性硬化症靶向治疗干预措施至关重要。
评估铜氰化物小鼠脱髓鞘和髓鞘再生的最常用方法是什么?
为了有效研究和理解脱髓鞘和髓鞘再生的过程,采用可靠的技术检测中枢神经系统(CNS)内的髓鞘以及脱髓鞘和髓鞘再生过程至关重要。实验组织中髓鞘的可视化可以通过组织学和免疫组织化学(IHC)技术完成。通过电子显微镜(EM)可以观察到髓鞘的 超 微结构,从而获得高分辨率图像。先进的非侵入性 体内 成像技术,如磁共振成像(MRI),可以深入了解正在发生的过程。虽然这些技术都可以促进对与髓鞘相关的疾病的深入了解,但它们各有优缺点,如下所述。
组织化学染色
有多种组织化学技术可用于评估铜氰化物小鼠的脱髓鞘和髓鞘再生。下面重点介绍几种常用的染色方法。
Luxol Fast Blue (LFB)
Luxol Fast Blue(LFB)是一种快速组织学染色剂,用于观察组织切片中的髓鞘。它能有效显示轴突脱髓鞘后的清晰空隙,有助于确定髓鞘受损程度。LFB法包括对组织进行过度染色,然后在碳酸锂中进行区分,以区分髓鞘化和脱髓鞘化区域。为了获得最佳染色效果,必须根据特定组织调整区分步骤。然而,这个过程会产生明显的批次差异,因此LFB不适合用于定量分析。
FluoroMyelin™ 和其他与髓磷脂结合的荧光染料
FluoroMyelin™ 染色剂是市售荧光染料,对髓磷脂具有选择性亲和力。这些染料已经开发出多种不同的荧光颜色,可用于在脑组织切片内与其他标记物结合,使髓磷脂可视化。此外,研究人员还开发了许多其他与髓磷脂有亲和力的荧光化合物。这些荧光髓磷脂结合化合物的缺点包括容易产生强烈的背景染色,染色对比度低且亮度通常较低,因此难以用于定量多重染色。
银染色
银染色是一种用于观察组织结构的非常灵敏的技术,但这是一个费力的过程,需要定制显影时间,从而导致批次间差异显著。虽然银染色非常灵敏,但其动态范围非常小,并且容易染上其他各种蛋白质结构,因此不适合定量分析。
甲苯胺蓝
甲苯胺蓝O是一种阴离子组织学染料,可与髓磷脂(以及其他结构)结合,从而详细显示髓磷脂包裹。它常用于外周神经,虽然有一定难度,但也可以用于中枢神经系统。组织制备过程非常费力,因为需要使用EPON树脂包埋,而且染色半薄(0.5-1μm)塑料包埋的组织切片时效果最佳。观察胼胝体内的髓磷脂需要仔细解剖,因为该过程最适合小组织样本,且切片必须与轴突垂直,才能有效观察髓磷脂鞘。该方法的缺点是耗时,且不能对同一组织进行免疫染色。此外,甲苯胺蓝O染色剂会与其他结构结合,因此仔细取样至关重要。
免疫组织化学(IHC)染色
在组织切片上使用髓磷脂碱性蛋白(MBP)、蛋白脂蛋白(PLP)和髓磷脂少突胶质细胞糖蛋白(MOG)等标记物进行免疫组织化学染色,对于识别与成熟少突胶质细胞突起和细胞体相关的髓磷脂鞘非常有效。 该 技术非常适合量化髓磷脂水平并显示髓磷脂损伤程度,但并不适用于计算髓磷脂生成细胞的数目。
免疫组织化学染色法可检测少突胶质细胞谱系标记物,如Olig2、PDGF-α受体(PDGFRα)和NKX2.2,从而深入了解少突胶质细胞前体细胞(OPC)的成熟和分化阶段。这些标记物通常位于细胞核或细胞体中,因此非常适合在OPC成熟和分化过程中计数和追踪细胞数量。Olig2是一种转录因子,对少突胶质细胞的增殖和分化至关重要。它表达于少突胶质细胞核中,并在成熟的少突胶质细胞中持续表达。PDGFRα是一种细胞表面受体,可与血小板衍生生长因子(PDGF)结合。它是早期少突胶质细胞的标志物,对它们的增殖和存活至关重要。随着OPC分化成成熟的少突胶质细胞,PDGFRα的表达通常会下调。NKX2.2是一种转录因子,在OPC分化成成熟的少突胶质细胞的过程中起着至关重要的作用。它表达于细胞核,参与调控少突胶质细胞成熟和髓鞘化所需的基因。
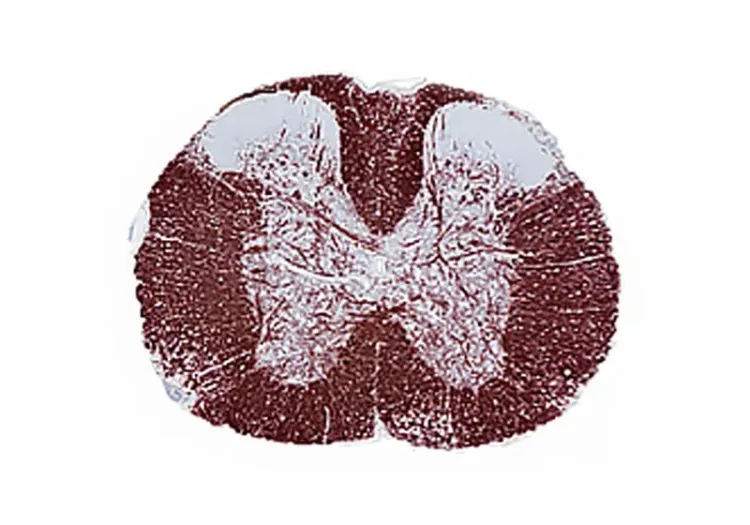
多组织切片中的髓磷脂碱性蛋白(MBP)免疫组织化学染色 ,突出了 暴露于 铜氰化物饮食 五周的小鼠胼胝体中线脱髓鞘 。
电子 显微镜(EM)
电子显微镜 能够提供 组织样本的超 高清图像,在细胞和亚细胞水平上呈现髓鞘结构和包裹的精细细节(Cruz-Martinez,2016)。它 被 用于 确定 有髓鞘轴突的g值,是区分发育中髓鞘轴突和再髓鞘轴突的绝佳技术。然而,它只能 对组织中的极 小区域进行采样 ,在铜氰酸盐模型中 ,它 无法帮助我们了解 整个胼胝体的 脱髓鞘或再髓鞘化的程度 。
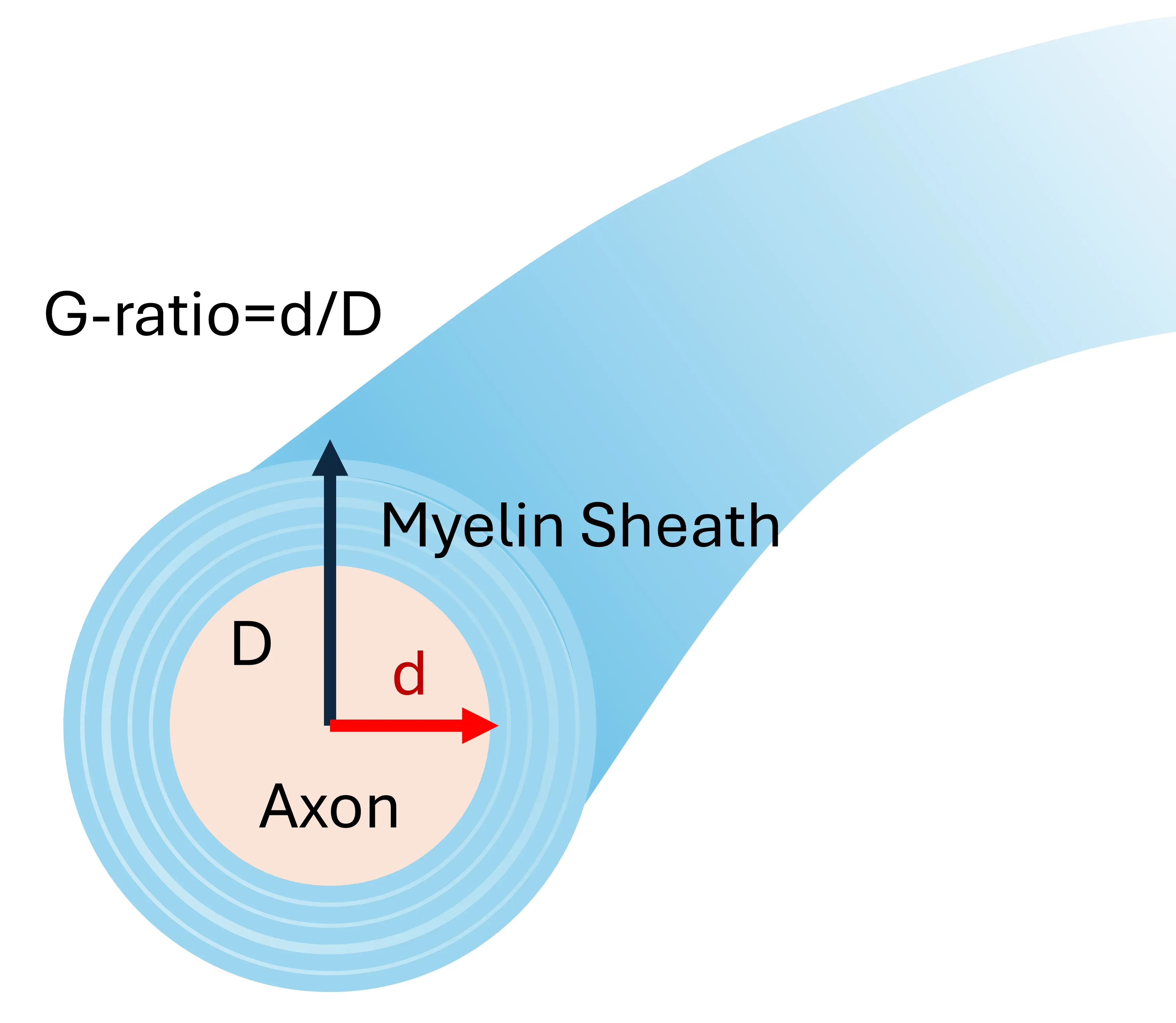
G值计算图
体内成像
由于水扩散具有组织特异性 ,临床前磁共振成像(MRI) 和弥散张量成像(DTI)可用于结构评估 。 髓鞘轴突表现出一种特有的受限定向DTI信号(Wang,2019)。这些技术可以作为活体评估,提供对髓鞘变化演变的洞察,并且从临床前功效研究到临床试验完全可转化(即转化生物标记物 )(Sommer,2022)。
磁化转移率(MTR)(Tagge,2016)是另一种MRI技术,通过测量游离水和大分子结合水之间的磁化转移来提供对髓磷脂含量的洞察。这种方法与DTI一样,可以作为活体评估进行,提供有关髓磷脂变化演变的宝贵信息。MTR也可以从临床前功效研究转化为临床试验(Sommer,2022)。
虽然MRI、DTI和MTR是强大的非侵入性、纵向、 体内评估工具,但它们无法进行微观评估,且可能受到水肿的影响,不过,鉴于血管源性水肿并不起主要作用,因此这个问题在铜氰化物模型中并不需要特别考虑。
在临床前疗效研究中,测量脱髓鞘和髓鞘再生有哪些实际考虑因素?
在药物研发过程中,使用铜氰化物模型进行临床前疗效研究时,需要考虑 的重要 事项包括确定干预和终点读数的合适时间窗口。干预时间需要考虑治疗药物的药代动力学(PK)和目标细胞类型 。
通常 ,治疗效果会改变脱髓鞘和髓鞘再生的速度,但最终模型会恢复到非常相似的最终髓鞘再生状态。因此,选择最合适的终点评估时机也至关重要。鉴于脱髓鞘和髓鞘再生过程发生在不同的时间段,应评估多个时间点,以捕捉这些过程的动态变化 。
选择 适当的病理评估对于生成客观且可重复的量化结果至关重要。确保组织制备和切片能够有针对性地将病理定位到胼胝体受影响最大的区域,这对于跨组比较非常重要 。
利用 活体成像技术 ,可以 最大 程度地了解脱髓鞘和髓鞘再生病变的演变和解决 。 扩散张量成像(DTI)和磁化转移成像(MTR)等技术可以深入了解白质的完整性。使用核磁共振成像(MRI)进行纵向研究可以在同一只动物身上进行重复测量,从而跟踪疾病进展和治疗效果 。
我们的团队非常乐意回答有关Cuprizone小鼠模型的任何问题,或提供有关我们用于疗效研究的MS模型的具体信息。
了解更多关于玛莎拉蒂模型的信息
相关内容
多发性硬化症的最新信息以及与MS动物模型治疗剂评估相关的最佳实践。
实验性自身免疫性脑脊髓炎(EAE)和轴索损伤
本资源描述了在多发性硬化症(MS)EAE模型中测量轴突损伤和轴突变性的可用方法,包括组织标记物以及血浆和脑脊液神经丝轻链(NfL;NF-L)水平。