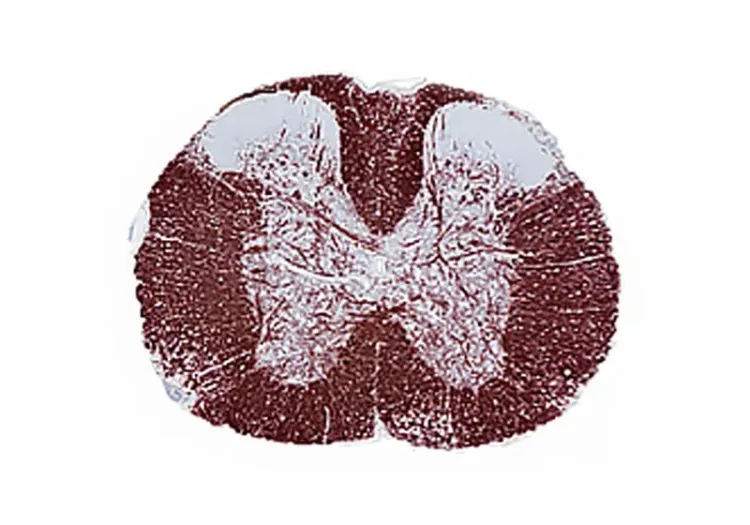
Qu'est-ce que l'EAE?
L'encéphalomyélite auto-immune expérimentale (EAE) est une maladie auto-immune principalement causée par des lymphocytes T auxiliaires qui envahissent le système nerveux central (SNC). Cette affection entraîne une inflammation, une démyélinisation et une neurodégénérescence du SNC, ainsi qu'une perturbation précoce de la barrière hémato-encéphalique (BHE) (Robinson, 2014; Terry, 2016; Dhaiban, 2021).
L'EAE est l'un des principaux modèles animaux utilisés pour étudier la sclérose en plaques (SEP). Une grande partie de notre compréhension de la SEP provient d'études portant sur l'EAE, et les traitements explorés dans ce modèle sont souvent transposés à des applications humaines. Il convient de noter que l'EAE présente certaines similitudes avec la progression de la SEP chez l'homme, se manifestant par des lésions histopathologiques caractérisées par une neuroinflammation, une gliose, une démyélinisation et une lésion axonale (Robinson, 2014; Terry, 2016; Hasselmann, 2017).
Veuillez vous référer à nos ressources : Lésion axonale et encéphalomyélite auto-immune expérimentale, démyélinisation et remyélinisation dans le modèle Cuprizone
Outre l'EAE, les chercheurs utilisent divers autres modèles pour étudier la SEP, tels que les modèles de démyélinisation déclenchés par des toxines comme le cuprizone et la lysolécithine. En raison de la complexité de la SEP, aucun modèle ne peut à lui seul en saisir tous les aspects (Robinson, 2014; Melamed, 2022).
Voir : Modèles murins de sclérose en plaques (SEP) à la cuprizone
Modèles EAE
Les modèles EAE ciblent les protéines exprimées par les oligodendrocytes, qui sont responsables de la production de myéline dans le SNC. Ce modèle entraîne une démyélinisation primaire des voies axonales, une altération de la conduction axonale et une paralysie progressive des membres postérieurs.
L'EAE peut être induite de deux manières principales (Constantinescu, 2011; Khan, 2014; Robinson, 2014; Terry, 2016; Hasselmann, 2017):
- Immunisation active avec des protéines ou des peptides dérivés de la myéline. L'immunisation active contre l'EAE peut être réalisée avec plusieurs épitopes encéphalitogènes, notamment
- Épitopes encéphalitogènes de la protéine protéolipidique (PLP139-151,PLP178-191,PLP56-70)
- Protéine basique de la myéline (MBP84-104,MBP12-26)
- La glycoprotéine oligodendrocytaire de la myéline (MOG92-106,MOG35-55,MOG1-20,MOG1-125)
- Ces protéines/peptides peuvent être émulsionnés avec l'adjuvant complet de Freund (CFA) afin de renforcer la réponse immunitaire.
- Transfert passif de lymphocytes T CD4+ activés
- Les cellules T CD4+ encéphalitogènes ciblant les antigènes de la myéline sont prélevées sur des souris donneuses immunisées, activées dans une culture, puis injectées à des souris receveuses. Cette méthode est utile pour développer des thérapies ciblant des populations spécifiques de cellules T (par exemple, Th1, Th17).
Différentes formes pathologiques d'EAE apparaissent en fonction de l'espèce ou de la souche de l'animal, de la protéine cible et de la voie d'immunisation utilisée. Pour les modèles murins, les souches couramment utilisées sont SJL (Swiss Jim Lambert) (H-2s), C57BL/6 (H-2b), PL/J et B10.PL (H-2u). Pour les modèles de rats, les souches Lewis et Dark Agouti sont souvent utilisées. Les primates, tels que les ouistitis, sont également utilisés comme modèles en raison de leur proche parenté phylogénétique avec les humains (Linker, 2009; Khan, 2014; Robinson, 2014; Terry, 2016; Melamed, 2022).
Veuillez vous référer aux modèles murins EAE de la sclérose en plaques (SEP)
L'évolution clinique typique d'une souris atteinte d'EAE suit ce schéma (Robinson, 2014; Hasselmann, 2017):
- Une période prodromique d'une durée de 10 à 15 jours.
- Une paralysie ascendante qui commence au niveau de la queue et des membres postérieurs.
- Progression de la paralysie s'étendant aux membres antérieurs.
- perte de poids de 15 à 20 % pendant la phase aiguë.
- La phase chronique commence généralement environ 30 jours après l'induction.
- Différents modèles animaux présentent des caractéristiques uniques de la maladie. Par exemple
- Les souris SJL (PLP139-151,MOG92-106) présentent une évolution récidivante-rémittente (RR).
- Les souris C57BL/6 (MOG35-55) ont tendance à présenter une évolution chronique progressive.
- Les souris PL/J et B10.PL présentent toutes deux une évolution aiguë et récurrente de la maladie.
- Afin de surveiller l'apparition, la progression et la guérison des lésions neurologiques, les chercheurs utilisent le score EAE, une échelle clinique allant de 0 à 5, pour les animaux atteints d'EAE.
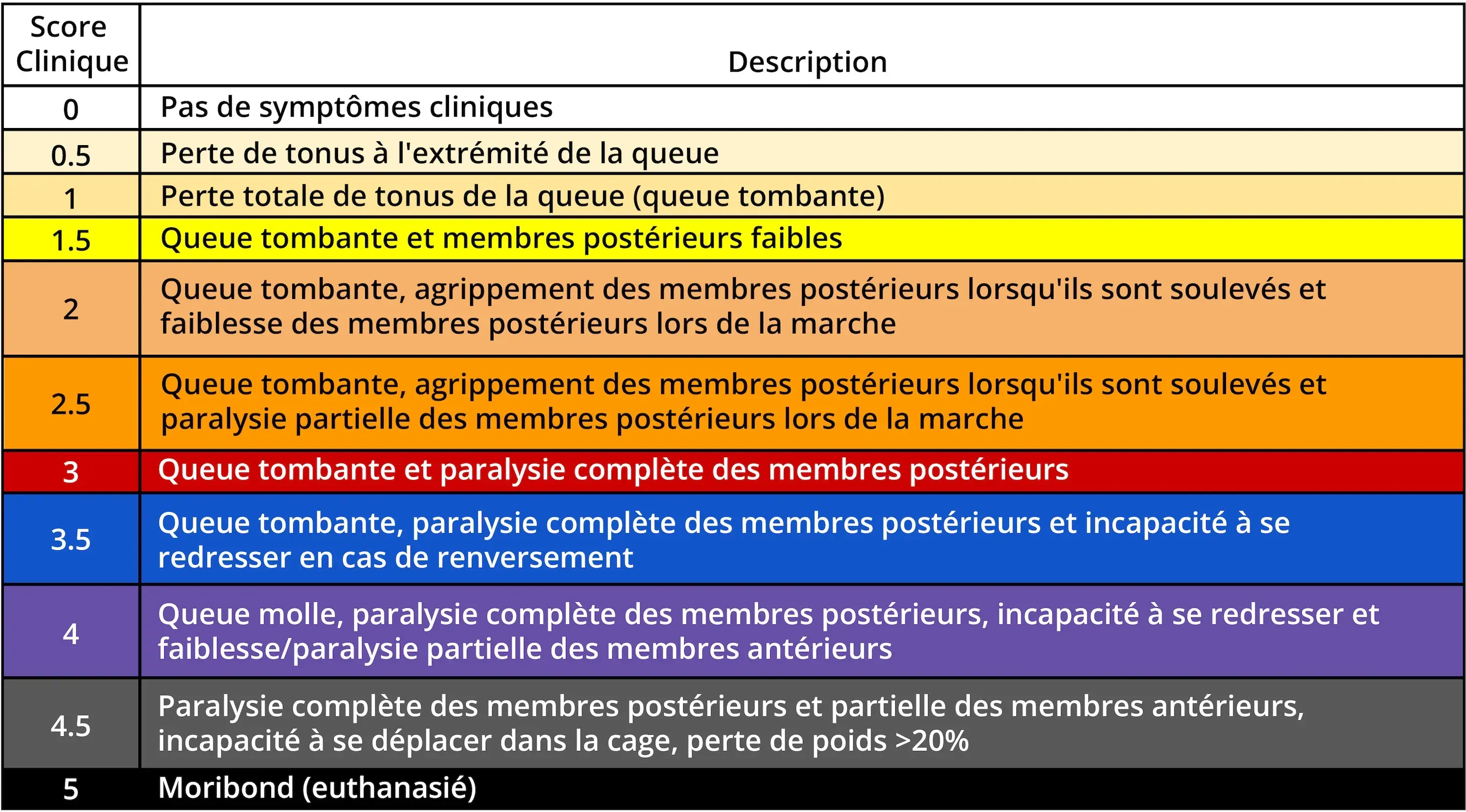
Système de notation EAE
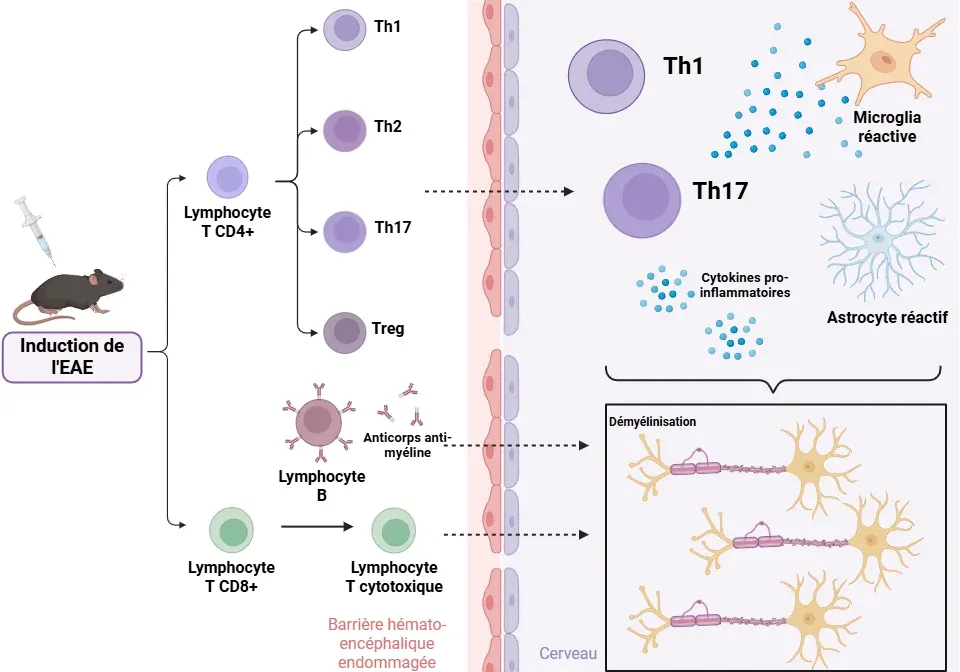
Quels sont les mécanismes physiopathologiques impliqués dans l'EAE?
Les techniques d'immunohistochimie et d'immunofluorescence fournissent des informations précieuses sur les caractéristiques pathologiques et la progression des maladies. La physiopathologie de l'EAE implique une interaction complexe entre diverses cellules immunitaires et gliales.
Lymphocytes T CD4+ (Linker, 2009; Shin, 2012; Duffy, 2014; Robinson, 2014)
- Au départ, on pensait que les cellules Th1 étaient les seules responsables de l'induction de l'inflammation.
- Les cellules Th1 et Th17 sont toutes deux présentes dans les lésions du SNC dans les modèles d'EAE. Les cellules Th17, stimulées par l'IL-23, ainsi que les cellules Th1, jouent un rôle important dans le développement de l'EAE, bien que les cytokines qu'elles produisent ne soient pas essentielles à l'apparition de la maladie (Th1: IFNγ et TNFα; Th17: IL-17-A, IL-17-F, IL-22).
- Les cellules Th1 et Th17 contribuent aux lésions axonales par le biais de mécanismes de démyélinisation et d'inflammation, qui peuvent varier en fonction de la souche animale et de la méthode d'immunisation.
- Alors que les cellules Th1 sont effectivement pathogènes, les cellules Th2 jouent un rôle dans l'immunorégulation.
- Les cellules T régulatrices (Treg), qui sécrètent du TGF-β et de l'IL-10, maintiennent l'autotolérance. Leur dysfonctionnement est lié à la progression de la SEP, tandis que leur activité peut favoriser la guérison spontanée dans certains modèles d'EAE.
Lymphocytes T CD8+ (Linker, 2009; Duffy, 2014; Robinson, 2014)
- Bien que l'EAE serve principalement de modèle pour les lymphocytes T CD4+, les lymphocytes T CD8+ et les lymphocytes B sont également impliqués dans cette pathologie.
- Les lymphocytes T CD8+ sont présents dans les lésions de la SEP aux côtés des microglies et des macrophages, où ils exercent à la fois des fonctions pathogènes et régulatrices.
- Les lymphocytes cytotoxiques CD8+ peuvent endommager directement les gaines de myéline et les axones. Bien qu'ils puissent induire une EAE par infiltration du SNC, leur rôle précis reste quelque peu incertain.
Cellules B (Robinson, 2014; Dedoni, 2023)
- Les lymphocytes B contribuent au développement des lésions en agissant comme des cellules présentatrices d'antigènes et en produisant des anticorps contre la myéline.
- Ils jouent un rôle essentiel dans l'apparition de l'EAE lorsqu'ils sont immunisés avec leMOG1-125
- Les cellules B jouent également un rôle dans l'activation des cellules T, avec les cellules dendritiques, et peuvent former des centres germinatifs ectopiques dans le SNC des souris RR EAE.
- Les cellules B différenciées peuvent libérer des cytokines qui facilitent la différenciation des cellules T.
- La production d'immunoglobulines a été détectée dans le liquide céphalo-rachidien (LCR).
Conséquences pathologiques
- Perturbation de la BHE: l'IL-17, produite par les cellules Th17, agit sur les cellules endothéliales, entraînant la rupture des jonctions serrées qui maintiennent l'intégrité de la barrière. Cette perméabilisation permet l'infiltration des cellules T, des cellules B et des macrophages (Shin, 2012; Duffy, 2014; Dhaiban, 2021).
- Inflammation et démyélinisation: l'infiltration de cellules immunitaires dans le SNC provoque une inflammation et un œdème locaux, entraînant la destruction de la gaine de myéline qui entoure les axones (Robinson, 2014; Toader, 2018).
- Lésion axonale: des lésions axonales étendues surviennent en conjonction avec des lésions démyélinisantes, qui contribuent de manière significative à des déficits neurologiques progressifs (Robinson, 2014; Hasselmann, 2017).
- Gliose: en réponse à l'inflammation et aux lésions tissulaires, les astrocytes deviennent réactifs et conduisent à la formation de cicatrices gliales (Toader, 2018).
- Dysfonctionnement mitochondrial: le dysfonctionnement mitochondrial contribue à la production de radicaux libres d'oxyde nitrique, affectant la pathogenèse de l'EAE. Il existe une corrélation entre le dysfonctionnement mitochondrial et les lésions corticales chez certains patients atteints de SEP (Dutta, 2006).
Physiopathologie de l'EAE
Quel rôle jouent les contrôles positifs dans les études précliniques utilisant des modèles EAE?
Les contrôles positifs sont indispensables dans la recherche sur l'EAE afin de valider la réactivité du modèle expérimental aux traitements efficaces connus et de fournir une cible fiable à laquelle comparer les nouveaux agents thérapeutiques (Robinson, 2014; Melamed, 2022). Vous trouverez ci-dessous les principaux contrôles positifs utilisés dans les études sur l'EAE.
Évolution clinique de l'EAE chronique et récurrente-rémittente et effet des contrôles positifs
Dexaméthasone (Donia, 2010; Nam, 2021)
- Glucocorticoïde utilisé pour traiter les rechutes aiguës chez les patients atteints de sclérose en plaques (SEP) et servant de contrôle positif standard, présentant des effets immunosuppresseurs et anti-inflammatoires dans l'EAE.
- Elle se lie aux récepteurs glucocorticoïdes cytosoliques, qui se translatent vers le noyau pour réguler l'expression génique. Cette action supprime les voies pro-inflammatoires, telles que NF-κB, tout en activant les gènes anti-inflammatoires.
- Il préserve la myéline et les axones, inhibe l'infiltration des cellules immunitaires périphériques (CD45+) et retarde l'activation des microglies et des astrocytes aux premiers stades de la maladie.
- La dexaméthasone retarde considérablement l'apparition clinique de l'EAE et réduit la gravité maximale de la maladie.
- Les effets protecteurs de la dexaméthasone sont transitoires et une résistance aux glucocorticoïdes peut se développer.
Fingolimod (Webb, 2004; Choi, 2011; Constantinescu, 2011; Robinson, 2014; Melamed, 2022)
- Le fingolimod a été le premier traitement modificateur de la maladie (TMM) par voie orale approuvé par la FDA pour la SEP et est très efficace dans l'EAE.
- Le fingolimod sert de contrôle positif pour tester les thérapies qui ciblent le trafic des leucocytes, la migration cellulaire à partir des organes lymphoïdes ou les voies de signalisation du récepteur 1 de la sphingosine-1-phosphate (S1P₁).
- Le mécanisme principal implique la phosphorylation du FTY720 en sa forme active, le FTY720-P. Cette molécule provoque l'internalisation du SIP₁ sur les lymphocytes, les piégeant dans les organes lymphoïdes secondaires et empêchant leur migration vers le SNC. Le fingolimod affecte également le S1P₁ sur les astrocytes du SNC.
- Le fingolimod empêche presque complètement le développement de l'EAE chez les rats Lewis.
Interféron bêta (IFN-β) (Constantinescu, 2011; Robinson, 2014)
- Traitement de première intention injectable pour la SEP, l'IFN-β sert de contrôle positif pour les traitements immunomodulateurs dans l'EAE et vise à moduler l'équilibre des cytokines, en particulier dans les cellules Th1 et Th17.
- L'IFN-β atténue les symptômes, la progression et le développement de l'EAE en limitant les réponses pro-inflammatoires de l'IFN-γ (provenant des cellules Th1) et de l'IL-17 (provenant des cellules Th17) in vivo.
Natalizumab (Constantinescu, 2011; Robinson, 2014)
- Le natalizumab est un anticorps monoclonal dirigé contre l'intégrine α4β1 (VLA-4). Il bloque l'adhésion des lymphocytes aux vaisseaux sanguins, empêchant ainsi leur entrée dans le SNC.
- Il sert de contrôle positif pour les traitements ciblant le trafic leucocytaire et l'infiltration du SNC.
Acétate de glatiramère (Schrempf, 2007; Constantinescu, 2011; Moore, 2014; Robinson, 2014)
- L'acétate de glatiramère est un analogue synthétique de la MBP composé de divers polypeptides qui modulent la réponse immunitaire des lymphocytes T et favorisent la survie des cellules précurseurs des oligodendrocytes.
- Il a été démontré qu'il réduisait les rechutes dans la SEP-RR d'environ 30 %.
Fumarate de diméthyle (DMF) (Dhaiban, 2021; Melamed, 2022)
- Le DMF est un traitement de fond oral approuvé par la FDA dont les bénéfices ont été démontrés dans des modèles d'EAE.
- Il module les réponses Th1 et Th2, inhibe les cytokines pro-inflammatoires et améliore la fonction des cellules NK.
Le modèle EAE offre des informations précieuses sur les mécanismes de démyélinisation, en particulier dans le contexte d'une atteinte de la moelle épinière. Bien qu'il se concentre principalement sur la démyélinisation de la moelle épinière, qui diffère des lésions cérébrales et cérébelleuses plus étendues observées dans la SEP, il reste un outil utile pour comprendre la progression de la maladie. En outre, bien que l'accent soit mis sur les lymphocytes T CD4+ dans l'EAE, les recherches en cours reconnaissent de plus en plus l'importance des lymphocytes T cytotoxiques CD8+ dans la SEP. Cette perspective en évolution met en évidence le potentiel d'amélioration des stratégies thérapeutiques issues de la recherche sur l'EAE afin de mieux les transposer dans les applications cliniques de la SEP. La poursuite des recherches dans ce domaine des neurosciences est prometteuse pour faire progresser notre compréhension et nos options thérapeutiques.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant les modèles EAE ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
Découvrez nos modèles MS
Contenu connexe
Informations actualisées sur la sclérose en plaques et les meilleures pratiques relatives à l'évaluation des agents thérapeutiques dans les modèles animaux de la SEP.
Démyélinisation et remyélinisation dans le modèle Cuprizone
Aperçu des méthodes disponibles pour mesurer la myéline et les oligodendrocytes dans le modèle murin de démyélinisation par la cuprizone de la sclérose en plaques (SP).
Lésions axonales dans l'encéphalomyélite auto-immune expérimentale (EAE)
Cette ressource décrit les méthodes disponibles pour mesurer les lésions axonales et la dégénérescence des axones, y compris les marqueurs tissulaires et les niveaux de chaîne légère des neurofilaments (NfL ; NF-L) dans le plasma et le LCR, dans le modèle EAE de la sclérose en plaques (SP).
Dysfonctionnement mitochondrial dans les microglies et les astrocytes
Le rôle du dysfonctionnement mitochondrial dans les microglies et les astrocytes dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.