この資料では以下の内容について説明しております:
EAEとは何ですか?
実験的自己免疫性脳脊髄炎(EAE)は、主にTヘルパー細胞が中枢神経系(CNS)に侵入することで引き起こされる自己免疫疾患です。この状態は、中枢神経系における炎症、脱髄、神経変性、ならびに血液脳関門(BBB)の早期破壊を引き起こします(Robinson, 2014;Terry, 2016;Dhaiban, 2021)。
EAEは、多発性硬化症(MS)を研究するための主要な動物モデルの一つとして機能しております。MSに関する我々の理解の多くはEAEを用いた研究に由来しており、このモデルで検討された治療法はしばしばヒトへの応用へと発展します。特に注目すべきは、EAEがMSのヒトにおける進行過程と一定の類似性を示し、神経炎症、グリア化、脱髄、軸索損傷を特徴とする組織病理学的病変を呈することです(Robinson, 2014;Terry, 2016;Hasselmann, 2017)。
関連リソース:軸索損傷・実験的自己免疫性 脳脊髄炎・脱髄・クプリゾンモデルにおける再髄鞘形成
EAEに加え、研究者らはMSの研究に様々な他のモデルも用いています。例えば、クプリゾンやリゾレシチンなどの毒素によって誘発される脱髄モデルなどです。MSの複雑さゆえに、その全ての側面を完全に捉える単一のモデルは存在しません(Robinson, 2014;Melamed, 2022)。
EAEモデル
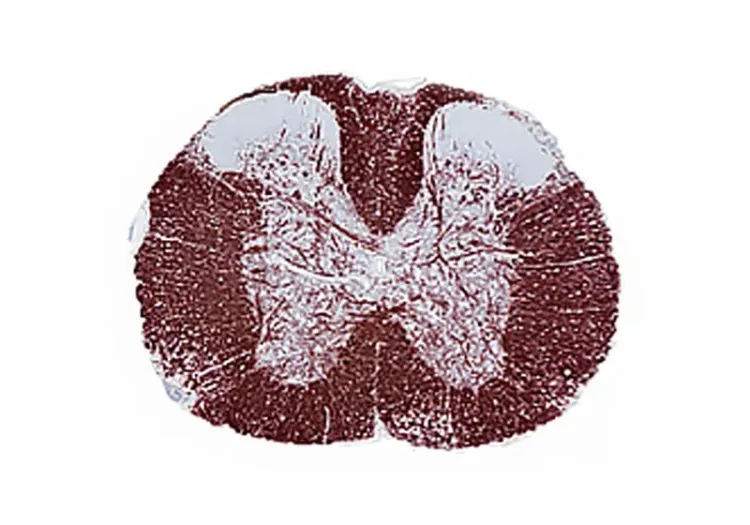
EAEモデルの標的は、中枢神経系(CNS)におけるミエリン形成を担うオリゴデンドロサイトが発現するタンパク質です。このモデルの結果として、軸索路の一次脱髄、軸索伝導障害、および後肢の進行性麻痺が生じます。
EAEは主に2つの方法で誘導可能です(Constantinescu, 2011;Khan, 2014;Robinson, 2014;Terry, 2016;Hasselmann, 2017):
- ミエリン由来タンパク質またはペプチドを用いた能動免疫。能動的EAE免疫は、以下の脳炎誘発エピトープを含む複数のエピトープを用いて実施可能です:
- プロテオリピッドタンパク質(PLP)の脳炎誘発エピトープ(PLP139-151、PLP178-191、PLP56-70)
- ミエリン塩基性タンパク質(MBP84-104、MBP12-26)
- ミエリンオリゴデンドロサイト糖タンパク質(MOG92-106、MOG35-55、MOG1-20、MOG1-125)
- これらのタンパク質/ペプチドは、免疫反応を増強するために、完全フレインドアジュバント(CFA)と乳化することができます。
- 活性化CD4+ T細胞の受動移入。
- ミエリン抗原を標的とする脳炎誘発性CD4+ T細胞を、免疫化されたドナーマウスから採取し、培養で活性化させた後、レシピエントマウスに注入します。この方法は、特定のT細胞集団(例:Th1、Th17)を標的とする治療法の開発に有益です。
EAEの異なる病理形態は、動物の種や系統、標的タンパク質、および使用される免疫経路に基づいて生じます。マウスモデルでは、一般的に使用される系統にはSJL(スイス・ジム・ランバート)(H-2s)、C57BL/6(H-2b)、PL/J、およびB10.PL(H-2u)が含まれます。ラットモデルでは、ルイスラットやダークアグーチ系統が頻繁に用いられます。また、マーモセットなどの霊長類も、ヒトとの系統発生学的近縁性からモデルとして利用されています(Linker, 2009;Khan, 2014;Robinson, 2014;Terry, 2016;Melamed, 2022)。
多発性硬化症(MS)のEAEマウスモデルについては、こちらをご参照ください。
EAEマウスにおける典型的な臨床経過は以下のパターンに従います(Robinson, 2014;Hasselmann, 2017):
- 前駆期:10~15日間持続します。
- 尾部および後肢から始まる上行性麻痺。
- 麻痺が前肢にまで進行します。
- 急性期における体重減少は15~20%です。
- 慢性期は通常、誘導後約30日目に始まります。
- 異なる動物モデルでは、疾患の固有の特徴が観察されます。例えば:
- SJLマウス(PLP139-151、MOG92-106)は再発寛解型(RR)の経過を示します。
- C57BL/6マウス(MOG35-55)は慢性進行性の経過を示す傾向があります。
- PL/JマウスおよびB10.PLマウスはいずれも、急性かつ寛解性の病態経過を示します。
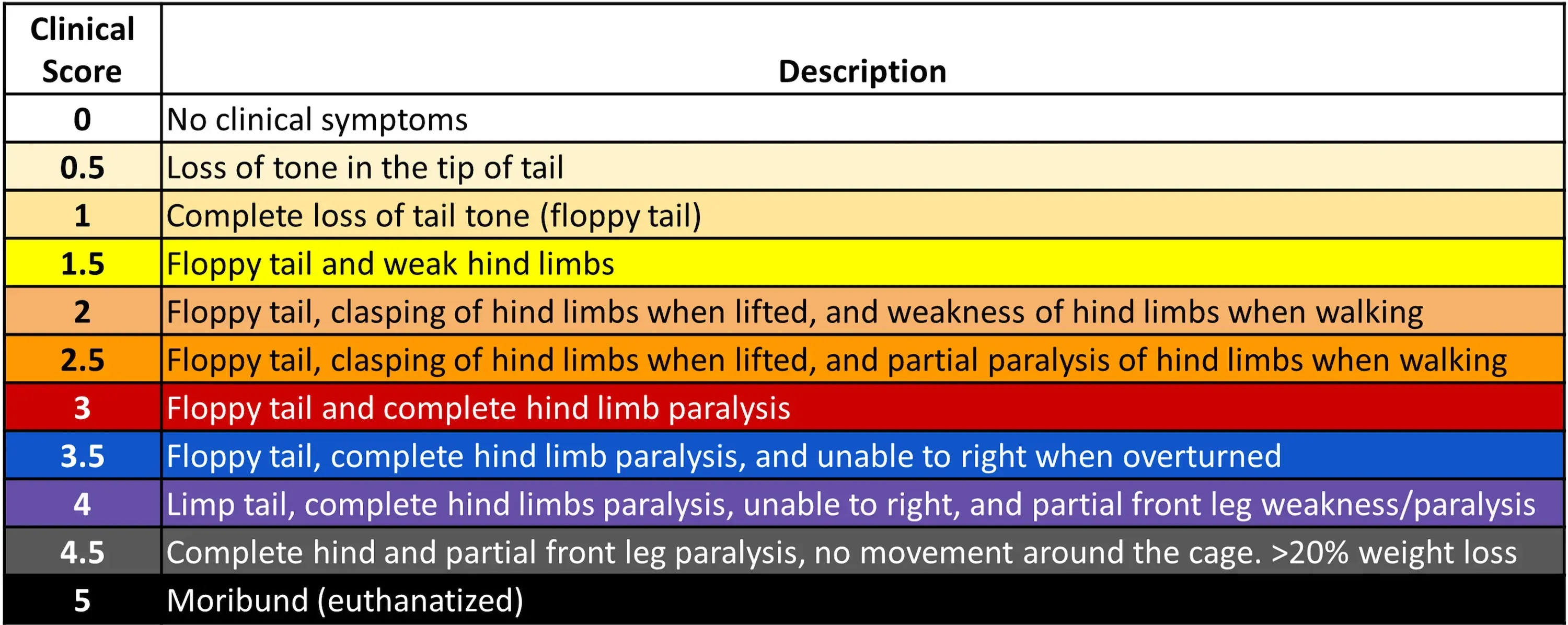
- 神経学的損傷の発症、進行、回復をモニタリングするため、研究者はEAE誘発動物に対し、0から5までの臨床的尺度であるEAEスコアを用います。
EAEスコアリングシステム
EAE(実験的自己免疫性脳脊髄炎)に関与する病態生理学的メカニズムにはどのようなものがありますか?
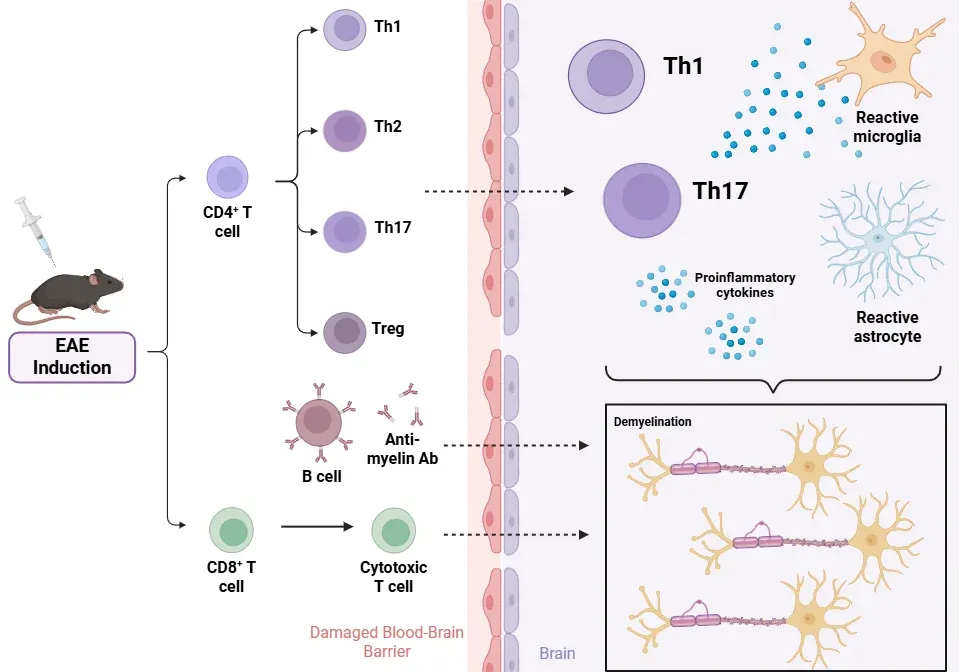
免疫組織化学および 免疫蛍光法は、疾患の病理学的特徴と進行について貴重な知見を与えてくれます。EAE の病態生理学には、さまざまな免疫細胞とグリア細胞間の複雑な相互作用が関わっています。
CD4+ T リンパ球(Linker、2009 年、Shin、2012 年、ダフィー、2014 年、ロビンソン、2014 年)
- 当初、炎症の誘発は Th1 細胞のみによるものと考えられていました。
- EAE モデルでは、Th1 細胞と Th17 細胞の両方が中枢神経系の病変に存在します。IL-23 によって誘導される Th17 細胞は、Th1 細胞とともに EAE の発症に重要な役割を果たしますが、これらの細胞が産生するサイトカインは、疾患の発症に必須ではありません(Th1:IFNγ およびTNFα、Th17:IL-17-A、IL-17-F、IL-22)。
- Th1細胞とTh17細胞は、脱髄および炎症のメカニズムを通じて軸索損傷に寄与しますが、その作用は動物系統や免疫化方法によって異なる場合があります。
- Th1細胞が確かに病原性を示す一方で、Th2細胞は免疫調節の役割を果たします。
- TGF-β および IL-10 を分泌する制御性 T 細胞(Treg)は、自己耐性を維持します。その機能不全は MS の進行に関連していますが、その活性は特定の EAE モデルにおける自然回復をサポートする可能性があります。
CD8+ T リンパ球( Linker、2009 年、ダフィー、2014 年、ロビンソン、2014 年)
- EAE は主に CD4+ T 細胞モデルとして機能しますが、CD8+ T 細胞および B 細胞もこの病態に関与しています。
- CD8+ T 細胞は、ミクログリアやマクロファージとともに MS の病変部に見られ、病原性および調節性の両方の機能を発揮します。
- CD8+ 細胞傷害性リンパ球は、ミエリン鞘や軸索を直接損傷する可能性があります。中枢神経系への浸潤によって EAE を誘発する可能性があるものの、その正確な役割は依然として不明な点が多いです。
B 細胞( Robinson, 2014;Dedoni, 2023)
- B細胞は、抗原提示細胞として作用し、ミエリンに対する抗体を産生することで病変の発達に寄与します。
- MOG1-125で免疫化された場合、EAEの発症に不可欠です。
- B細胞はまた、樹状細胞とともにT細胞の活性化に関与し、RR型EAEマウスの中枢神経系において異所性胚中心を形成することがあります。
- 分化したB細胞は、T細胞の分化を促進するサイトカインを放出する可能性があります。
- 免疫グロブリン産生は脳脊髄液(CSF)で検出されています。
病理学的結果
- 血液脳関門の破壊:Th17 細胞によって産生される IL-17 は、内皮細胞に作用し、関門の完全性を維持するタイトジャンクションの破壊をもたらします。この透過性により、T 細胞、B 細胞、およびマクロファージの浸潤が可能になります(Shin、2012 年、ダフィー、2014 年、Dhaiban、2021 年)。
- 炎症および脱髄:免疫細胞が中枢神経系に浸潤すると、局所的な炎症や浮腫が生じ、軸索を囲む髄鞘が破壊されます(Robinson、2014 年、Toader、2018 年)。
- 軸索損傷:脱髄病変と併せて広範囲の軸索損傷が生じ、進行性の神経学的欠損に大きく寄与します(Robinson、2014 年、Hasselmann、2017 年)。
- グリア症:炎症および組織損傷への反応として、アストロサイトが反応性を示し、グリア瘢痕の形成を引き起こします(Toader, 2018)。
- ミトコンドリア機能障害:ミトコンドリア機能障害は一酸化窒素フリーラジカルの産生に寄与し、EAEの病態形成に影響を及ぼします。一部のMS患者においては、ミトコンドリア機能障害と皮質病変との間に相関関係が認められています(Dutta, 2006)。
EAEの病態生理学
EAEモデルを用いた前臨床研究において、陽性対照はどのような役割を果たしますか?
陽性対照は、EAE研究において、既知の有効治療法に対する実験モデルの反応性を検証し、新規治療薬を比較するための信頼できる基準を提供するために必要です(Robinson, 2014;Melamed, 2022)。以下に、EAE研究で使用される主要な陽性対照を示します。
慢性および再発寛解型EAEの臨床経過と陽性対照の影響
デキサメタゾン( Donia, 2010;Nam, 2021)
- 多発性硬化症(MS)患者の急性再発治療に用いられるグルココルチコイドであり、EAEにおいて免疫抑制作用および抗炎症作用を示す標準的な陽性対照薬として機能します。
- 細胞質内のグルココルチコイド受容体に結合し、核へ移行して遺伝子発現を調節します。この作用により、NF-κBなどの炎症促進経路を抑制すると同時に、抗炎症性遺伝子を活性化します。
- 髄鞘と軸索を保護し、末梢免疫細胞(CD45+)の浸潤を抑制するとともに、疾患初期段階におけるミクログリアおよびアストロサイトの活性化を遅延させます。
- デキサメタゾンはEAEの臨床発症を大幅に遅らせ、疾患のピーク時の重症度を軽減します。
- デキサメタゾンの保護効果は一時的であり、グルココルチコイド耐性が生じる可能性があります。
フィンゴリモド(Webb, 2004;Choi, 2011;Constantinescu, 2011;Robinson, 2014;Melamed, 2022)
- フィンゴリモドは、FDAが承認した最初の経口疾患修飾治療薬(DMT)であり、EAEにおいて高い有効性を示します。
- フィンゴリモドは、白血球の移動、リンパ器官からの細胞遊走、またはスフィンゴシン-1-リン酸受容体1(S1P₁)シグナル伝達経路を標的とする治療法の試験における陽性対照として機能します。
- 主な作用機序は、FTY720が活性型であるFTY720-Pへリン酸化されることです。この分子はリンパ球上のS1P₁を内取り込みさせ、二次リンパ器官内に閉じ込め、中枢神経系(CNS)への移動を阻止します。フィンゴリモドはまた、中枢神経系内のアストロサイト上のS1P₁にも作用します。
- フィンゴリモドは、ルイス系ラットにおけるEAEの発症をほぼ完全に抑制します。
インターフェロン-β(IFN-β)(Constantinescu, 2011;Robinson, 2014)
- 多発性硬化症(MS)の第一選択注射型疾患修飾療法(DMT)であるIFN-βは、EAEにおける免疫調節療法の陽性対照として機能し、特にTh1細胞およびTh17細胞におけるサイトカインバランスを調節することを目的としています。
- IFN-βは、生体内におけるIFN-γ(Th1細胞由来)およびIL-17(Th17細胞由来)の炎症促進反応を抑制することにより、EAEの症状、進行、発症を改善します。
ナタリズマブ( Constantinescu, 2011;Robinson, 2014)
- ナタリズマブは、α4β1インテグリン(VLA-4)に対するモノクローナル抗体です。リンパ球の血管への接着を阻害し、中枢神経系(CNS)への侵入を防ぎます。
- 白血球の移動および中枢神経系への浸潤を標的とする治療法の陽性対照として機能します。
グラチラマー酢酸塩( Schrempf, 2007;Constantinescu, 2011;Moore, 2014;Robinson, 2014)
- グラチラマー酢酸塩は、T細胞の免疫応答を調節し、オリゴデンドロサイト前駆細胞の生存を促進する様々なポリペプチドで構成される、MBPの合成類似体です。
- 再発寛解型多発性硬化症(RR-MS)における再発を約30%減少させることが示されています。
フマル酸ジメチル(DMF)(Dhaiban、2021年、Melamed、2022年)
- DMF は、EAE モデルにおいてその有効性が実証されている、FDA 承認の経口 DMT です。
- Th1およびTh2応答を調節し、炎症誘発性サイトカインを抑制し、NK細胞機能を強化します。
EAEモデルは、特に脊髄の関与という観点において、脱髄のメカニズムに関する貴重な知見を提供します。主に脊髄の脱髄に焦点を当てている点(MSで観察されるより広範な大脳および小脳病変とは異なります)はありますが、疾患の進行を理解する上で有用なツールであり続けています。さらに、EAEではCD4+ T細胞への注目が顕著である一方、進行中の研究ではMSにおけるCD8+細胞傷害性T細胞の重要性が次第に認識されつつあります。この進化する視点は、EAE研究から得られた治療戦略をMSの臨床応用へより効果的に転用する可能性を浮き彫りにしています。神経科学のこの分野における継続的な探求は、我々の理解と治療選択肢の進展に有望な可能性を秘めています。
弊社のチームは、EAEモデルに関するご質問や、治療効果試験に使用するモデルの詳細情報について、喜んでご回答いたします。
当社のMSモデルについて、さらに詳しくご覧ください
関連コンテンツ
多発性硬化症に関する最新情報ならびに、MS動物モデルにおける治療薬の評価に関連する最善の実践法について。
キュプリゾンモデルにおける脱髄と再脱髄
多発性硬化症(MS)の銅線脱髄マウスモデルにおけるミエリンおよびオリゴデンドロサイトを測定する方法の概要。
実験的自己免疫性脳脊髄炎(EAE)および軸索損傷
この資料では、多発性硬化症(MS)のEAEモデルにおける軸索損傷および軸索変性の測定方法について説明しています。組織マーカーや血漿およびCSF中のニューロフィラメント軽鎖(NfL;NF-L)レベルなど、利用可能な測定方法を説明しています。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。