ミトコンドリアはミクログリアおよびアストロサイトにおいてどのような役割を果たしていますか?
ミトコンドリアの機能と動態
ミトコンドリアは、多様な細胞機能を支える不可欠な細胞小器官です。「細胞のエネルギー工場」と呼ばれるミトコンドリアは、電子伝達系(ETC)を介した酸化リン酸化(OXPHOS)を通じて、細胞プロセスにおける主要なエネルギー源であるアデノシン5'三リン酸(ATP)を生成します(Tönnies, 2017)。しかし、その役割はエネルギー生成に留まりません。ミトコンドリアは、脂質とアミノ酸の代謝、カルシウム(Ca2+)の恒常性維持、およびプログラム細胞死(PCD、アポトーシスとも呼ばれる)にも関与しています(Bose, 2016)。さらに、活性酸素種(ROS)の生成と抗酸化防御のバランスを調整することで、酸化ストレスを調節しています。
ミトコンドリアは高度に動的であり、融合と分裂のプロセスを通じて継続的な形態的再編成を経験します。これらの動的変化は、ミトコンドリア機能の維持とアポトーシスの防止に不可欠です。ミトコンドリアの動的変化に関与する主要なタンパク質には、分裂に関連するダイナミン関連タンパク質1(Drp1)と、融合に関連するミトフシン(Mfn1/2)および視神経萎縮1(OPA1)があります。これらのプロセスのバランスが崩れると、ミトコンドリアの断片化、ATP産生の減少、細胞ストレスの増加を引き起こす可能性があります。さらに、分裂と融合の障害はミトコンドリアの輸送を妨げ、シナプス機能障害や神経変性に関与する可能性があります。
ミトコンドリア機能障害とグリア介在性神経炎症
ミトコンドリア機能障害は、老化やミトコンドリアDNA(mtDNA)の変異など、さまざまな要因により引き起こされ、ATP産生障害、活性酸素種(ROS)の増加、構造異常、酸化ストレス、アポトーシスを引き起こします(Tönnies, 2017; Wang, 2020)。生理的なレベルのROSはシグナル伝達分子として機能しますが、過剰なROSはミトコンドリアの構造と機能を障害します(Kumar, 2012)。ミトファジーによって適切に除去されない損傷を受けたミトコンドリアは、ミトコンドリア由来の損傷関連分子パターン(DAMPs)を放出する可能性があります。これらは、先天性免疫受容体の活性化を通じて炎症性シグナル伝達経路を誘発します(Salmina, 2021; Lin, 2022)。
ミクログリアとアストロサイトは中枢神経系(CNS)の免疫応答において重要な役割を果たし、ミトコンドリア由来のDAMPsに対する主要な応答細胞です。ミクログリアはパターン認識受容体を通じてこれらの危険信号を認識し、NF-κBなどの転写因子を活性化し、インターロイキン-1β(IL-1β)や腫瘍壊死因子アルファ(TNF-α)などの炎症性サイトカインの放出を促進します。これらのサイトカインは酸化ストレスを悪化させ、血液脳関門(BBB)を破壊し、神経細胞の損傷を促進します(Wang, 2020)。ミクログリアとアストロサイトの両方で、ミトコンドリア機能障害は神経保護機能を障害し、慢性炎症を維持します。このようにして悪循環が形成され、ミトコンドリア損傷がグリア細胞を活性化し、その結果生じる炎症性仲介物質がさらにミトコンドリアを損傷し、神経変性を増強します(Jeon, 2020; Yan, 2020)。
重要な点は、ミトコンドリア機能障害が、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患において神経炎症に先行する可能性があり、ミトコンドリア機能障害が疾患病理の潜在的なドライバーとして位置付けられている点です(Swerdlow, 2014)。神経細胞だけでなくグリア細胞におけるミトコンドリアの変化を調査することは、疾患の早期メカニズムの理解を深め、新たな治療戦略の開発を促進する可能性があります(Lin, 2022)。
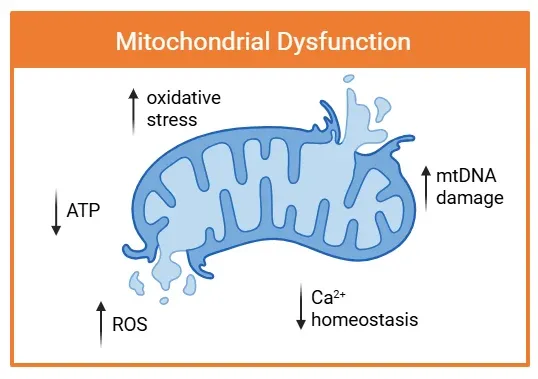
ミトコンドリア機能障害は、構造的損傷および機能障害を特徴とします。矢印は、ROS の産生増加、酸化ストレス、mtDNA 損傷などの重要な病理学的変化を示しています。これらの障害は、ATP 生成の低下およびCa2+の恒常性障害と一致し、神経炎症および神経変性疾患の進行に寄与しています。
ミトコンドリア機能障害とミクログリアおよびアストロサイト、ならびにアルツハイマー病(AD)、パーキンソン病(PD)、および筋萎縮性側索硬化症(ALS)との関連性はどのようなものでしょうか?
ミクログリアとアストロサイトにおけるミトコンドリア機能障害は、神経変性疾患の研究において注目されている新たな分野です。これらのグリア細胞におけるミトコンドリア機能の障害は、その支持機能を損なうだけでなく、神経炎症を引き起こし持続させ、神経細胞の損傷を悪化させるフィードバックループを形成します。
アルツハイマー病(AD)
ADは、進行性の記憶障害、認知機能の低下、行動の変化が臨床的特徴として現れます。病理学的特徴には、アミロイドベータ(Aβ)プラークの蓄積、過リン酸化タウ神経原線維変化、神経細胞の喪失が含まれます。特に、ミトコンドリア機能障害、酸化ストレス、炎症は、ADの進行に寄与する初期の要因の一つとして指摘されています(Swerdlow, 2014)。
ADにおいて、ミトコンドリア内のAβの蓄積はETC複合体IIとIVを阻害し、ATP産生を減少させ、ROSを増加させます(Kumar, 2015;Swerdlow, 2016)。Aβはまた、ミトコンドリアタンパク質の輸入を障害し、mtDNAを損傷し、CA2+の恒常性を損ない、アポトーシスを促進します(Kumar, 2015)。さらに、Aβはミトコンドリアの形態と動態、特に分裂と融合の調節を障害します(Wang, 2008;2009)。これらの動態を仲介するDrp1とOPA1の調節異常は、Aβ誘発性神経毒性と関連しています(Wang, 2008;2009)。損傷したミトコンドリアの除去障害は神経変性を増強します(Kumar, 2015)。
前臨床モデルでは、ミトコンドリアを標的とした介入が治療効果をもたらす可能性が示唆されています。例えば、OPA1の過剰発現は、アルツハイマー病モデルにおいてミトコンドリアの構造と機能を回復させます(Wang, 2008;2020)。さらに、Drp1/Fis1選択的阻害剤であるP110は、ミトコンドリアの断片化およびミクログリアとアストロサイトの活性化を抑制し、ミクログリアからの損傷ミトコンドリアの放出を減少させ、サイトカイン介在性損傷から神経細胞を保護します(Joshi, 2019)。これらの結果は、ミクログリアにおけるミトコンドリア分裂を標的とすることで、神経炎症と神経細胞損傷を軽減する可能性を支持しています。
パーキンソン病(PD)
PDは、運動症状(運動緩慢、筋強剛、歩行障害、安静時振戦)と非運動症状(認知機能障害、気分・睡眠障害)を呈します。Lewy小体内のα-シヌクレイン(α-syn)の蓄積と、黒質緻密部(SNpc)のドーパミン神経細胞の変性が特徴的です。ほとんどのPDは散発性ですが、一部はDJ-1(PARK7としても知られている)などの遺伝子の変異と関連しています(Almikhalfi, 2020)。
家族性および散発性のPDはともにミトコンドリア機能障害を示します(Grünewald, 2019)。DJ-1ノックアウトラットでは、SNにおける進行性ドーパミン神経変性、運動障害、および電子伝達系複合体I(ETC複合体I)などのミトコンドリア経路の障害が観察されています(Almikhlafi, 2020)。アストロサイトは、オートファジー-リソソーム経路を介してα-シヌクレインの分解を助けます。しかし、過剰なα-シヌクレインはこのプロセスを過剰に刺激し、さらにミトコンドリア機能障害を引き起こします。α-シヌクレインは、シトクロムCオキシダーゼ1(COX1)を含むミトコンドリア成分と相互作用し、ミトコンドリア機能を障害します(Jeon, 2020)。ATP13A2の変異は、ミトコンドリアとリソソーム経路を障害し、α-シヌクレインの蓄積に寄与します(Grünewald, 2019)。
筋萎縮性側索硬化症(ALS)
ALSは運動神経細胞に影響を及ぼす進行性神経変性疾患で、筋力低下、痙攣、呼吸不全を引き起こします。ほとんどの症例は散発性ですが、家族性ALSは C9orf72、 SOD1、 FUS、TARDBPなどの遺伝子変異と関連しています。変性タンパク質(変異型スーパーオキシドディスムターゼ1(SOD1)やTDP-43など)はALSの代表的な特徴です。
ALS患者、マウス、細胞培養モデルにおいて、異常なミトコンドリア形態が報告されています(Magrané, 2009)。神経筋接合部におけるミトコンドリアの輸送と位置は、運動神経細胞の機能に不可欠です。死後研究では、ALS患者の脊髄において電子伝達系(ETC)複合体の活性が低下していることが示されています(Obrador, 2020)。ミトコンドリアのサーチュイン(SIRT1とSIRT3など)の機能障害は、ミトコンドリアの生物生成と機能を障害します(Obrador, 2020)。SIRT1はPGC-1αを活性化し、SIRT3を介してミトコンドリア機能と活性酸素種(ROS)防御を強化します(Song, 2013)。レスベラトロールでSIRT1を活性化すると、SOD1G93AALSマウスモデルにおいて症状の改善と生存率が向上し、一方、SIRT3の過剰発現はROSの生成を減少させ、培養中のSOD1G93A運動神経細胞におけるミトコンドリアの断片化と死から保護します(Han, 2012; Song, 2013)。
TDP-43は、電圧依存性アニオンチャネル1(VDAC1)などのミトコンドリアタンパク質と相互作用し、ミトコンドリアダイナミクスとミトファジーを障害します(Obrador, 2020)。誘導多能性幹細胞(iPSC)由来のC9orf72運動神経細胞では、酸化ストレスは年齢とともに増加しますが、酸化ストレスを軽減することで一部緩和されます(Lopez-Gonzalez, 2016)。
要約すると、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)は、臨床症状と病理学的に異なるものの、共通のメカニズムを有しています。すなわち、慢性的なグリア細胞の活性化と神経炎症を促進するミトコンドリア機能障害です。この双方向の関係はフィードバックループを形成し、疾患の進行を加速させます。このサイクルを標的とすることで、新たな治療アプローチが提案される可能性があります。
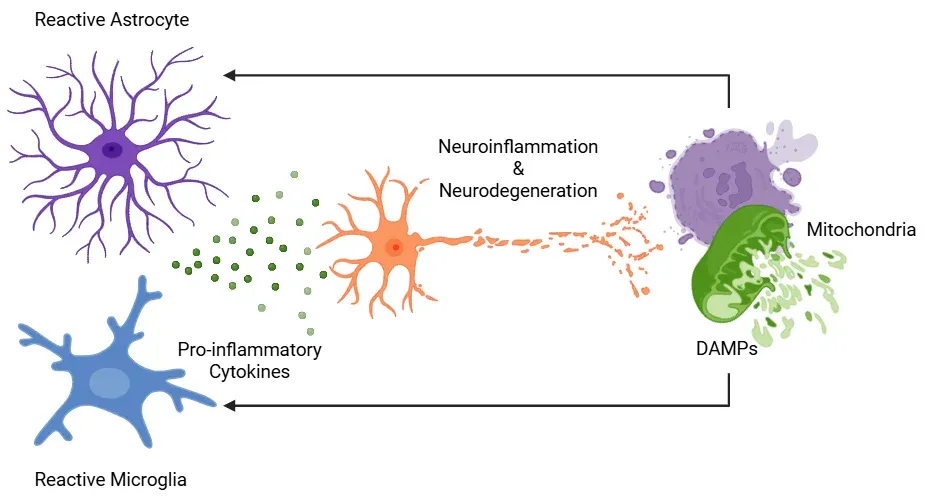
神経変性疾患における神経炎症は、機能障害を起こしたミトコンドリアと反応性グリア細胞の相互作用によって引き起こされます。損傷を受けたミトコンドリアは、ミトコンドリア由来のDAMPsを放出します。これらはミクログリアとアストロサイトによって認識されます。これに応答して、これらのグリア細胞は反応性フェノタイプを採用し、炎症性サイトカインを分泌し、さらにミトコンドリアの機能を障害します。このプロセスは、ミトコンドリアの機能障害とグリア細胞の反応性が互いに増幅し合う自己維持的なフィードバックループを形成し、慢性的な神経炎症と進行性の神経細胞変性に寄与します。図はPiccaet al.(Picca, 2022)からクリエイティブ・コモンズ・ライセンスに基づき改変しました。
神経変性疾患におけるミトコンドリア機能障害を標的とした治療アプローチにはどのようなものがありますか?
神経変性疾患においてミトコンドリア機能障害と酸化ストレスが中心的な役割を果たすことから、ミトコンドリア経路を標的とした治療戦略が有望なアプローチとして浮上しています。ミトコンドリア標的抗酸化物質、ミトコンドリアダイナミクスの調節、バイオエネルゲティック機能の向上など、複数のアプローチが現在検討されています。血液脳関門(BBB)透過性などの課題が残るものの、これらの介入は疾患の進行を遅らせたり、改変したりする可能性を秘めています。
ROSと抗酸化防御のバランスが崩れることで生じる酸化ストレスは、ミトコンドリア機能障害の主要な要因です。ミトコンドリア標的抗酸化物質は、前臨床モデルにおいて神経細胞の酸化損傷を防止する効果を示しています(Kumar, 2015)。MitoQ、MitoTEMPOL、mitovitEなどの化合物は、ミトコンドリア内の酸化ストレスを源流で軽減するように設計されています。しかし、これらの化合物のBBB透過性の低さは、依然として重大な障害となっています(Hara, 2019)。さらに、抗酸化療法は慎重に調節する必要があります。過剰な抗酸化作用は、正常な細胞機能に必要な重要な酸化シグナル伝達経路を乱す可能性があるためです(Hara, 2019)。
ミトコンドリアの分裂と融合の動的プロセスは、ミトコンドリアの健康維持に不可欠です。これらのプロセスの調節異常は、複数の神経変性疾患と関連しています。ミトコンドリアダイナミクスに関連するタンパク質(Drp1やOPA1など)を標的とした治療法が注目されています。例えば、小分子Mdivi-1によるDrp1の阻害は、早期アルツハイマー病(AD)のマウスモデルにおいて、ミトコンドリア形態の回復、ダイナミクスの改善、アミロイド病理の軽減、認知機能の向上をもたらし、おそらくAβ産生の減少を介して作用すると考えられています(Wang, 2020)。
もう一つの新興治療戦略は、ミトコンドリアのバイオエネルゲティクス調節に焦点を当てています。ミトコンドリア機能とATP産生の向上は、神経変性疾患でよく観察されるエネルギー不足を補う可能性があります。クエン酸回路の中間体であるオキサロアセテート(OAA)は、ミトコンドリアのバイオエネルゲティクス流量を増やし、脳機能を改善する能力を示しています。AD患者を対象とした第I相臨床試験では安全性が確認されましたが、認知機能への効果は限定的でした(Swerdlow, 2016)。有効な投与量と長期的な有効性を確定するためには、さらなる研究が必要です。もう一つの候補物質であるCP2は、神経細胞のミトコンドリアに選択的に蓄積し、ミトコンドリア複合体Iを阻害する化合物で、アルツハイマー病マウスモデルにおいてアミロイド斑とタウ病理を減少させ、認知機能を維持する可能性を示しています(Zhang, 2015)。
ペプチドベースの療法は、SS-31(エラミプレチドまたはMTP-131としても知られています)など、もう一つの革新的なアプローチです。SS-31はミトコンドリアの内膜を標的とし、ミトコンドリア膜の integrity に重要な脂質であるカルディオリピンに結合します。この結合は、OXPHOSに関与するスーパーコンプレックスの形成をサポートします。前臨床研究では、SS-31がADモデルにおいてミトコンドリア機能とシナプス機能を改善することが示されており、最近ではFriedreichの失調症(NCT05168774)などの希少疾患を対象とした臨床試験で試験されています。
結論として、ミトコンドリア機能障害の是正を目的とした治療戦略は、神経変性疾患の治療に大きな可能性を秘めています。しかし、薬物送達の最適化、血液脳関門(BBB)透過性の確保、ROS抑制と生理的シグナル伝達とのバランス維持など、複数の課題が残されています。これらの治療法を精緻化し、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの疾患に対する有効な治療法として実用化するためには、継続的な研究が不可欠です。
ミクログリアおよびアストロサイトにおけるミトコンドリア機能障害、神経変性疾患に関するご質問、または治療効果研究に使用している AD、ALS、PD モデルに関する具体的な情報については、弊社チームがお答えいたします。
当社の神経変性疾患モデルについて詳しくはこちらをご覧ください。
関連コンテンツ
ミクログリアおよびアストロサイトにおけるミトコンドリア機能障害と神経変性疾患に関する最新情報、ならびに神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
ミクログリアとニューロンの相互作用と神経変性疾患
ミクログリアとニューロンの直接的な相互作用、およびこれらの細胞間相互作用が神経変性疾患においてどのように影響を受けるかについて簡潔にレビューします。
パーキンソン病におけるミクログリア、アストロサイト、およびα-シヌクレイン
α-シヌクレインがパーキンソン病およびその他のシヌクレイン病においてミクログリアおよびアストロサイトに及ぼす影響。
ミクログリアとアストロサイトのライソゾーム機能不全
ミクログリアとアストロサイトのライソゾーム機能不全の概要と、神経変性疾患におけるその役割。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。
ミトコンドリア機能障害とパーキンソン病
パーキンソン病におけるミトコンドリア機能障害が神経変性と関連する仕組みの概要。
ミトファジーとパーキンソン病
障害のあるミトファジーがパーキンソン病における神経変性につながる仕組みの概要。