アストロサイトおよびミクログリアにおけるリソソームの役割は何でしょうか?
リソソームは細胞質小器官であり、主にさまざまな細胞残屑の分解に関与していることで知られています(Perera, 2016)。リソソームの形成は主に転写因子 EB(TFEB)によって制御されており、この因子はリソソームタンパク質と酵素を生成する遺伝子の発現を制御しています。リソソームは、リソソーム関連膜タンパク質(LAMP)で構成される特殊な膜に包まれた、v-ATPase(プロトンポンプ)によって酸性腔を維持しています。リソソームには、その異化機能を担う多数の加水分解酵素が含まれています。
リソソームは細胞外および細胞内の物質の分解に重要です(Perera, 2016)。細胞外物質の摂取はエンドサイトーシスによって行われ、廃棄物はエンドソームにパッケージ化され、後にリソソームと融合して分解されます。一方、細胞内物質はオートファジーによって分解され、再利用されます。この過程では、老朽化または損傷した細胞小器官はオートファゴソームにパッケージ化され、リソソームと融合して再利用または分解されます。このように、リソソームは、高分子が分解されて構成成分となり、除去または再利用される共通の終着点として機能します。
アストロサイトとミクログリアは、神経細胞のシグナル伝達をサポートし、調節する上で極めて重要です。アストロサイトは、神経細胞のシグナル伝達を調節するために余剰の神経伝達物質を再利用する上で重要な役割を果たすほか、血液脳関門の維持など、さまざまな機能を持っています。ミクログリアは、中枢神経系(CNS)の主要な免疫細胞です。ミクログリアは、病原体や細胞残屑(神経変性疾患で見られるタンパク質凝集体を含む)の除去に重要な役割を果たす食細胞です(Kreher, 2021)。細胞残骸の分解における主要評価項目として、アストロサイトおよびミクログリアの最適な機能にはリソソームが不可欠です(Kreher, 2021)。
マイクログリアのオートファジーの障害が神経変性疾患を引き起こすメカニズムに関する詳細な情報は、以下の文献をご参照ください:神経変性疾患におけるマイクログリアのオートファジーの障害
ライソゾーム機能不全は、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症にどのように影響するのでしょうか?
ライソゾームの機能不全は、さまざまな形で現れます。ライソゾームの酸性化、ライソゾームの加水分解酵素活性、ライソゾーム膜の透過性、およびオートファゴソームまたはエンドソームとライソゾームの融合の崩壊における機能不全は、神経変性疾患に共通して見られます(Kreher, 2021;Quick, 2023)。これらのライソゾームの機能不全は、細胞残屑の非効率的な分解をもたらし、さらなる病態につながる可能性があります。
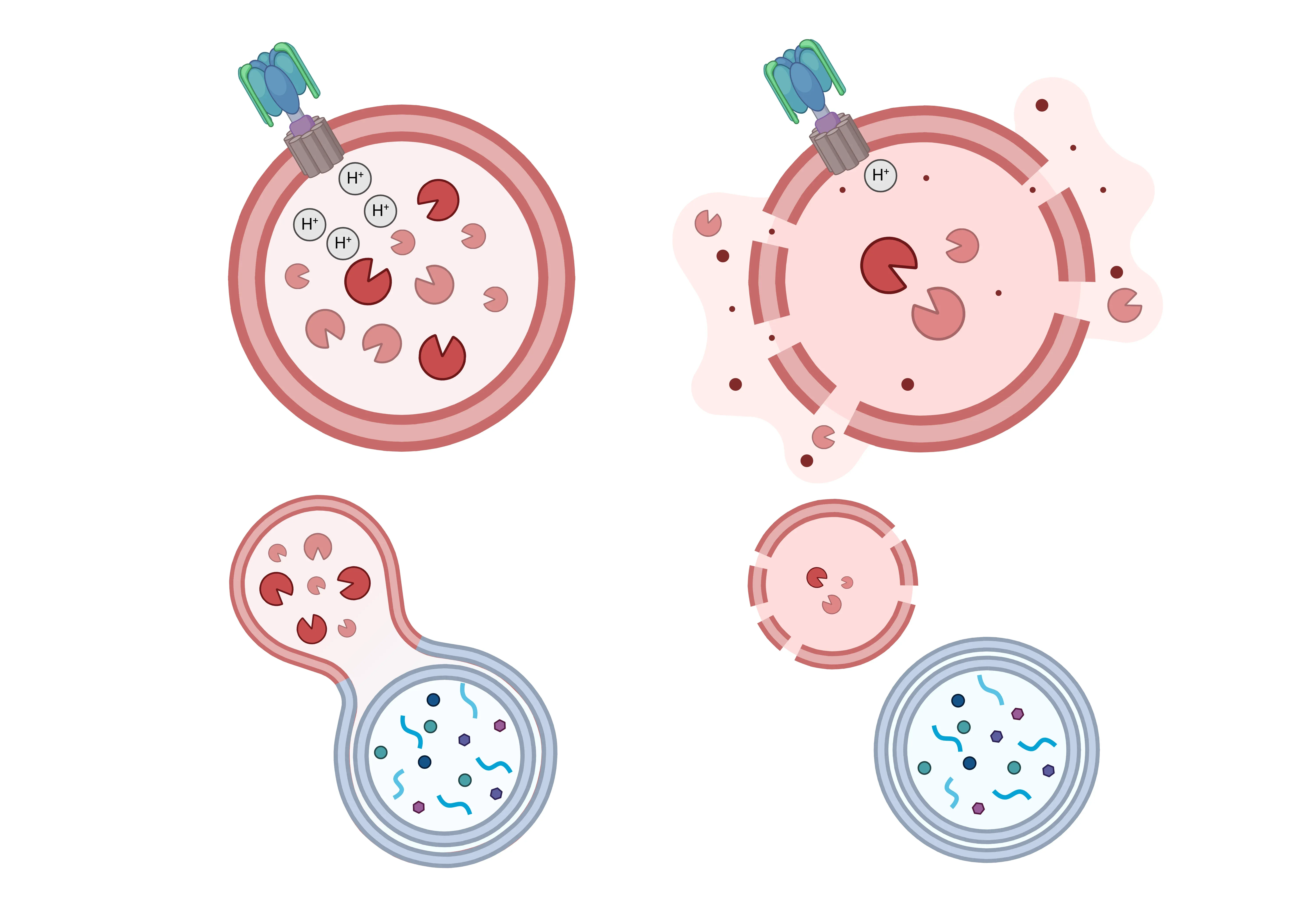
多くの神経変性疾患では、正常なリソソーム機能(左)が損なわれ、リソソーム機能障害のさまざまな症状(右)が現れます。リソソームの酸性化は、v-ATPase機能の低下によりリソソーム内腔のpHが上昇することで影響を受ける可能性があります。さらに、リソソーム膜の透過性が高まり、リソソーム加水分解酵素が細胞質に放出されます。リソソーム酵素の供給量も減少するため、分解能力が低下します。最終的には、リソソームとエンドソームおよびオートファゴソームの融合が阻害され、分解されなかった物質が蓄積されることになります。
クリックしてリンクをコピー
アルツハイマー病(AD)
ADは、アミロイドβ(Aβ)とタウ凝集体の蓄積を特徴とする神経変性疾患です。アストロサイトとミクログリアのライソゾームは、これらの有害なタンパク質凝集体の細胞内取り込みと分解において重要な役割を果たしています(Kreher, 2021)。しかし、Aβの貪食と分解はミクログリアにおいてより顕著であるようです(Prakash, 2021)。オートファジーが欠損したミクログリアを持つマウスでは、利用可能なリソソーム酵素が減少し、Aβの除去が損なわれています(Choi, 2023)。さらに、ADではリソソーム酵素が失われ、タンパク質凝集体の分解能力が低下します(Kim, 2025)。リソソームがその異化機能を果たすためには、適切なリソソームの酸性化が不可欠ですが、アルツハイマー病ではこれが損なわれています。ClC-7 塩素および水素イオンアンチポーターの遺伝子ノックダウンは、ミクログリアのリソソームの不適切な酸性化につながり、結果としてアミロイドβタンパク質の凝集体の分解が損なわれます(Majumdar, 2011)。さらに、アルツハイマー病の発症と強く関連していることが分かっているプレセニリン1(PS1)の変異は、リソソームのv-ATPaseの組み立ての障害につながり、不適切なリソソームの酸性化、およびミクログリアによるAβの非効率的な分解を引き起こします(Ledo, 2021)。さらに、PS1の変異は、ミクログリアにおけるTFEB mRNAレベルの低下にも関連しており、リソソームの生合成の減少とオートファジーの障害につながります(Ledo, 2021)。
また、アルツハイマー病とタンパク質凝集体の蓄積は、グリア細胞におけるリソソーム機能不全をさらに悪化させる可能性があります。例えば、Aβ凝集体の存在は、TFEBの輸送に影響を与え、その結果、リソソームの酸性化がさらに不適切になり、タンパク質凝集体の除去が減少します(Guo, 2017)。Aβ凝集体への長時間の曝露は、リソソーム膜の透過性を高めることで、ミクログリアのオートファジーおよびリソソームの機能をさらに阻害します(Pomilio, 2020)。このように、リソソーム機能不全と神経毒性タンパク質凝集体の蓄積のフィードフォワードメカニズムが、アルツハイマー病におけるさらなる神経変性を引き起こす可能性があります。
パーキンソン病(PD)
パーキンソン病(PD)は、アルツハイマー病に次いで2番目に多い神経変性疾患であり、運動機能および非運動機能の著しい変化を特徴とする疾患です。PDの主な神経病理学的特徴は、黒質内のドーパミン作動性ニューロンの死です。PDではまた、レビー小体の主要成分であるα-シヌクレイン(α-Syn)タンパク質の凝集体の存在が顕著です。PDにおけるタンパク質の凝集は主に神経細胞で認められますが、アストロサイトやミクログリアにも存在します(Tremblay, 2019)。アストロサイトやミクログリアは、神経細胞から分泌されたα-シヌクレインがリソソーム依存的に分解される際の細胞内取り込みにおいて重要な役割を果たしている可能性があります(Lee, 2010;Choi, 2020)。ミクログリアは、α-シヌクレインの取り込みを担う主要なスカベンジャーですが(Filippini, 2019)、アストロサイトによるα-シヌクレインの過剰な取り込みは、リソソーム経路を圧倒し、アストロサイトに特異的にα-シヌクレインが沈着する可能性があります(Tremblay, 2019)。
ロイシンリッチリピートキナーゼ2(LRRK2)とグルコセレブロシダーゼ(GBA)は、パーキンソン病に関連する最も一般的な遺伝子の2つです(Pang, 2022)。また、どちらもアストロサイトとミクログリアにおけるリソソーム機能において重要な役割を果たしています(Tremblay, 2019)。アストロサイトでは、LRRK2はリソソーム関連膜タンパク質(LAMP)と共局在することが分かっています。LAMPは、分解のためのエンドソームおよびオートファゴソームとリソソームの融合を促進する上で重要です(Henry, 2015;Tremblay, 2019)。PDと関連付けられているLRRK2の変異は、リソソームが肥大化し、分解能力が低下したアストロサイトを示します(Henry, 2015)。LRRK2は、TFEBへの影響を介して、アストロサイトおよびミクログリアにおけるリソソーム分解を負に調節することが示されています(Henry, 2015;Yadavalli, 2023)。LRRK2活性が高くなると、アストロサイトにおけるリソソーム数が減少し、ミクログリアにおけるリソソーム加水分解酵素の発現が減少します(Henry, 2015;Yadavalli, 2023)。GBA遺伝子は、リソソーム酵素であるグルコセレブロシダーゼ(GCase)をコードしており、この酵素もまたPDと関連していることがよく知られています。GBAは、神経変性への反応としてアストロサイトとミクログリアの動員に関与しています(Tremblay, 2019)。さらに、GBAのノックダウンはGCase活性を低下させ、リソソームの機能不全を引き起こし、α-シヌクレイン凝集体の蓄積を増大させる可能性があります(Schöndorf, 2014)。したがって、パーキンソン病と最も関連性の高い2つの遺伝子は、アストロサイトおよびミクログリア内のリソソーム機能に影響を及ぼしているようです。
筋萎縮性側索硬化症(ALS)
ALSは、中枢神経系の運動ニューロンの変性によって特徴づけられる致死性の疾患です。この疾患の主な遺伝的要因のひとつとして、第9染色体オープンリーディングフレーム72遺伝子(C9orf72)の非コード領域におけるヘキサヌクレオチドリピート伸長が発見されています(Root, 2021)。興味深いことに、C9orf72遺伝子の変異はリソソーム機能においても重要な役割を果たしていることが示されています。C9orf72タンパク質はリソソームに局在し(Amick, 2016;Laflamme, 2019)、ミクログリアで高発現しています(O’Rourke, 2016)。C9orf72の変異はリソソームの酸性化を妨げ、分解の低下につながります(Shao, 2019)。さらに、C9orf72ノックアウトマウスでは、ミクログリアにおいて分解のためのリソソーム輸送が特に障害されています(O’Rourke, 2016)。C9orf72変異によって引き起こされるリソソーム分解経路の機能障害は、ALSにおける神経変性の一因となるタンパク質凝集体の蓄積につながる可能性があります(Root, 2021)。
Transactive response DNA binding protein 43 kDa (TDP-43) は、TARDBP遺伝子によってコードされるタンパク質であり、ALSとも関連しています(Root, 2021)。 TDP-43は、リソソームおよびリソソーム分解経路の正常な機能にとって重要です。 たとえば、TDP-43は、リソソーム機能および生合成の制御を担うTFEBの発現を媒介します(Root, 2021)。さらに、TDP-43の変異はリソソーム機能不全と関連しています(Kreiter, 2018)。興味深いことに、ミクログリアにおけるTDP-43の損失は、リソソームの新生を促進し、ミクログリアの貪食作用とタンパク質凝集体の除去を促進することが示されています(Paolicelli, 2017)。TDP-43凝集体は、ALSを含む多くの神経変性疾患において、ニューロンやグリアにも蓄積することがあります(Root, 2021)。過剰なTDP-43はリソソームの分解能力を妨害し、異常なオートファジーを誘発するだけでなく、TDP-43凝集体の除去能力も低下させる可能性があります(Leibiger, 2018)。この影響は非常に有害であり、ALSにおけるTDP-43凝集体の除去は、他の分解システムが過負荷状態になるにつれ、オートファジー-リソソーム経路に依存するようになるためです(Root, 2021)。
神経変性疾患の治療にライソゾーム機能を標的とするのはなぜでしょうか?
神経変性疾患とリソソーム機能不全との関連を示す有力な証拠があります。そのため、リソソーム機能を改善または回復させる治療戦略は、神経変性の病理学的症状を軽減するために活用することができます。関連する戦略は、リソソーム機能を回復または改善することで、タンパク質凝集体の除去を増加させることを目的としている場合が多くあります。例えば、現在、第2相プラセボ対照臨床試験(NCT02914366)が進行中で、リソソーム酵素GCaseの活性を高め、マウスのα-シヌクレイン凝集体を減少させることが示されているアンブロキソールが試験されています(Migdalska-Richards, 2016)。臨床試験で検討されている別の方法として、中枢神経系(CNS)のリソソーム機能障害を修正するためのLRRK2阻害剤の使用があります(NCT04557800およびNCT04056689)。これらのLRRK2阻害剤は、健常対照者およびパーキンソン病患者の両者において、概ね安全で耐容性が高いことが分かっていますが、その有効性についてはまだ分かっていません(Jennings, 2023)。
リソソームを介した神経変性疾患の治療の一般的な標的は、リソソームの生合成と機能に深く関与する TFEB です(Kim, 2025)。 TFEB は、ラパマイシンなどの分子によって達成される哺乳類ラパマイシン標的タンパク質(mTOR)経路の阻害によって活性化することができます(Kim, 2025)。他の分子もmTOR非依存経路でTFEBを増加させることができ、Aβタンパク質凝集体の分解を増加させることが示されています(Portbury, 2017)。さらに、TFEBの活性化は、他の上流過程の阻害によっても達成できます。例えば、脂質キナーゼPIKfyveをAIT-101で選択的に阻害すると、TFEBが活性化され、TDP-43凝集体のリソソームによる除去が促進され、ALSのマウスモデルにおける神経炎症と機能障害が軽減されます(Young, 2023)。TFEBを活性化し、特にグリア細胞におけるリソソームクリアランスを促進する分子のさらなる開発は、神経変性疾患の治療に大きな可能性を示しています。TFEBおよびオートファジーに関与する他のタンパク質の産生を高めることで、神経炎症と闘い、α-シヌクレイン凝集体の除去を行うために、ミクログリアの活性化が改善されます(Chen, 2021)。さらに、TFEBの発現が増加すると、リソソームの新生とアストロサイトのAβおよびタウ凝集体の取り込みも促進されます(Xiao, 2014;Martini-Stoica, 2018)。グリア細胞のリソソーム機能を回復させることは、神経変性疾患の治療における新たなアプローチとなる可能性があります。
神経変性疾患におけるミクログリアとアストロサイトのリソソーム機能障害に関するご質問や、治療効果研究に使用しているAD、ALS、PDモデルに関する具体的な情報については、お気軽にお問い合わせください。
神経変性疾患モデルについてさらに詳しく知る
関連コンテンツ
ミクログリアとアストロサイトにおけるリソソーム機能障害に関する最新情報と、神経変性疾患動物モデルにおける治療薬の評価に関するベストプラクティス。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。
オートファジーと転写因子EB(TFEB)
転写因子TFEB(Transcription Factor EB)の概要と、オートファジーおよび神経変性疾患における役割について。
オートファジーと神経変性疾患
細胞性オートファジーが脳の健康と神経変性において果たす役割についての概要。
オートファジー、パーキンソン病、ドーパミン作動性ニューロン
パーキンソン病における障害のあるオートファジーが、ドーパミン作動性ニューロンにおける病理学的変化と神経変性につながる仕組みの概要。