この資料では以下について説明しております:
TREM2とは何でしょうか?
TREM2(Triggering receptor expressed on myeloid cells 2)は、I型膜貫通糖タンパク質であり、中枢神経系(CNS)内のミクログリアやその他の骨髄系細胞(樹状細胞や顆粒球など)において、自然免疫受容体として機能します。このタンパク質はTREM2遺伝子によってコード化され、TREM1も含まれるTREMスーパーファミリーに属します(Gratuze, 2018;Li, 2023)。TREM2は、脳の恒常性維持や様々な病態への対応において重要な役割を果たしています(Qin, 2021;Li, 2023;Shi, 2025)。
シグナル伝達カスケード:
- TREM2は、細菌由来成分、リン脂質、糖脂質、APOE、APOJ、アミロイドβオリゴマー、TDP-43など、多様なリガンドに対するセンサーとして機能します(Filipello, 2022;Tagliatti, 2024;Shi, 2025)。
- TREM2はアダプタータンパク質DAP12およびDAP10と相互作用し、免疫受容体チロシン活性化モチーフ(ITAM)を介したリン酸化が促進されます(Ulland, 2018;Li, 2023;Shi, 2025)。
- この相互作用は、脾臓チロシンキナーゼ(SYK)の活性化や、PI3K/AKT、mTOR、MAPK、NF-κBなどの様々な下流経路を含む細胞内イベントを引き起こします(Ulland, 2018;Li, 2023;Shi, 2025)。
- 可溶性TREM2(sTREM2)は、α-セクレターゼ(ADAM10、ADAM17)によるTREM2の細胞外ドメインのタンパク質分解的切断によっても生成され、これにより可溶性細胞外ドメインが脳脊髄液(CSF)や血漿などの細胞外空間に放出されます。さらに、sTREM2はTREM2 mRNAのオルタナティブスプライシングによって直接生成されることもあります(Ulland, 2018;Filipello, 2022;Hou, 2022;Tagliatti, 2024)。sTREM2は、脳内のミクログリア活性化および神経炎症のバイオマーカーと見なされています(Filipello, 2022;Li, 2023)。
シグナル伝達カスケードを通じて、TREM2の主な機能には以下が含まれます:
- 損傷の感知:TREM2リガンドは、組織損傷、神経細胞死、脱髄、病理学的タンパク質凝集体の存在と頻繁に関連しています(Filipello, 2022;Tagliatti, 2024;Shi, 2025)。
- ミクログリアの生存と増殖:ITAM/Syk経路はPI3K/AKT/mTORシグナル伝達経路を活性化し、アポトーシス経路を抑制するだけでなく、細胞増殖シグナルを刺激します(Wang, 2015;Ulland, 2018;Qin, 2021;Shi, 2025)。
- 貪食作用と細胞残骸の除去:TREM2は、ジアシルグリセロール(DAG)およびプロテインキナーゼC(PKC)の活性化とともにカルシウムの動員を媒介し、貪食作用の鍵となる細胞骨格の再編成をもたらします。最終的に、TREM2はアポトーシス神経細胞、ミエリン残骸、およびアルツハイマー病(AD)におけるβアミロイド凝集体や筋萎縮性側索硬化症(ALS)および前頭側頭型認知症(FTD)におけるTDP-43などの異常折り畳みタンパク質を含む細胞残骸の取り込みと除去を促進します(Lue, 2015;Gratuze, 2018;Qin, 2021;Li, 2023;Shi, 2025)。神経変性疾患における貪食作用の詳細については、当リソース「ミクログリア-ニューロン相互作用と神経変性疾患」をご参照ください。
- 炎症調節:TREM2は、PI3K/AKT/Fox03aおよびPI3K/AKT/GSK3b経路を介して、ミクログリアにおける炎症促進応答の負の調節因子として一般的に機能し、IL-10およびTGF-βの分泌を促進すると同時に、炎症促進性サイトカイン(TNF-α、 IL-1β)を抑制します。しかしながら、NF-κBおよびMAPK経路を介して、炎症促進性サイトカインの産生を刺激し、食作用を増強することもあります(Gratuze, 2018;Li, 2023;Shi, 2025)。
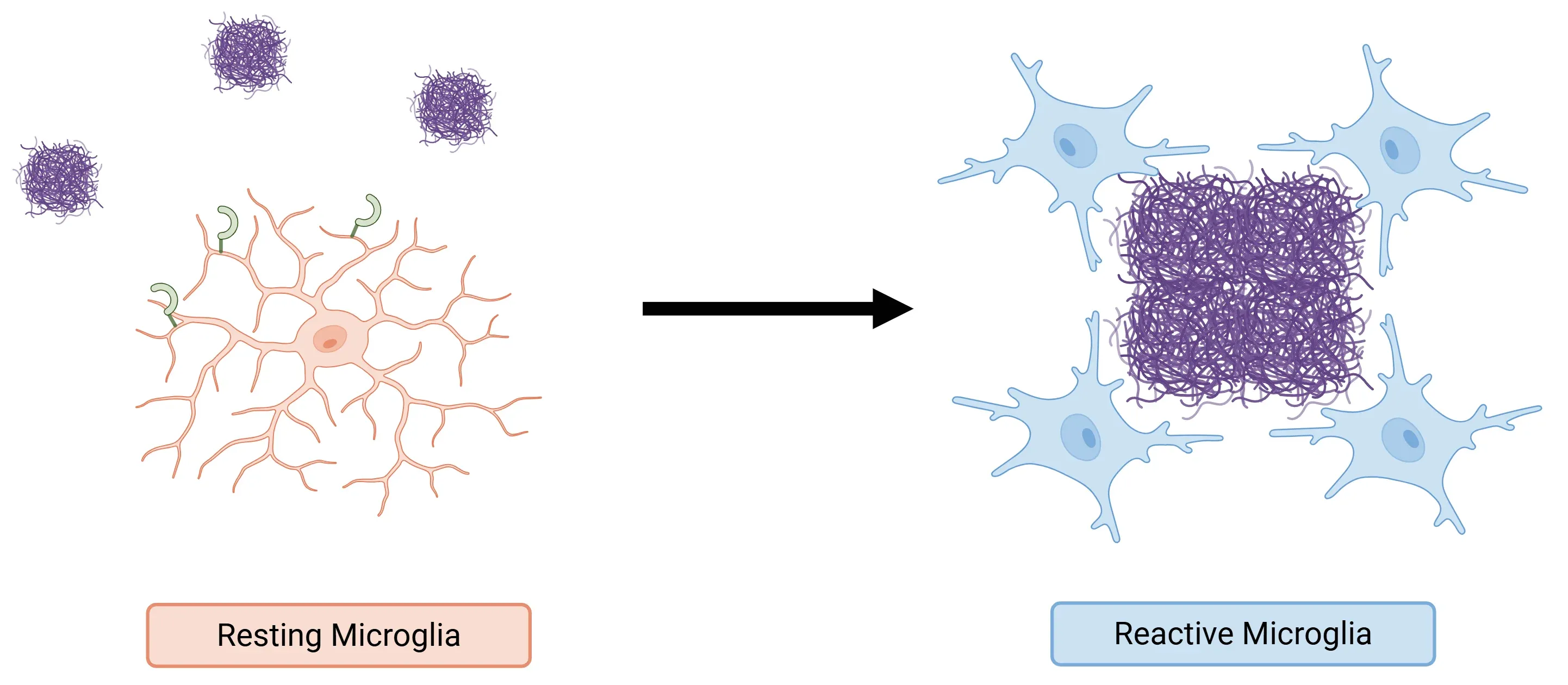
- 疾患関連ミクログリア(DAM)の調節:TREM2は、ミクログリアが恒常性状態からDAM表現型へ移行する過程において重要な役割を果たします。このDAM状態は、アルツハイマー病(AD)などの疾患において神経変性を緩和する保護効果をもたらすと考えられています(Filipello, 2022;Basha, 2023;Li, 2023;Tagliatti, 2024)。
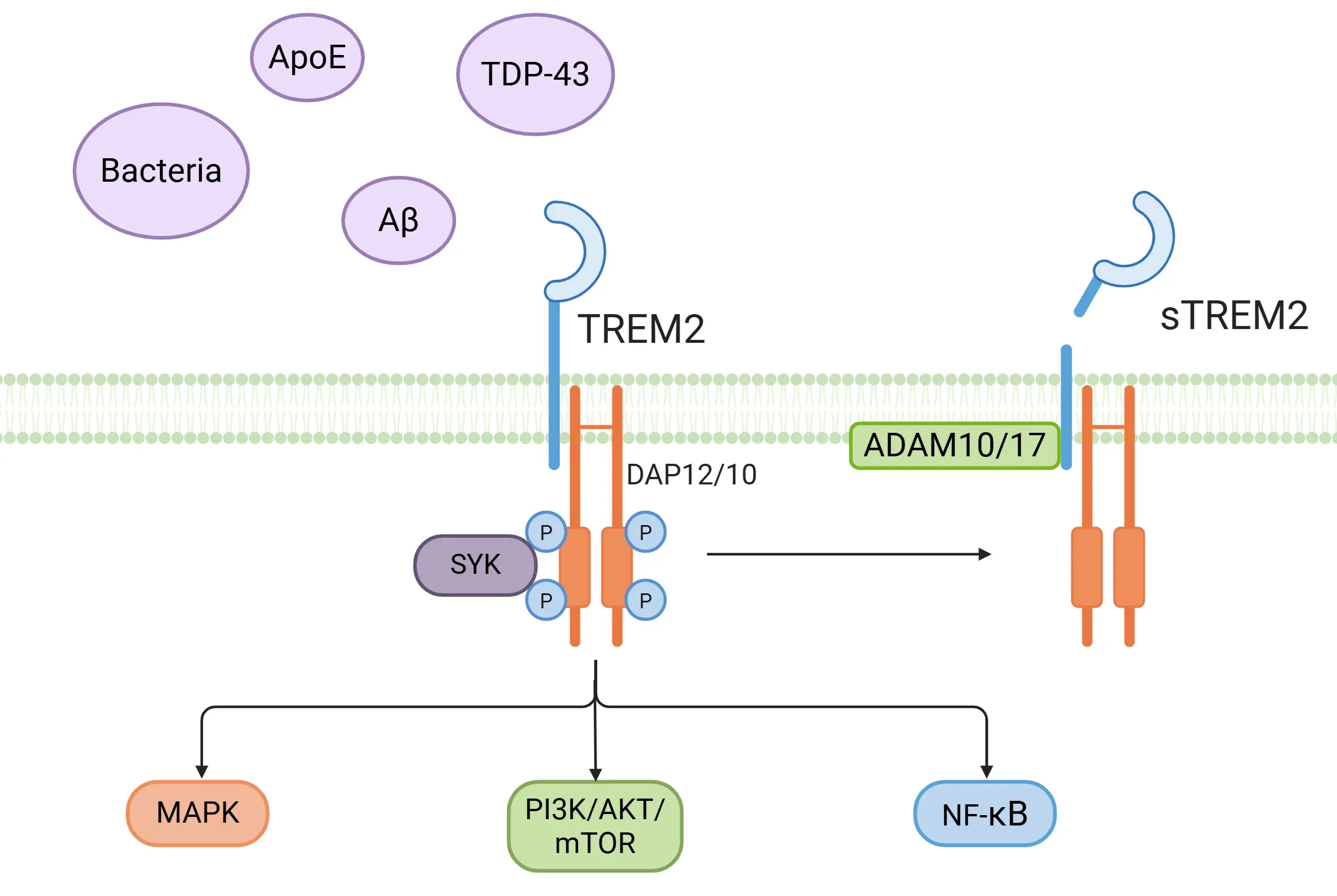
TREM2シグナル伝達カスケード。様々なリガンドによるTREM2受容体の活性化は、異なるシグナル伝達経路を誘導し、可溶性TREM2(sTREM2)の放出を引き起こします。
TREM2は神経変性疾患においてどのような役割を果たしているのでしょうか?
TREM2は、脳の恒常性維持に不可欠であり、神経疾患において重要な役割を果たすミクログリアの機能において、極めて重要な役割を担っています。TREM2は一般的に保護機構を促進しますが、この分子の調節異常は炎症の増大を招き、神経変性疾患の一因となる可能性があります。
TREM2遺伝子の両アレル変異は、ナス・ハコラ病として知られる稀な常染色体劣性疾患を引き起こします。この疾患は多発性脂肪膜性骨異形成症を伴い、硬化性白質脳症を併発します。その結果、患者はしばしば若年性認知症を発症します(Carmona, 2018;Kiianitsa, 2024)。
TREM2遺伝子変異のヘテロ接合体は、ミクログリア活性化を抑制し炎症反応を調節不能にすることで、遅発性アルツハイマー病発症リスクを高めます。神経変性疾患の中でも、TREM2のアルツハイマー病における役割は最も広く研究されています。以下にTREM2の関与の概要を示します:
- TREM2はリン脂質、ApoE含有リポタンパク質、βオリゴマーなどのリガンドと相互作用し、アダプター分子DAP12に結合します。この相互作用により下流のシグナル伝達カスケードが活性化され、ミクログリアの生存・増殖・走化性、ならびにアポトーシスを起こした神経細胞や残骸の貪食が促進されます(Zhang, 2025)。
- また、TREM2シグナル伝達カスケードは、恒常性ミクログリアがアミロイド斑周囲に集積するDAM(病態関連ミクログリア)へ移行する過程を促進します。これらのDAMは斑を凝縮させ、特にAD初期段階において神経突起変性を抑制する保護バリアを形成します(Zhang, 2025)。
- マウスモデルにおいて、TREM2欠損はアミロイドβ斑塊周囲のDAM集積を減少させ、より拡散性の斑塊、Aβ42/Aβ40比の上昇、軸索損傷の増加を引き起こします。一方、TREM2の過剰発現またはアゴニスト抗体による治療は、ミクログリアの応答を回復させ、プラークの除去を促進し、グルコース代謝を改善することが示されています(Ulland, 2018;Zhang, 2025)。
- TREM2のタウ病理における役割は複雑であり、結果が混在しています。タウの蓄積と伝播を抑制するその効果は、アミロイドβプラークの存在下に限られます(Zhang, 2025)。
- 機能喪失変異体(R47H、R62H、H157Yなど)はリガンド親和性を低下させるか、細胞外ドメインの切断を増加させ、それによってミクログリア活性化と細胞代謝を阻害します。これはアミロイドとタウの両方の病理を悪化させ、ADリスクを高めます(Guerreiro, 2013;Gratuze, 2018;Zhang, 2025)。
- ADAM媒介による切断で生成されるsTREM2は、AD初期段階で脳脊髄液(CSF)に現れます。sTREM2はミクログリア活性化および認知機能低下の遅延と相関し、βオリゴマーに結合して凝集を抑制するため、有望な診断バイオマーカーおよび治療標的となります(Zhang, 2025)。
TREM2は、その正確な役割は依然として不明確ではありますが、アルツハイマー病以外の神経変性疾患にも関与しているようです(Carmona, 2018;Kiianitsa, 2024;Awuah, 2025):
- 稀なヘテロ接合型TREM2変異は前頭側頭型認知症(FTD)のリスク増加と関連付けられており、p.Arg47His変異はパーキンソン病(PD)患者集団で観察されています。しかしながら、これらの疾患における関連性は一貫しておらず、集団によって差異が見られます(Carmona, 2018;Huang, 2023)。
- TREM2変異と筋萎縮性側索硬化症(ALS)、レビー小体型認知症、クロイツフェルト・ヤコブ病、虚血性脳卒中などの疾患リスクとの関連性を調査する研究も存在します。しかしながら、これらの関連性研究では結果が分かれており、TREM2がこれらの疾患に影響を与えるメカニズムについては、まだ解明されていない部分が残されています(Carmona, 2018;Awuah, 2025)。
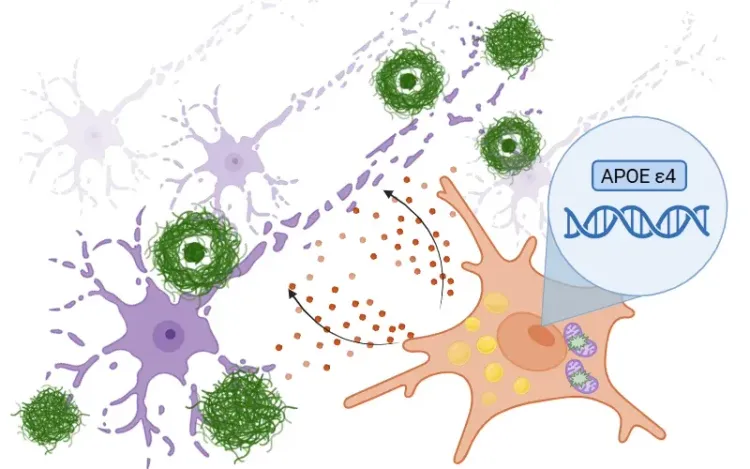
ADにおけるTREM2の役割。アミロイドβに結合することによって、TREM2はミクログリアを活性化し、DAMに変化させる。これらの細胞はアミロイド斑の周囲に集まり、病気の初期段階でアミロイド斑によって引き起こされるダメージを軽減する。
TREM2は治療標的となり得るのでしょうか?
TREM2は、アルツハイマー病(AD)およびその他の神経変性疾患に対する有望な治療標的と考えられます。その作用機序としては、TREM2シグナル伝達はミクログリアの生存、増殖、脂質代謝、ならびにβアミロイドおよびデブリスの貪食作用を促進し、それによってプラーク形成と神経突起ジストロフィーを抑制します。
前臨床研究はTREM2の治療的潜在性を支持しています:
- 4D9やAL002などのTREM2アゴニスト抗体は、ADトランスジェニックマウスモデルにおいて、ミクログリアの増殖促進、プラークの圧縮改善、脳内グルコース代謝の増強を示すことが確認されています(van Lengerich, 2023;Awuah, 2025)。
- 転移リンタンパク質受容体結合部位を介して血液脳関門(BBB)を通過するATV:TREM2抗体は、ADマウスモデルにおいてミクログリアの活性およびグルコース代謝を促進します(van Lengerich, 2023)。
- TREM2遺伝子を過剰発現する5xFADマウスモデルでは、アミロイドβの貪食作用の改善と認知機能の向上が確認されています(Li, 2023)。
- 可溶性TREM2(sTREM2)の具体的な役割は依然として不明ですが、sTREM2を投与するとアミロイド形成マウスにおける神経突起ジストロフィーが軽減されることが判明しています。しかしながら、トランスジェニックマウスにおけるTREM2の脱落変化は、アミロイド沈着の増加につながる可能性があります(Zhang, 2025)。
これらの知見の臨床応用は既に進行中です:
- ヒト化抗体AL002は第1相安全性試験を完了し、重篤な有害事象を伴わない良好な忍容性を示しました(Wang, 2015;Long, 2024)。しかしながら、第2相試験の結果は良好な結果をもたらしませんでした。
- VHB937はTREM2作動型モノクローナル抗体であり、ミクログリアの貪食作用および走化性を増強することが示されています。この治療薬は現在、ALS治療を目的とした第2相臨床試験において評価が進められています(Noh, 2025)。
- TREM2の役割は複雑であり、その活性化はアミロイド種形成の初期段階で最も有益と考えられます。疾患の後期段階では異なる戦略が必要となる可能性があり、末梢骨髄系細胞へのオフターゲット効果についても考慮しなければなりません(Zhang, 2025)。
要約しますと、TREM2はアルツハイマー病およびその他の神経変性疾患に対する治療標的として大きな可能性を示しています。前臨床研究では、ミクログリア機能の増強と認知機能改善におけるその役割が強調されています。しかしながら、TREM2が疾患進行において複雑な役割を担っているため、慎重な検討が必要です。神経変性に対する効果的な介入を実現するため、TREM2を標的とした治療法を最適化するための継続的な研究が極めて重要です。
当チームは、TREM2およびミクログリアに関するご質問や、治療効果研究に使用している神経変性疾患モデルに関する具体的な情報について、喜んでご回答いたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経変性疾患モデル動物における治療薬の評価に関する最新情報とベストプラクティス。
APOE4、ミクログリア、およびアルツハイマー病
アポE4がアルツハイマー病におけるミクログリアの活動に及ぼす影響と、標的治療法の開発に関する概説。
ミクログリアとニューロンの相互作用と神経変性疾患
ミクログリアとニューロンの直接的な相互作用、およびこれらの細胞間相互作用が神経変性疾患においてどのように影響を受けるかについて簡潔にレビューします。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。
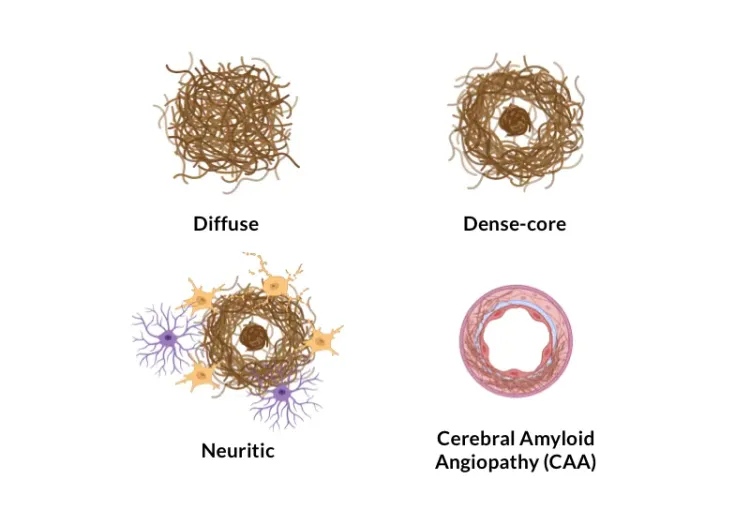
アルツハイマー病におけるアミロイドβプラーク分析
ヒトおよびアルツハイマー病動物モデル(トランスジェニックマウスおよびラット)の脳組織切片におけるAβプラークの分類および定量化方法の概要。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。