이 자료는 다음을 설명합니다:
TREM2란 무엇인가?
TREM2(Triggering receptor expressed on myeloid cells 2)는 제1종 막횡단 당단백질로, 중추신경계(CNS) 내 미세아교세포 및 기타 골수세포(예: 수지상세포, 과립구)에서 선천성 면역 수용체 역할을 합니다. 이 단백질은 TREM2 유전자에 의해 암호화되며 TREM1을 포함하는 TREM 슈퍼패밀리에 속합니다(Gratuze, 2018; Li, 2023). TREM2는 뇌의 항상성 유지와 다양한 병리적 상태에 대한 반응에 중요한 역할을 합니다(Qin, 2021; Li, 2023; Shi, 2025).
신호 전달 경로:
- TREM2는 박테리아 유래 성분, 인지질, 당지질, APOE, APOJ, 아밀로이드 베타 올리고머, TDP-43 등을 포함한 다양한 리간드의 센서 역할을 합니다(Filipello, 2022; Tagliatti, 2024; Shi, 2025).
- TREM2는 어댑터 단백질 DAP12 및 DAP10과 상호작용하여 면역수용체 티로신 기반 활성화 모티프(ITAM)에 의해 촉진되는 인산화를 유발합니다(Ulland, 2018; Li, 2023; Shi, 2025).
- 이러한 상호작용은 비장 티로신 키나아제(SYK)의 활성화 및 PI3K/AKT, mTOR, MAPK, NF-κB와 같은 다양한 하류 경로의 활성화를 포함한 세포 내 사건을 유발합니다(Ulland, 2018; Li, 2023; Shi, 2025).
- 가용성 TREM2(sTREM2)는 또한 α-세크레타제(ADAM10, ADAM17)에 의한 TREM2의 외막 도메인의 단백질 분해 절단을 통해 유래될 수 있으며, 이는 가용성 외막 도메인을 뇌척수액(CSF) 및 혈장을 포함한 세포외 공간으로 방출합니다. 또한, sTREM2는 TREM2 mRNA의 대체 스플라이싱을 통해 직접 생성될 수도 있습니다 (Ulland, 2018; Filipello, 2022; Hou, 2022; Tagliatti, 2024). sTREM2는 뇌에서 미세아교세포 활성화 및 신경 염증의 바이오마커로 간주됩니다 (Filipello, 2022; Li, 2023).
신호 전달 계통을 통해 TREM2의 주요 기능은 다음과 같습니다:
- 손상 감지: TREM2 리간드는 조직 손상, 신경세포 사멸, 탈수초화, 병리적 단백질 응집체 존재와 빈번히 연관됩니다(Filipello, 2022; Tagliatti, 2024; Shi, 2025).
- 미세아교세포 생존 및 증식: ITAM/Syk 경로는 PI3K/AKT/mTOR 신호전달 경로를 활성화하여 세포사멸 경로를 억제할 뿐만 아니라 세포 성장 신호를 자극합니다(Wang, 2015; Ulland, 2018; Qin, 2021; Shi, 2025).
- 식균 작용 및 잔해물 제거: TREM2는 칼슘의 동원, 디아실글리세롤(DAG) 및 단백질 키나아제 C(PKC)의 활성화를 매개하여 식균 작용에 핵심적인 세포골격 재구성을 유도합니다. 궁극적으로 TREM2는 세포 사멸 신경세포, 미엘린 잔해, 그리고 알츠하이머병(AD)의 아밀로이드 베타 응집체, 근위축성 측삭경화증(ALS) 및 전두측두엽치매(FTD)의 TDP-43과 같은 잘못 접힌 단백질을 포함한 세포 잔해의 포식과 제거를 촉진합니다(Lue, 2015; Gratuze, 2018; Qin, 2021; Li, 2023; Shi, 2025). 신경퇴행성 질환에서의 식작용에 대한 자세한 내용은 "미세아교세포-뉴런 상호작용 및 신경퇴행성 질환" 리소스를 참조하십시오.
- 염증 조절: TREM2는 일반적으로 PI3K/AKT/Fox03a 및 PI3K/AKT/GSK3b 경로를 통해 미세아교세포에서 전염증 반응의 부정적 조절자 역할을 하여, IL-10 및 TGF-β의 분비를 촉진하는 한편 전염증성 사이토카인(TNF-α, IL-1β)을 억제합니다. 그러나 NF-κB 및 MAPK 경로를 통해 전염증성 사이토카인의 생성을 자극하고 식세포 작용을 강화할 수도 있습니다 (Gratuze, 2018; Li, 2023; Shi, 2025).
- 질병 관련 미세 아교 세포(DAM)의 조절: TREM2는 미세 아교 세포가 항상성 상태에서 DAM 표현형으로 전환되는 데 중요한 역할을 합니다. 이 DAM 상태는 알츠하이머병(AD)과 같은 질환에서 신경 퇴화를 완화하여 보호 효과를 제공하는 것으로 생각됩니다 (Filipello, 2022; Basha, 2023; Li, 2023; Tagliatti, 2024).
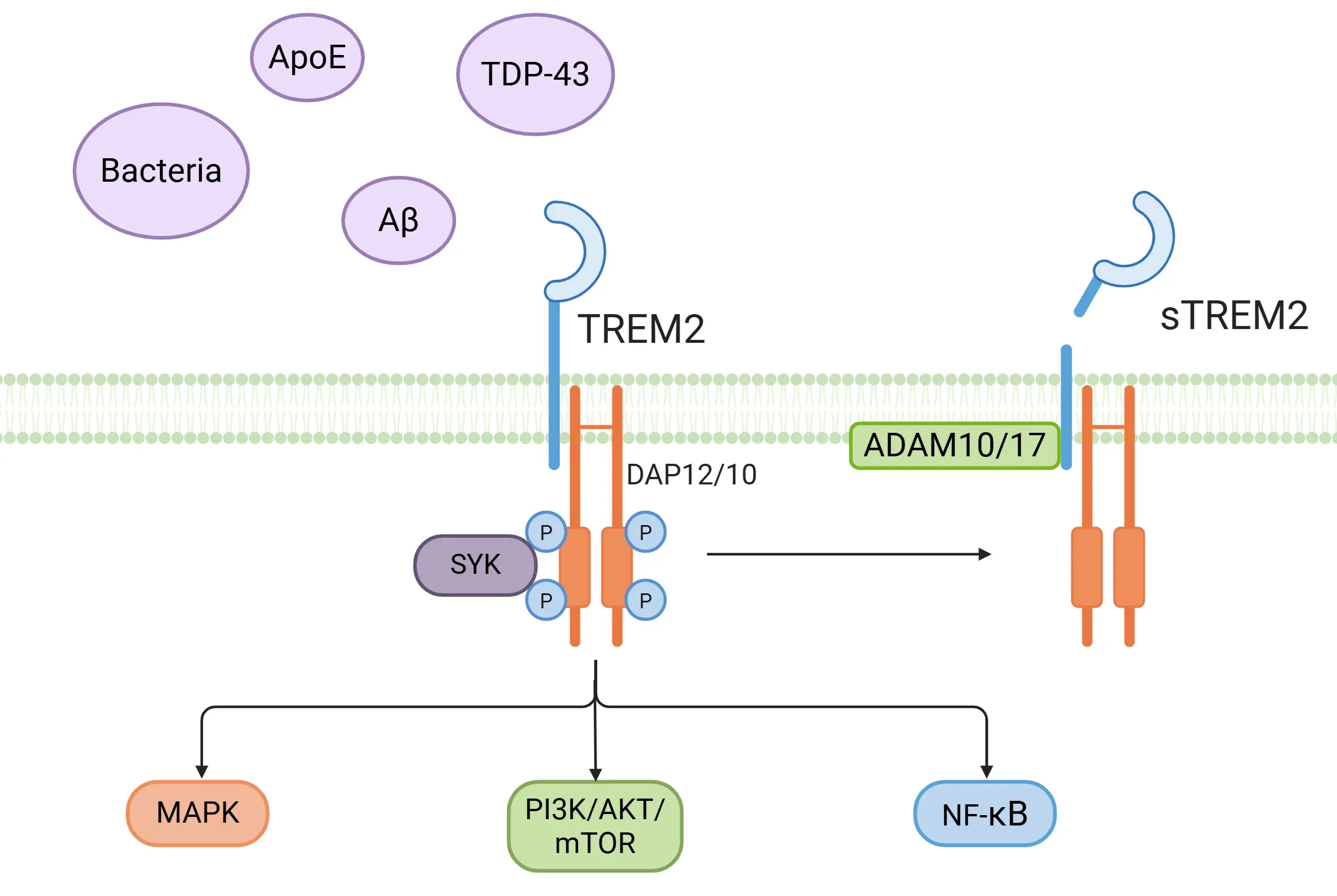
TREM2 신호 전달 경로. 다양한 리간드에 의한 TREM2 수용체 활성화는 서로 다른 신호 전달 경로를 유발하고 용해성 TREM2(sTREM2)의 분비를 촉진한다.
TREM2는 신경퇴행성 질환에서 어떤 역할을 하는가?
TREM2는 미세아교세포의 기능에 중요한 역할을 하며, 이는 뇌의 항상성 유지에 필수적이며 신경계 질환에 상당한 영향을 미칩니다. TREM2는 일반적으로 보호 기전을 촉진하지만, 이 분자의 조절 이상은 염증 증가로 이어져 신경퇴행성 질환에 기여할 수 있습니다.
TREM2 유전자의 양알레일 돌연변이는 나스-하코라병(Nasu-Hakola disease)으로 알려진 희귀한 상염색체 열성 질환을 유발한다. 이 질환은 경화성 백질뇌병증을 동반한 다낭성 지방막성 골이형성증을 초래한다. 그 결과, 환자들은 종종 조기 발병 치매를 경험한다(Carmona, 2018; Kiianitsa, 2024).
TREM2 유전자 돌연변이의 이형접합 변이체는 미세아교세포 활성화를 감소시키고 염증 반응을 조절 장애를 일으켜 후기 발병 알츠하이머병(AD) 발병 위험을 증가시킵니다. 신경퇴행성 질환 중 TREM2의 AD에서의 역할은 가장 광범위하게 연구되었습니다. 아래는 AD에서 TREM2의 관여에 대한 개요입니다:
- TREM2는 인지질, ApoE 함유 지단백질 또는 β-아밀로이드 올리고머와 같은 리간드와 상호작용하여 어댑터 단백질 DAP12에 결합합니다. 이 상호작용은 미세아교세포의 생존, 증식, 화학주행 및 사멸 신경세포와 잔해의 식작용을 촉진하는 하류 신호 전달 경로를 활성화합니다(Zhang, 2025).
- TREM2 신호 전달 경로는 또한 항상성 미세아교세포가 아밀로이드 플라크 주변에 집적되는 DAM(병리적 활성 미세아교세포)으로 전환되도록 촉진합니다. 이러한 DAM은 플라크를 압축하고 보호 장벽을 형성하여, 특히 AD 초기 단계에서 신경돌기 위축을 제한합니다(Zhang, 2025).
- 마우스 모델에서 TREM2 결핍은 아밀로이드 베타 플라크 주변에 집적하는 DAM의 수를 감소시켜 플라크의 확산을 증가시키고, Aβ42/Aβ40 비율을 상승시키며, 축삭 손상을 증가시킵니다. 반대로 TREM2 과발현 또는 작용제 항체 치료는 미세아교세포 반응을 회복시키고, 플라크 제거를 촉진하며, 포도당 대사를 개선할 수 있다(Ulland, 2018; Zhang, 2025).
- 타우 병리 에서 TREM2의 역할은 복잡하며 혼합된 결과를 보여줍니다. 타우 축적 및 전파 제한에 대한 그 효과는 아밀로이드 베타 플라크의 존재로 제한됩니다 (Zhang, 2025).
- 기능 상실 변이체(R47H, R62H, H157Y 등)는 리간드 친화도를 감소시키거나 세포외도메인 분비를 증가시켜 미세아교세포 활성화 및 세포 대사를 손상시킵니다. 이는 아밀로이드 및 타우 병리를 모두 악화시키고 AD 위험을 높입니다(Guerreiro, 2013; Gratuze, 2018; Zhang, 2025).
- aDAM 매개 분비로 생성된 sTREM2는 AD 초기 단계에서 뇌척수액(CSF)에 나타난다. sTREM2는 미세아교세포 활성화 및 느린 인지 기능 저하와 상관관계를 보이며, Aβ 올리고머에 결합하여 응집을 억제할 수 있어 유망한 진단 바이오마커 및 치료 표적이 된다(Zhang, 2025).
TREM2는 정확한 역할은 아직 명확하지 않지만, 알츠하이머병을 넘어선 신경퇴행성 질환에도 관여하는 것으로 보인다(Carmona, 2018; Kiianitsa, 2024; Awuah, 2025):
- 희귀한 이형접합 TREM2 변이는 전두측두엽치매(FTD) 발병 위험 증가와 연관되었으며, p.Arg47His 변이는 파킨슨병 (PD) 집단에서 관찰되었다. 그러나 이러한 질환과의 연관성은 여전히 일관성이 없으며 집단에 따라 차이가 있다(Carmona, 2018; Huang, 2023).
- TREM2 변이와 ALS, 루이체 치매, 크로이츠펠트-야콥병, 허혈성 뇌졸중 등의 질환 위험 간 연관성을 조사한 연구들이 존재한다. 그럼에도 이러한 연관성 연구들은 혼재된 결과를 보였으며, TREM2가 이들 질환에 영향을 미치는 기전은 아직 규명되지 않았다(Carmona, 2018; Awuah, 2025).
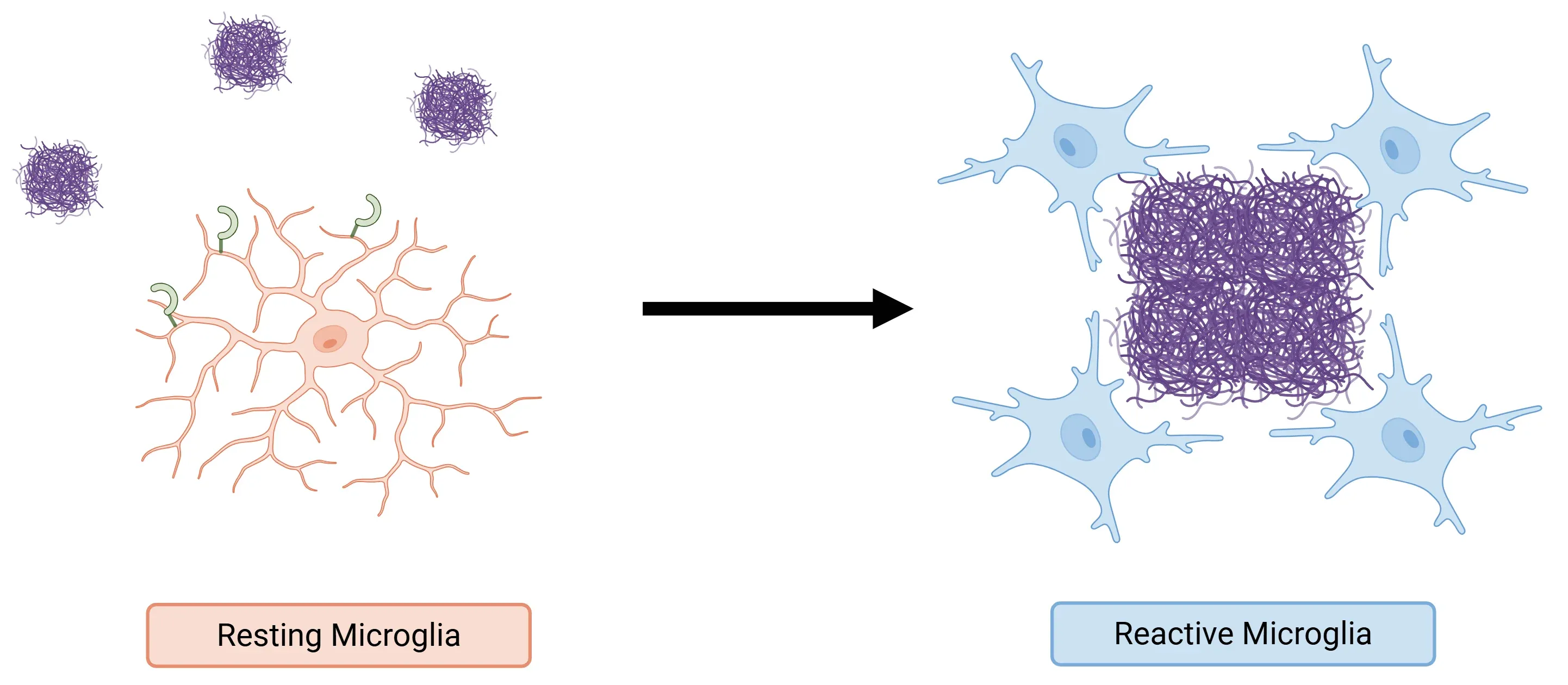
알츠하이머병에서 TREM2의 역할. TREM2는 아밀로이드베타에 결합하여 미세아교세포를 활성화하여 DAM으로 변형시킵니다. 이 세포는 아밀로이드 플라크 주위에 모여 질병의 초기 단계에서 플라크로 인한 손상을 완화합니다.
TREM2는 잠재적 치료 표적인가?
TREM2는 알츠하이머병(AD) 및 기타 신경퇴행성 질환에 대한 유망한 치료 표적이다. 기전적으로 TREM2 신호전달은 미세아교세포의 생존, 증식, 지질 대사 및 베타아밀로이드와 잔해물의 식작용을 촉진하여 플라크 형성과 신경돌기 위축을 억제한다.
TREM2의 치료 가능성은 전임상 연구를 통해 입증되었습니다:
- 4D9 및 AL002를 포함한 TREM2 작용제 항체는 AD 트랜스제닉 마우스 모델에서 미세아교세포 증식을 증가시키고, 플라크 압축을 개선하며, 뇌 포도당 대사를 향상시키는 것으로 나타났습니다(van Lengerich, 2023; Awuah, 2025).
- 트랜스페린 수용체 결합 부위를 이용해 혈뇌 장벽(BBB)을 통과하는 ATV:TREM2 항체는 AD 마우스 모델에서 미세아교세포 활동과 포도당 대사를 향상시킵니다(van Lengerich, 2023).
- tREM2 유전자를 과발현하는 5xFAD 마우스 모델에서는 아밀로이드 베타의 식균 작용이 개선되고 인지 기능이 향상된 것으로 나타났습니다(Li, 2023).
- 용해성 TREM2(sTREM2)의 구체적인 역할은 아직 불분명하지만, sTREM2 투여는 아밀로이드 생성 마우스에서 신경돌기 위축을 감소시키는 것으로 밝혀졌습니다. 그러나 트랜스제닉 마우스에서 TREM2 분비 변화는 아밀로이드 침착 증가로 이어질 수 있습니다(Zhang, 2025).
이러한 연구 결과의 임상 적용은 이미 진행 중이다:
- 인간화 항체 AL002는 1상 안전성 시험을 완료했으며, 심각한 부작용 없이 양호한 내약성을 입증했습니다(Wang, 2015; Long, 2024). 그러나 2상 시험 결과는 긍정적이지 않았습니다.
- VHB937은 미세아교세포의 식작용 및 화학주성을 증진시키는 것으로 입증된 TREM2 작용제 단일클론 항체이다. 이 치료제는 현재 ALS 치료를 위한 2상 임상시험에서 평가 중이다(Noh, 2025).
- TREM2는 복합적인 역할을 수행하며, 그 활성화는 아밀로이드 시딩 초기 단계에서 가장 유익한 것으로 보인다. 질병 후기 단계에서는 다른 전략이 필요할 수 있으며, 말초 골수계 세포에 대한 비표적 효과도 고려해야 한다(Zhang, 2025).
요약하면, TREM2는 알츠하이머병 및 기타 신경퇴행성 질환의 치료 표적으로 상당한 가능성을 보여줍니다. 전임상 연구는 미세아교세포 기능 강화 및 인지 기능 개선에서의 역할을 강조합니다. 그러나 TREM2가 질병 진행에 미치는 복잡한 역할로 인해 신중한 고려가 필요합니다. 신경퇴행성 질환에 대한 효과적인 개입을 위해 TREM2 표적 치료법을 최적화하는 지속적인 연구가 중요합니다.
저희 팀은 TREM2 및 미세아교세포에 관한 모든 질문에 기꺼이 답변해 드리며, 치료 효능 연구에 활용하는 신경퇴행성 질환 모델에 대한 구체적인 정보도 제공해 드릴 수 있습니다.
관련 콘텐츠
신경 퇴행성 질환의 동물 모델에서 치료제의 평가와 관련된 최신 정보 및 모범 사례.
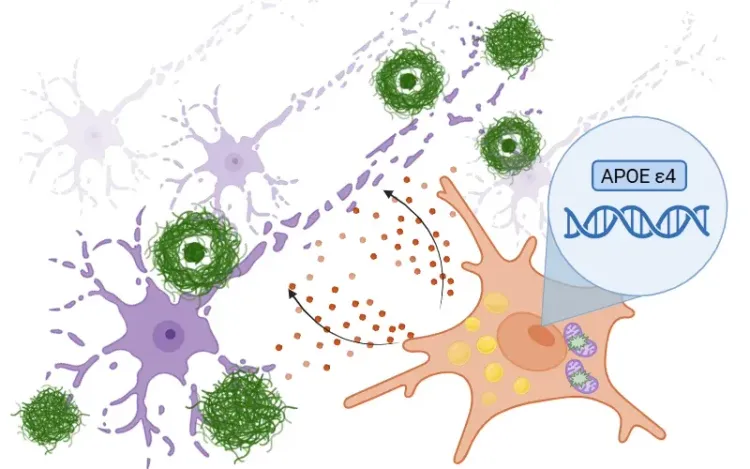
APOE4, 미세아교세포 및 알츠하이머병
알츠하이머병에서 ApoE4가 미세아교세포 활동에 미치는 영향 및 표적 치료제 개발에 관한 개요.
미세아교세포-신경세포 상호작용 및 신경퇴행성 질환
미세아교세포와 신경세포 간의 직접적인 상호작용에 대한 간결한 검토, 그리고 이러한 세포 간 상호작용이 신경퇴행성 질환에서 어떻게 영향을 받을 수 있는지.
신경 퇴행성 질환의 TNF-α & 미세 아교 세포
미세아교세포에서 종양괴사인자-알파(TNF-α)의 기능과 신경퇴행의 진행에 대한 기여에 대한 개요.
IL-1β란 무엇인가요?
IL-1β의 개요, 전신 및 신경계 질환에서의 염증 촉진 역할, 그리고 IL-1β 억제를 포함한 치료 전략.
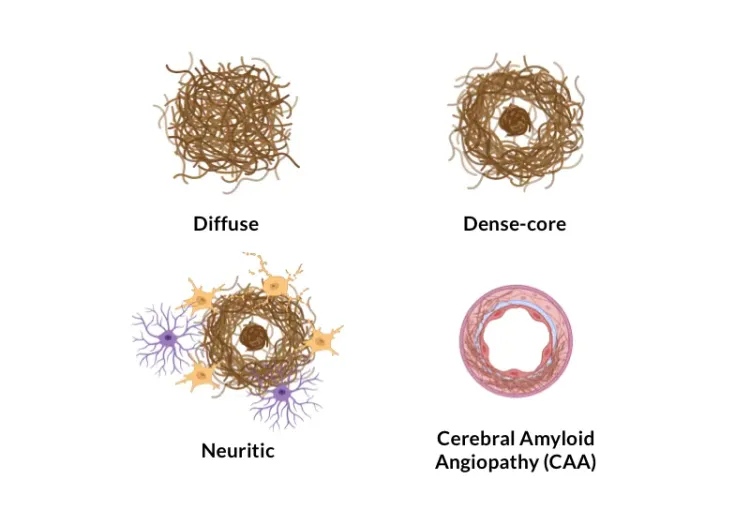
알츠하이머병의 아밀로이드-베타 플라크 분석
인간과 알츠하이머병 동물 모델(유전자 변형 쥐와 랫트)의 뇌 조직 섹션에서 Aβ 플라크를 분류하고 정량화하는 방법의 개요.
ALS, 알츠하이머병, 파킨슨병의 미세아교세포 형태학
미세아교세포 형태학적 분석의 개요와 신경퇴행성 질환 연구 및 신약 개발에 대한 응용.