この資料では以下について説明しています:
APOE ε4とは何でしょうか?
アルツハイマー病(AD)は、記憶力や認知機能の漸進的な低下を特徴とする進行性の神経変性疾患です。65歳以上の方における認知症の最も一般的な原因であり、高齢化に伴い世界的にその有病率は増加傾向にあります。この疾患は、脳内に蓄積する二つの特徴的なタンパク質、アミロイドβ(Aβ)斑とタウ線維と関連しています。これらの沈着物は神経細胞間のコミュニケーションを妨げ、細胞死や認知機能障害を引き起こします。
アルツハイマー病は、以下の2つの形態に分類されます:
- 若年性アルツハイマー病(EOAD):稀な形態で、通常65歳以前に発症します。
- 遅発性アルツハイマー病(LOAD):AD症例の95%以上を占め、通常65歳以降に発症します。
アルツハイマー病の正確な原因は未だ解明されていませんが、遺伝的要因、環境要因、生活習慣要因の複合が関与していると考えられています。中でも遺伝的素因は重要な危険因子であり、アルツハイマー病に関連する最もよく知られた遺伝的要因の一つがAPOE遺伝子です。
APOE(アポリポプロテインE)遺伝子は19番染色体上に位置し、アポリポプロテインE(ApoE)タンパク質をコードしています。このタンパク質は、脂質代謝、神経細胞の修復、中枢神経系(CNS)内の免疫機能において重要な役割を果たします。ApoEは、神経細胞の健全性とシナプス機能に不可欠なコレステロールを含む脂質の輸送に関与しています。
APOE遺伝子には、3つの主要なアイソフォーム(APOE ε2、 APOE ε3、APOE ε4 )が存在し、 これらは単一のアミノ酸置換によって区別されます。APOE ε3は 最も一般的であり 、アルツハイマー病(AD)リスクに関して「中立的」と考えられています。一方、APOE ε2は 保護的であると考えられています 。しかし、APOE ε4は 加齢性認知症(LOAD)の発症リスクを 著しく 高めます。
このリスク増加の背景にある病理学的メカニズムは複雑であり、アポE4と脳内の様々な細胞プロセスとの相互作用が関与しています。具体的には、アポE4は脂質代謝を阻害し、ミクログリア機能を乱し、βアミロイドのクリアランスを妨げると考えられており、これらすべてが脳内での毒性タンパク質の蓄積と慢性炎症に寄与します。
さらに、ApoE4はβアミロイドの凝集を促進し、神経細胞を損傷するプラークの形成を助長します。また、ApoE4はタウ病変を調節し、タウの過剰リン酸化を促進します。これは神経原線維変化(ADの特徴的な病理所見)の形成につながります。βアミロイドの除去障害、タウ凝集、神経炎症の組み合わせが疾患の進行を促進し、神経細胞の喪失と認知機能の低下を引き起こします(Shi, 2017;Najm, 2020)。
APoE4とミクログリアの相互作用は、どのようにアルツハイマー病の進行を促進するのでしょうか?
ミクログリアは中枢神経系(CNS)の常在性免疫細胞であり、脳内の細胞の約10~15%を占めています。ミクログリアは、脳環境を常に監視して損傷を検知し、老廃物を除去し、炎症を調節することで、脳の恒常性維持に不可欠な役割を果たしています。正常な状態では、ミクログリアはAβやタウなどの異常折り畳みタンパク質を含む細胞廃棄物を除去することで、神経細胞を損傷から保護し、シナプス機能をサポートします。しかし、アルツハイマー病、特にAPOE ε4アレルを 保有する個人においては、ミクログリアの機能不全が生じ、これが疾患の進行に寄与します。
ApoE4が存在する場合、ミクログリアの機能は以下のように著しく変化します:
βアミロイドの除去機能の障害
- ApoE4はミクログリアがβアミロイドペプチドを効果的に除去する能力を低下させ、プラークの蓄積を引き起こします(Deane, 2008;Najm, 2020)。
- 通常、ミクログリアはP2RY12受容体を発現しており、これはミクログリアをβアミロイド沈着部位へ誘導し、その除去を可能にするために不可欠です。ApoE4保有者では、P2RY12受容体の発現が抑制され、ミクログリアの運動性およびβアミロイド斑を効果的に除去する能力が損なわれます(Sepulveda, 2024)。
炎症促進環境
- βアミロイドの蓄積はミクログリアの活性化を引き起こします。これは細胞残渣の除去を促進し、免疫応答を開始するためのプロセスです。しかし、ApoE4が存在する場合、ミクログリアは慢性的な炎症促進性表現型を獲得し、神経炎症を悪化させます(Rao, 2025)。
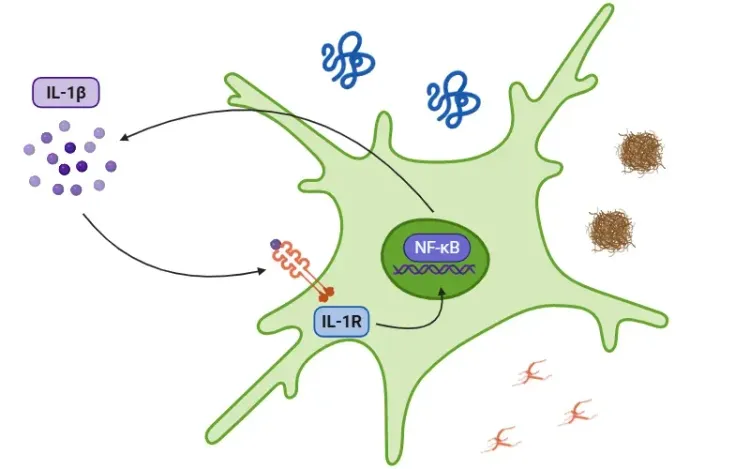
- ApoE4を発現するミクログリアは、TNF-α 、IL-1β、IL-6などの高レベルの炎症促進性サイトカインを放出します(Iannucci, 2021)。これらのサイトカインは脳内の慢性炎症を持続させます。
- ApoE4はまた、疾患関連ミクログリア(DAM)の活性化に関与する受容体であるTREM2の発現を増加させます。DAMの活性化はβアミロイドの除去を目的としていますが、炎症と神経変性をさらに促進します(Iannucci, 2021)。
神経変性疾患における炎症促進性サイトカイン、IL-1βの役割に関する詳細は以下を参照のこと:インターロイキン-1β(IL-1β)と神経変性疾患
βアミロイドとタウ病理
- アポE4は神経毒性を持つβオリゴマーの形成を促進し、アミロイド病理を悪化させます(Hashimoto, 2012)。
- βアミロイドに加え、アポE4はタウの過剰リン酸化も増加させ、アルツハイマー病の特徴である神経原線維変化の形成につながります(Shi, 2017)。
脂質代謝の障害
- ApoE4 は脂質代謝を損ない、ミクログリア細胞内に脂質滴やコレステロールが蓄積する原因となります(Wang, 2022)。
- この脂質蓄積はミクログリアの機能を損ない、Aβやその他の有害タンパク質を除去する能力をさらに低下させます。
- さらに、こうした脂質バランスの乱れは、ミクログリア内の炎症誘発性シグナル伝達を促進し、神経変性をさらに悪化させます。
酸化ストレスの増加
- ApoE4を発現するミクログリアは、活性酸素種(ROS)のレベルを上昇させ、脳内の酸化ストレスを引き起こします(Liu, 2025)。
- ROS は細胞構成要素を損傷し、酸化ストレスはミクログリアの機能をさらに損ない、炎症と神経変性の悪循環を促進します。
参照:ミクログリアおよびアストロサイトにおけるミトコンドリア機能障害
ミクログリアの形態学的変化
- 通常、ミクログリアは、脳内を効率的に監視し、損傷に対応できる、広範で高度に分岐した突起を有しています。
- ApoE4はミクログリアの形態を変化させ、突起を短縮・分枝化させ、脳内の損傷を監視し、βアミロイドやタウを除去する能力を損ないます(Sepulveda, 2024)。
神経変性疾患におけるミクログリアの形態学的変化に関する詳細なレビューについては、以下をご参照ください:ALS、アルツハイマー病、パーキンソン病におけるミクログリアの形態
ApoE4とミクログリアの間のこうした機能不全的な相互作用が相まって、神経炎症、アミロイド斑の蓄積、タウ病理、酸化ストレスという自己増殖的なサイクルを生み出します。これらの病理学的イベントは、神経細胞の損傷を悪化させるだけでなく、ADの進行を加速させ、認知機能の低下と神経変性をもたらします。
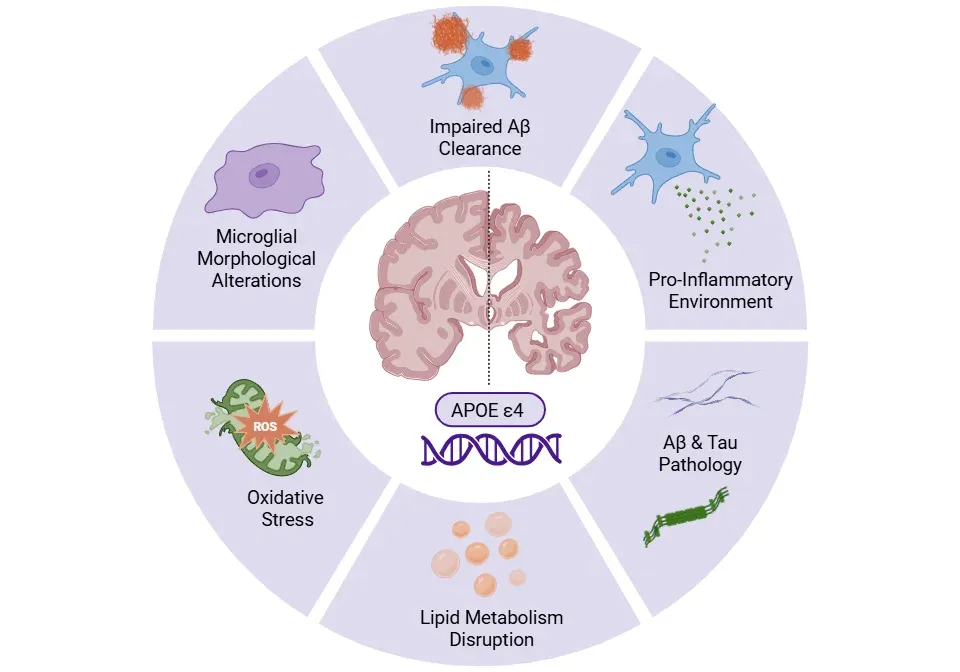
アルツハイマー病におけるApoE4によるミクログリア機能障害。
アポE4はミクログリアの形態と機能を変化させ、βアミロイドの除去を阻害し、脂質代謝を乱します。これによりβアミロイドとタウ病理、炎症促進環境、酸化ストレスが促進され、これらが相まって神経変性を加速させます。
アポE4を標的とするミクログリアに対する治療戦略にはどのようなものがありますか?
アポE4が、特にミクログリア機能や神経炎症への影響を通じて、アルツハイマー病(AD)の進行を促進する上で重要な役割を果たしていることを踏まえ、アポE4を直接標的とする、あるいはその作用を調節するいくつかの治療戦略が開発されております。これらの戦略は、アポE4の構造を修正する、その発現を減少させる、あるいはその下流の病理学的影響を打ち消すことを目的としております。
低分子化合物
- 低分子化合物は、ApoE4の構造と機能を特異的に変化させるよう設計されており、タンパク質構造を安定化させ、病原性の構造変化を防ぐことを目的としています(Dias, 2025)。
- 軽度認知障害(MCI)を有するAPOE ε4ホモ接合体におけるALZ-801(バリルトラミプロサート)の第III相臨床試験では、有望な結果が示されています(NCT04770220、NCT06304883)。
アンチセンスオリゴヌクレオチド(ASO)
- ASO は、メッセンジャー RNA に結合し、特定のタンパク質(この場合は ApoE4)の発現を減少させるよう設計された合成オリゴデオキシヌクレオチド鎖です。
- 前臨床研究では、ApoE4を標的とするASOが、アルツハイマー病マウスモデルにおいてApoE4の発現を効果的に抑制し、βアミロイド病理を減少させることが実証されています。
- 特に、プラーク沈着前に投与した場合、ASOはβアミロイド負荷を低下させることができました。しかし、シード形成期に投与した場合、ASOはより大きなβアミロイドプラークを形成するものの、プラークに関連する神経突起ジストロフィーは減少することが判明し、ASOの効果にはタイミング依存性があることが明らかになりました(Huynh, 2017)。
- ApoE4を標的とするASOは、タウ病変マウスモデルにおいても、タウ病理の軽減、シナプス密度の維持、神経炎症の抑制を示すことが確認されています(Litvinchuk, 2021)。
遺伝子編集
- CRISPR/Cas9などの遺伝子編集技術は、遺伝子のレベルでAPOE ε4アレルを直接改変する可能性を提供します。ε4アレルを ε3または ε2アイソフォームに修正することで、遺伝子編集はアルツハイマー病の根本的な遺伝的リスクを逆転させる可能性があります。
- CRISPR/Cas9を用いたin vitroモデルでは、グリア細胞によるβアミロイドのクリアランスを改善することで、タウリン酸化、細胞毒性、βアミロイド病理の低減に有望な結果が示されています(Raulin, 2022)。
- アデノ随伴ウイルス(AAV)ベクターを用いてAPOE2遺伝子を脳内に導入するLX1001のようなAAVベースの遺伝子治療は、中等度ADおよびMCIにおいて初期段階の臨床試験で成功を示しています。これらの試験の中間データでは、ApoE2の発現増加、タウバイオマーカーの減少、βアミロイド病理の安定化が示されています(NCT03634007、NCT05400330)。
抗炎症薬(NSAIDs)
- 非ステロイド性抗炎症薬(NSAIDs)は、ミクログリア活性化とサイトカイン放出を抑制するために最も広く使用されている薬剤群の一つです。しかしながら、NSAIDsを用いた臨床結果はばらつきがあり、アルツハイマー病において一貫した有効性は示されていません(McGeer, 2007;Imbimbo, 2010)。
免疫療法
- ApoE4またはミクログリア活性化を標的とする免疫療法は、神経炎症を軽減し、ADにおけるApoE4の病理学的影響を緩和するもう一つの戦略です。
- アルツハイマー病モデルを用いた前臨床研究では、ApoEを直接標的化し中和することでその病理学的影響を軽減する抗ApoE抗体が検討されてきました。これらのモデルにおいて、抗ApoE抗体はβアミロイド斑周囲へのミクログリアの動員を促進し、アミロイド負荷を減少させることが示されています(Kim, 2012;Liao, 2018)。
これらの治療戦略は現在も様々な開発段階にありますが、ADにおけるApoE4の有害な影響を軽減する有望なアプローチを示しています。今後の臨床試験は、これらの介入の安全性、有効性、および長期的な影響を判断する上で極めて重要となるでしょう。
当チームは、アルツハイマー病におけるApoE4がミクログリアの活動に及ぼす影響に関するご質問や、治療効果研究に使用するモデルに関する具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
インターロイキン-1ベータ(IL-1β)と神経変性疾患
アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患におけるIL-1βの役割。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。
ミクログリアとアストロサイトのライソゾーム機能不全
ミクログリアとアストロサイトのライソゾーム機能不全の概要と、神経変性疾患におけるその役割。
IL-1βとは何ですか?
IL-1βの概要、全身性疾患および神経疾患におけるその炎症誘発作用、ならびにIL-1β拮抗作用を基盤とした治療戦略について概説します。