Qu'est-ce que le TREM2 ?
Le récepteur déclencheur exprimé sur les cellules myéloïdes 2 (TREM2) est une glycoprotéine transmembranaire de type I qui sert de récepteur immunitaire inné sur les microglies du système nerveux central (SNC) ainsi que sur d'autres cellules myéloïdes (par exemple, les cellules dendritiques et les granulocytes). Cette protéine est codée par le gène TREM2 et appartient à la superfamille TREM, qui comprend également TREM1 (Gratuze, 2018; Li, 2023). TREM2 joue un rôle essentiel dans le maintien de l'homéostasie cérébrale et dans la réponse à diverses conditions pathologiques (Qin, 2021; Li, 2023; Shi, 2025).
Cascade de signalisation :
- TREM2 fonctionne comme un capteur pour une large gamme de ligands, notamment des composants dérivés de bactéries, des phospholipides, des glycolipides, l'APOE, l'APOJ, des oligomères bêta-amyloïdes et la TDP-43, entre autres (Filipello, 2022; Tagliatti, 2024; Shi, 2025).
- TREM2 interagit avec les protéines adaptatrices DAP12 et DAP10, ce qui entraîne une phosphorylation facilitée par le motif d'activation à base de tyrosine des immunorécepteurs (ITAM) (Ulland, 2018; Li, 2023; Shi, 2025).
- Cette interaction déclenche des événements intracellulaires, notamment l'activation de la tyrosine kinase de la rate (SYK) et de diverses voies en aval, telles que PI3K/AKT, mTOR, MAPK et NF-κB (Ulland, 2018; Li, 2023; Shi, 2025).
- Le TREM2 soluble (sTREM2) peut également être dérivé du clivage protéolytique du domaine extracellulaire du TREM2 par les α-sécrétases (ADAM10, ADAM17), qui libèrent le domaine extracellulaire soluble dans l'espace extracellulaire, y compris le liquide céphalo-rachidien (LCR) et le plasma. De plus, le sTREM2 peut être produit directement par épissage alternatif de l'ARNm du TREM2 (Ulland, 2018; Filipello, 2022; Hou, 2022; Tagliatti, 2024). le sTREM2 est considéré comme un biomarqueur de l'activation microgliale et de la neuroinflammation dans le cerveau (Filipello, 2022; Li, 2023).
Grâce à la cascade de signaux, les principales fonctions du TREM2 sont les suivantes :
- Détection des lésions : les ligands TREM2 sont fréquemment associés à des lésions tissulaires, à la mort neuronale, à la démyélinisation et à la présence d'agrégats protéiques pathologiques (Filipello, 2022; Tagliatti, 2024; Shi, 2025).
- Survie et prolifération des microglies : la voie ITAM/Syk active la voie de signalisation PI3K/AKT/mTOR, qui non seulement inhibe les voies apoptotiques, mais stimule également les signaux de croissance cellulaire (Wang, 2015; Ulland, 2018; Qin, 2021; Shi, 2025).
- Phagocytose et élimination des débris : TREM2 intervient dans la mobilisation du calcium, parallèlement à l'activation du diacylglycérol (DAG) et de la protéine kinase C (PKC), ce qui entraîne un réarrangement du cytosquelette, essentiel à la phagocytose. En fin de compte, TREM2 favorise l'engloutissement et l'élimination des débris cellulaires, notamment les neurones apoptotiques, les débris de myéline et les protéines mal repliées, telles que les agrégats bêta-amyloïdes dans la MA et la TDP-43 dans la sclérose latérale amyotrophique (SLA) et la démence frontotemporale (DFT) (Lue, 2015; Gratuze, 2018; Qin, 2021; Li, 2023; Shi, 2025). Veuillez vous référer à notre ressource intitulée «Interactions entre les microglies et les neurones et maladies neurodégénératives » pour plus d'informations sur la phagocytose dans les conditions neurodégénératives.
- Régulation inflammatoire : le TREM2 agit généralement comme un régulateur négatif des réponses pro-inflammatoires dans les microglies par le biais des voies PI3K/AKT/Fox03a et PI3K/AKT/GSK3b, favorisant la sécrétion d'IL-10 et de TGF-β tout en inhibant les cytokines pro-inflammatoires (TNF-α, IL-1β). Cependant, il peut également stimuler la production de cytokines pro-inflammatoires et renforcer la phagocytose via les voies NF-κB et MAPK (Gratuze, 2018; Li, 2023; Shi, 2025).
- Modulation des microglies associées à la maladie (DAM) : TREM2 joue un rôle crucial dans la transition des microglies d'un état homéostatique à un phénotype DAM. On pense que cet état DAM offre des effets protecteurs, atténuant la neurodégénérescence dans des conditions telles que la maladie d'Alzheimer (MA) (Filipello, 2022; Basha, 2023; Li, 2023; Tagliatti, 2024).
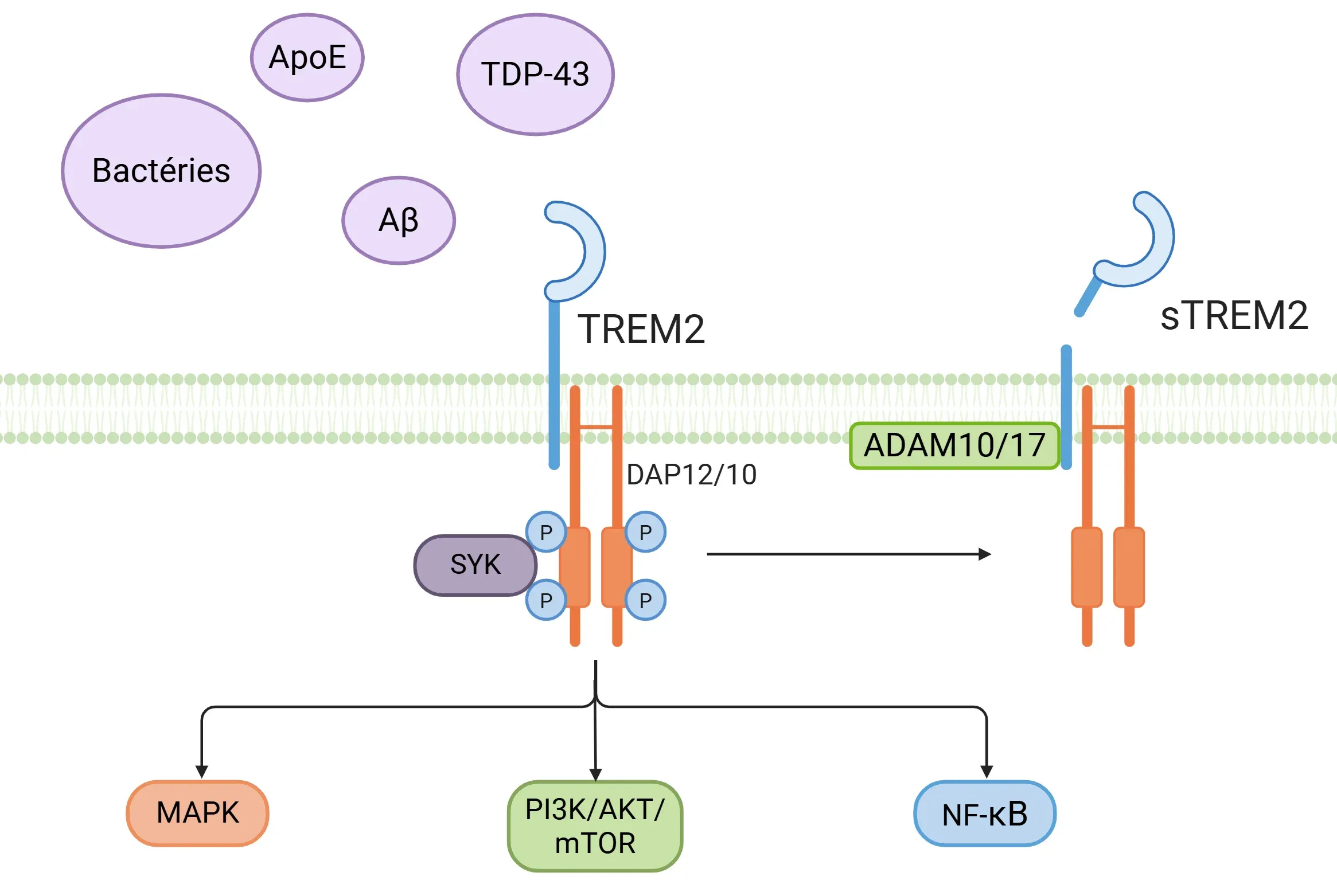
Cascade de signalisation TREM2. L'activation du récepteur TREM2 par divers ligands déclenche différentes voies de signalisation et la libération de TREM2 soluble (sTREM2).
Quel est le rôle de TREM2 dans les maladies neurodégénératives ?
Le TREM2 joue un rôle crucial dans le fonctionnement des microglies, qui sont essentielles au maintien de l'homéostasie cérébrale et ont des implications importantes dans les troubles neurologiques. Alors que le TREM2 favorise généralement les mécanismes de protection, une dérégulation de cette molécule peut entraîner une augmentation de l'inflammation et contribuer à des troubles neurodégénératifs.
Une mutation biallélique du gène TREM2 entraîne une maladie autosomique récessive rare connue sous le nom de maladie de Nasu-Hakola. Cette affection conduit à une ostéodysplasie lipomembraneuse polykystique, accompagnée d'une leucoencéphalopathie sclérosante. En conséquence, les personnes atteintes souffrent souvent de démence précoce (Carmona, 2018; Kiianitsa, 2024).
Les variants hétérozygotes de la mutation du gène TREM2 augmentent le risque de développer une MA tardive en réduisant l'activation des microglies et en dérégulant la réponse inflammatoire. Parmi les maladies neurodégénératives, le rôle du TREM2 dans la MA est le plus étudié. Voici un aperçu de l'implication du TREM2 dans la MA :
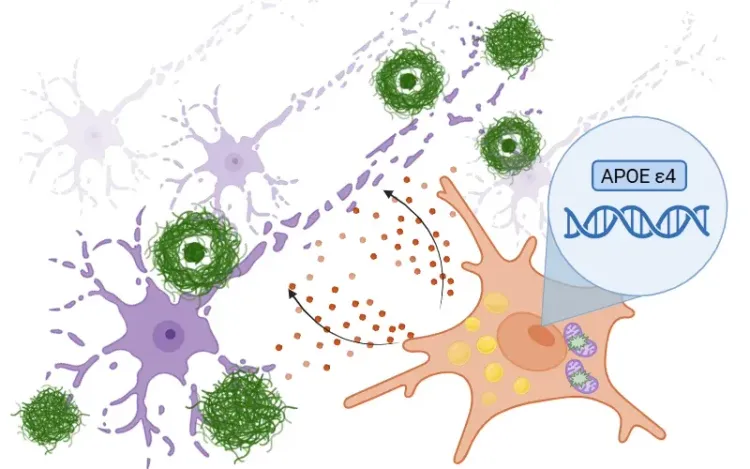
- Le TREM2 interagit avec des ligands tels que les phospholipides, les lipoprotéines contenant de l'ApoE ou les oligomères Aβ, se liant à l'adaptateur DAP12. Cette interaction active des cascades de signalisation en aval qui favorisent la survie, la prolifération et la chimiotaxie des microglies, ainsi que la phagocytose des neurones apoptotiques et des débris (Zhang, 2025).
- La cascade de signalisation TREM2 facilite également la transition des microglies homéostatiques en DAM qui se regroupent autour des plaques amyloïdes. Ces DAM compactent les plaques et forment une barrière protectrice qui limite la dystrophie neuritique, en particulier aux stades précoces de la MA (Zhang, 2025).
- Dans les modèles murins, une déficience en TREM2 entraîne une diminution du regroupement des DAM autour des plaques amyloïdes bêta, ce qui conduit à des plaques plus diffuses, à un rapport Aβ42/Aβ40 élevé et à une augmentation des lésions axonales. À l'inverse, la surexpression de TREM2 ou le traitement par des anticorps agonistes peut restaurer les réponses microgliales, améliorer l'élimination des plaques et améliorer le métabolisme du glucose (Ulland, 2018; Zhang, 2025).
- Le rôle de TREM2 dans la pathologie tau est complexe et donne des résultats mitigés. Son effet sur la limitation de l'accumulation et de la propagation de la protéine tau se limite à la présence de plaques amyloïdes bêta (Zhang, 2025).
- Les variants de perte de fonction (tels que R47H, R62H et H157Y) réduisent l'affinité des ligands ou augmentent la libération de l'ectodomaine, ce qui altère l'activation microgliale et le métabolisme cellulaire. Cela exacerbe à la fois la pathologie amyloïde et la pathologie tau et augmente le risque de MA (Guerreiro, 2013; Gratuze, 2018; Zhang, 2025).
- le sTREM2 généré par la libération médiée par l'ADAM apparaît dans le LCR à un stade précoce de la MA. Le sTREM2 est corrélé à l'activation microgliale et à un ralentissement du déclin cognitif, et il peut se lier aux oligomères AB pour inhiber l'agrégation, ce qui en fait un biomarqueur diagnostique et une cible thérapeutique prometteurs (Zhang, 2025).
Le TREM2 semble être impliqué dans des maladies neurodégénératives autres que la MA, bien que son rôle exact reste moins bien défini (Carmona, 2018; Kiianitsa, 2024; Awuah, 2025) :
- De rares variations hétérozygotes du gène TREM2 ont été associées à un risque accru de DFT, tandis que la variante p.Arg47His a été observée dans des cohortes de patients atteints de la maladie de Parkinson (MP). Cependant, les associations dans ces conditions restent incohérentes et varient selon les populations (Carmona, 2018; Huang, 2023).
- Certaines études examinent la relation entre les variations du gène TREM2 et le risque de développer des maladies telles que la SLA, la démence à corps de Lewy, la maladie de Creutzfeldt-Jakob et l'accident vasculaire cérébral ischémique, entre autres. Néanmoins, ces études d'association ont donné des résultats mitigés, et les mécanismes par lesquels le gène TREM2 influence ces maladies restent à élucider (Carmona, 2018; Awuah, 2025).
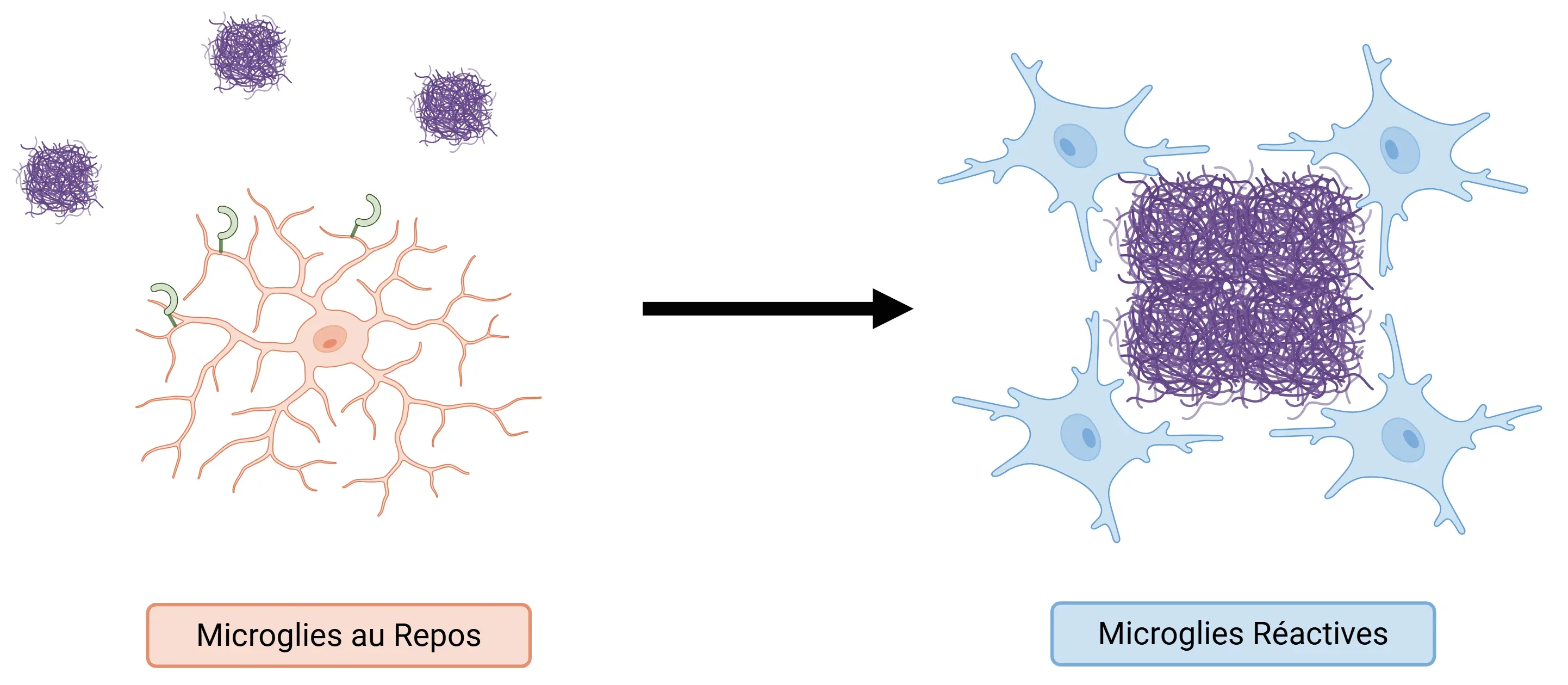
Rôle de TREM2 dans la maladie d'Alzheimer.
En se liant à la bêta-amyloïde, TREM2 active la microglie et la transforme en DAM. Ces cellules se regroupent autour des plaques amyloïdes pour atténuer les dommages causés par ces plaques aux premiers stades de la maladie.
Le TREM2 constitue-t-il une cible thérapeutique potentielle ?
TREM2 est une cible thérapeutique prometteuse pour la MA et éventuellement pour d'autres troubles neurodégénératifs. Sur le plan mécanique, la signalisation TREM2 favorise la survie, la prolifération, le métabolisme lipidique et la phagocytose des débris amyloïdes et bêta, limitant ainsi la formation de plaques et la dystrophie neuritique.
La recherche préclinique confirme le potentiel thérapeutique de TREM2 :
- Il a été démontré que les anticorps agonistes TREM2, notamment 4D9 et AL002, augmentent la prolifération microgliale, améliorent la compaction des plaques et renforcent le métabolisme cérébral du glucose dans des modèles murins transgéniques de la MA (van Lengerich, 2023; Awuah, 2025).
- L'anticorps ATV:TREM2, qui traverse la barrière hémato-encéphalique (BHE) en utilisant un site de liaison au récepteur de la transferrine, améliore l'activité microgliale et le métabolisme du glucose dans les modèles murins de MA (van Lengerich, 2023).
- les modèles murins 5xFAD qui surexpriment le gène TREM2 ont montré une amélioration de la phagocytose de la bêta-amyloïde et une amélioration des fonctions cognitives (Li, 2023).
- Bien que le rôle spécifique du TREM2 soluble (sTREM2) reste incertain, l'administration de sTREM2 s'est avérée réduire la dystrophie neuritique chez les souris amyloïdogènes. Cependant, des altérations de la libération de TREM2 chez les souris transgéniques peuvent entraîner une augmentation des dépôts amyloïdes (Zhang, 2025).
La transposition clinique de ces résultats est déjà en cours :
- L'anticorps humanisé AL002 a terminé les essais de sécurité de phase 1, démontrant une tolérance favorable sans effets indésirables graves (Wang, 2015; Long, 2024). Cependant, les résultats des essais de phase 2 n'ont pas donné de résultats positifs.
- Le VHB937 est un anticorps monoclonal agoniste du TREM2 qui s'est avéré améliorer la phagocytose et la chimiotaxie microgliales. Cet agent thérapeutique fait actuellement l'objet d'une évaluation dans le cadre d'essais cliniques de phase 2 pour le traitement de la SLA (Noh, 2025).
- Le TREM2 joue un rôle complexe ; son activation semble particulièrement bénéfique au cours des premiers stades de la formation des dépôts amyloïdes. À des stades plus avancés de la maladie, différentes stratégies peuvent être nécessaires, et les effets hors cible sur les cellules myéloïdes périphériques doivent également être pris en compte (Zhang, 2025).
En résumé, le TREM2 semble très prometteur en tant que cible thérapeutique pour la MA et éventuellement d'autres troubles neurodégénératifs. Les études précliniques soulignent son rôle dans l'amélioration de la fonction microgliale et des résultats cognitifs. Cependant, en raison du rôle complexe du TREM2 dans la progression de la maladie, une réflexion approfondie est nécessaire. Les recherches en cours sont essentielles pour optimiser les thérapies ciblant le TREM2 afin d'intervenir efficacement dans la neurodégénérescence.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant le TREM2 et les microglies ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour nos études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées et meilleures pratiques relatives à l'évaluation des agents thérapeutiques dans des modèles animaux de maladies neurodégénératives.
APOE4, microglies et maladie d'Alzheimer
Présentation générale de l'influence de l'ApoE4 sur l'activité microgliale dans la maladie d'Alzheimer et le développement de traitements ciblés.
Interactions entre les microglies et les neurones et maladies neurodégénératives
Une revue concise des interactions directes entre les microglies et les neurones, et de la manière dont ces interactions intercellulaires peuvent être affectées dans les maladies neurodégénératives.
TNF-α et microglie dans les maladies neurodégénératives
Un aperçu de la fonction du facteur de nécrose tumorale alpha (TNF-α) dans la microglie et de sa contribution à la progression de la neurodégénérescence.
Qu'est-ce que l'IL-1β?
Présentation générale de l'IL-1β, de son rôle pro-inflammatoire dans les maladies systémiques et neurologiques, et des stratégies thérapeutiques impliquant l'antagonisme de l'IL-1β.
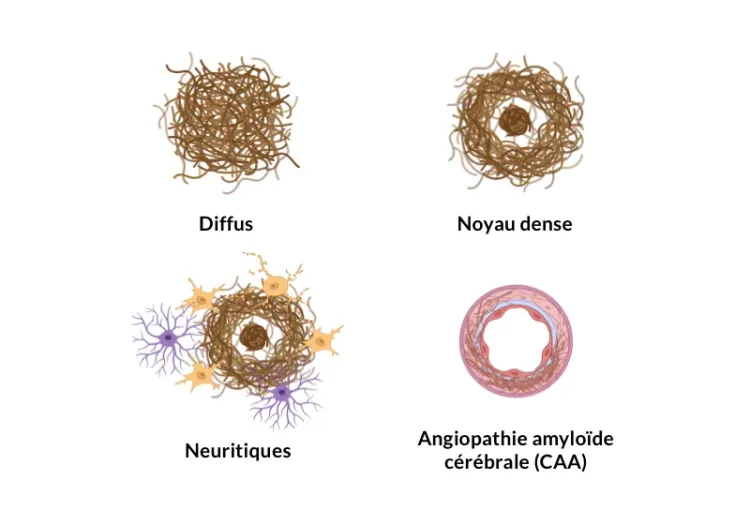
Analyse des plaques amyloïdes-β dans la maladie d'Alzheimer
Aperçu des méthodes de classification et de quantification des plaques Aβ dans les coupes de tissus cérébraux provenant d'humains et de modèles animaux de la maladie d'Alzheimer (souris et rats transgéniques).
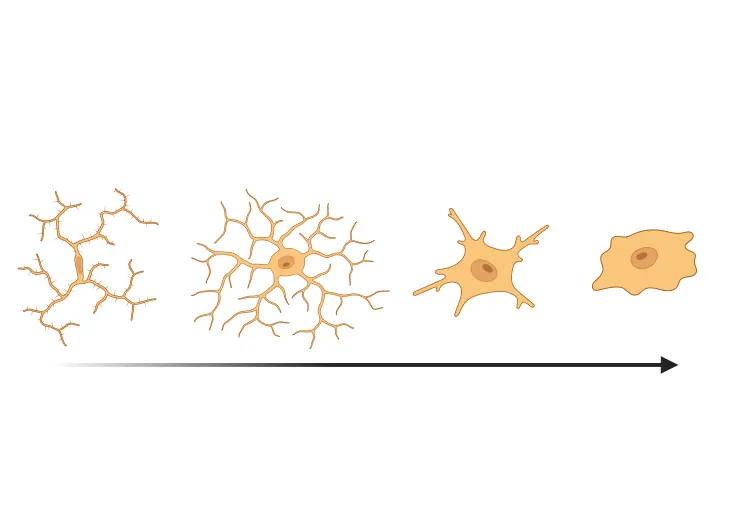
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.