この資料では以下の内容について説明しております:
ミクログリアにおけるTMEM119の意義とは何でしょうか?
膜貫通タンパク質119(TMEM119)は、中枢神経系(CNS)における安静時恒常性ミクログリアのマーカーとして認識されているI型膜貫通タンパク質です。ミクログリアは中枢神経系の主要な免疫細胞として機能し、神経細胞の健康と恒常性の維持に重要な役割を果たしています。脳内での役割に加え、TMEM119は骨芽細胞の分化・増殖や骨の石灰化にも関与しています。
2016年、二つの研究グループが独立してTMEM119をミクログリアの主要マーカーとして同定しました:
- ベネットらのグループは、原位ハイブリダイゼーション法により、機能不明のミクログリア特異的細胞表面タンパク質としてTMEM119を同定しました(Bennett, 2016)。
- また、TMEM119はマウスおよびヒト中枢神経系(CNS)においてミクログリアの特異的かつ信頼性の高いマーカーとして機能し、マクロファージ、その他の免疫細胞、神経細胞では発現していないことも明らかにしました。
- 細胞外ドメイン抗体を用いた手法により、マウス脳から高純度の非活性化ミクログリア細胞を分離する方法を確立しました。
- 佐藤ら(Satoh et al.)の研究グループは、マウスミクログリア転写体プロファイルの5つのデータセットを比較解析し、TMEM119とIba1の両方がほぼ全てのミクログリアで発現していることを明らかにしました(Satoh, 2016)。その知見は以下の通りです:
- TMEM119は、アルツハイマー病(AD)の有無にかかわらず、死後ヒト脳内のIba1+/CD68+ミクログリアに存在しましたが、反応性ミクログリアでは結果が異なりました。
- TMEM119は、多発性硬化症(MS)の活動性脱髄病変や脳梗塞の壊死病変に認められる浸潤性Iba1+/CD68+マクロファージでは検出されませんでした。
- 研究者らは、TMEM119がヒト脳において常在性ミクログリアと浸潤性血液由来マクロファージを区別する信頼性の高いマーカーであると結論づけました。
これらの論文発表以前、ヒト脳内で常在性ミクログリアと循環マクロファージを区別することは困難でした。ベネットら および佐藤らの研究により、神経変性疾患および神経炎症性疾患の進行におけるミクログリアの役割を評価することが可能となりました(Bennett, 2016;Satoh, 2016)。
ミクログリアの研究には、その他の補完的なマーカーも重要です:
- P2RY12(P2Yプリン受容体12)は、ヒトの恒常性ミクログリアに対する別の特異的マーカーとして機能します(Bottcher, 2019;Lier, 2021;Hashioka, 2022):
- その機能には、走化性の媒介や損傷部位へのミクログリア突起の伸長が含まれます。
- P2RY12はオリゴデンドロサイトにも発現しています。
- TMEM119陽性細胞はP2RY12も発現し、その逆も同様です。
- 両マーカーは、反応性ミクログリアにおいて顕著なダウンレギュレーションを示すか、消失します。
- Iba1、CD11b、CX3CR1、およびF4/80は、ミクログリアとマクロファージの両方で発現するマーカーです:
- 神経炎症時には、ミクログリアが活性化されるにつれて、Iba1 および CD11b の発現は通常安定しているか、あるいは上調節されます(Bottcher, 2019;Bohnert, 2020;Lier, 2021;Ruan, 2022)。
- F4/80はマウスのミクログリアには存在しますが、ヒトでは見られません。その発現パターンは反応性ミクログリアにおいて異なる場合があります(Bottcher, 2019;Boche, 2022)。
- CX3CR1は神経細胞とミクログリアのコミュニケーションに不可欠であり、疾患関連ミクログリア(DAM)において安定的に発現しています(Bennett, 2016;Boche, 2022)。
- CX3CR1に関する詳細情報は、弊社のリソース「ミクログリア-ニューロン相互作用と神経変性疾患」をご参照ください。
その後の研究では特異性が調査され、ミクログリアにおけるTMEM119の理解に貢献しています(Gonzalez Ibanez, 2019;Lier, 2021;Ruan, 2022;Vankriekelsvenne, 2022):
- 正常な生理的条件下では、TMEM119は恒常性ミクログリアにのみ発現します。しかし、様々な病態においてDAM(炎症性ミクログリア)ではその発現が減少します。
- TMEM119は、ニューロンやアストロサイトなどの他の脳常在細胞、および中枢神経系(CNS)に浸潤する可能性のある末梢由来マクロファージには存在しません。しかしながら、リンパ器官や褐色脂肪組織における濾胞樹状細胞などの他の細胞タイプは標識可能です。
- P2RY12と併せて、TMEM119は血液や脳脊髄液(CSF)中に存在する循環性骨髄系細胞からヒトミクログリアを効果的に区別します(Bottcher, 2019)。
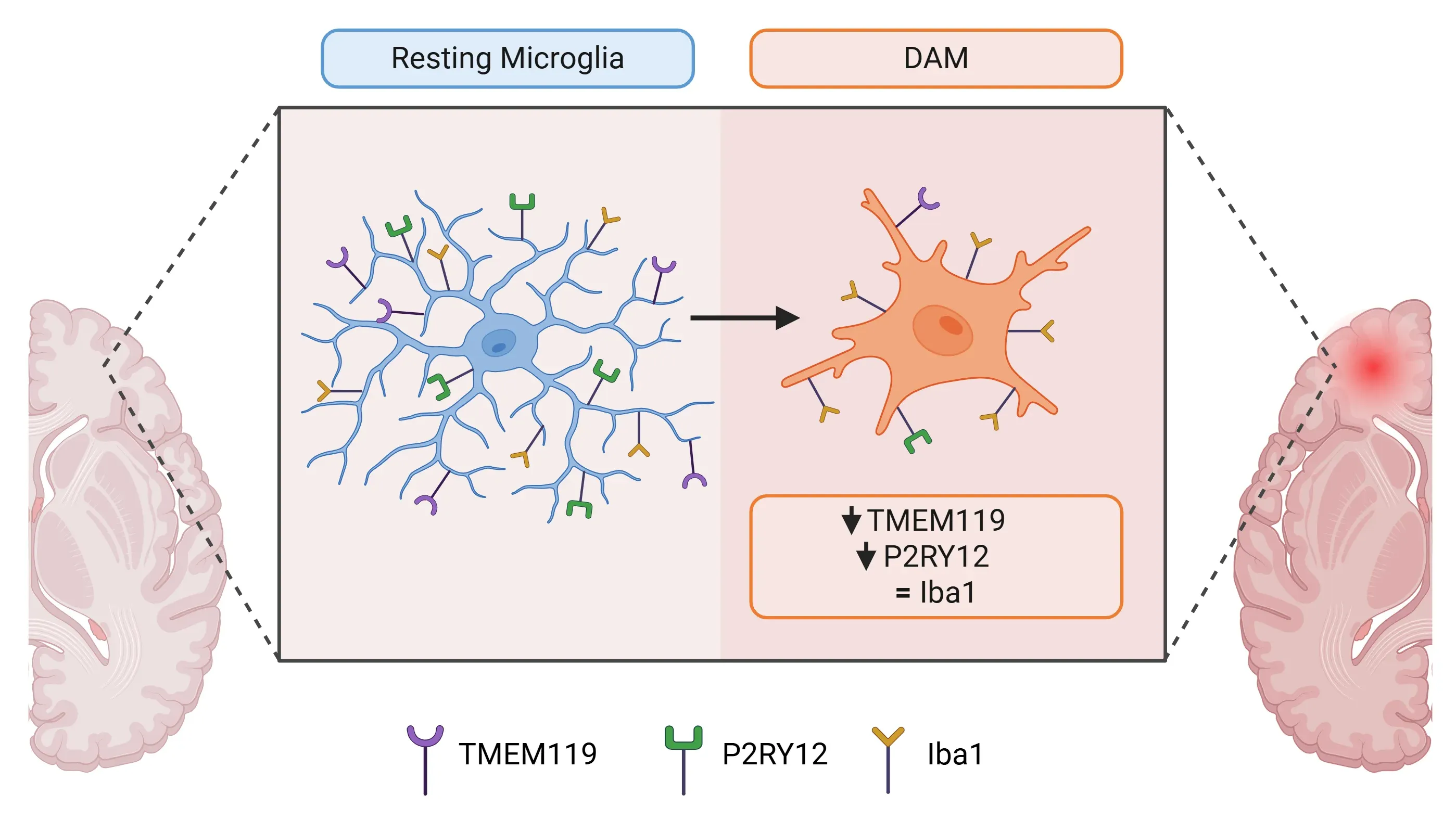
安静状態のミクログリアと疾患関連ミクログリア(DAM)におけるマーカー発現の違い。
TMEM119はアルツハイマー病においてどのような役割を果たしているのでしょうか?
恒常性ミクログリアのバイオマーカーとしての役割に加え、TMEM119は現在、マウスモデルを用いたアルツハイマー病における機能的意義について研究が進められております。その意義に関する知見の一部を以下にご紹介します:
- βアミロイド結合と除去(Liu, 2025):
- TMEM119はAβオリゴマーに直接結合します。
- ミクログリアにおけるTMEM119の過剰発現は、その貪食能を増強し、in vitroおよびin vivoの両方でβアミロイドの取り込みと分解を促進します。
- TMEM119は低密度リポタンパク質受容体1(LRP1)を動員し、これがAβの貪食およびその後のリソソーム分解を促進します。
- ミクログリアの恒常性維持(Liu, 2025):
- TMEM119の欠損は、恒常性ミクログリアからDAM(病態関連ミクログリア)への移行を加速させます。
- βアミロイド負荷の増加は、ミクログリアにおけるTMEM119の発現を減少させ、マウスの疾患進行と相関します。
- 治療の可能性(Liu, 2025):
- カルトゲニンおよびSRI-011381を用いたTMEM119発現の増強は、アルツハイマー病マウスモデルにおいてβアミロイドの除去を促進し、認知機能を改善することが示されています。
ミクログリアのアルツハイマー病における役割に関する詳細情報は、リソース「APOE4、ミクログリア、およびアルツハイマー病」ならびに「神経変性疾患におけるミクログリア、アストロサイト、およびタウ」をご参照ください。
アルツハイマー病におけるTMEM119の発現パターン
アルツハイマー病におけるTMEM119の発現研究は複雑です。様々な神経疾患において、TMEM119の発現は低下することが多く報告されています(Masuda, 2019;Kenkhuis, 2022;Mercurio, 2022;Liu, 2025)。アルツハイマー病においては、アミロイドβ(Aβ)斑に関連するミクログリアは、恒常性状態からDAM(病態ミクログリア)または神経変性ミクログリア表現型へと移行します。この反応性状態において、TMEM119やP2RY12などの恒常性マーカーの発現は著しく低下しており、TMEM119のADにおける役割の解明を困難にしております(Hashioka, 2022)。具体的には、以下の観察結果が得られております:
- Aβプラークから25μm以内のミクログリアではTMEM119発現が著しく減少する一方、より遠隔(≥50μm)のミクログリアでは発現低下が稀であることが確認されています(Liu, 2025)。微小環境解析の詳細については、リソース「アルツハイマー病マウスにおけるβアミロイドと炎症性微小環境」をご参照ください。
- ヒトのアルツハイマー病患者においては、βアミロイド斑への近接度に関わらず、TMEM119陽性ミクログリアの表現型が全体的に有意に減少しています(Kenkhuis, 2022)。
- ヒトAD脳における組織分析と細胞分析では相反する結果が報告されています(Satoh, 2016;Kenkhuis, 2022):
- 組織解析ではTMEM119 mRNA発現の増加が示されています。
- 一方、単離した反応性ミクログリアでは、TMEM119の発現が減少していることが示されています。
- TMEM119発現の喪失とTREM2の増加は、βアミロイド斑に対するミクログリア応答の特徴的な特徴です。
- 詳細については、リソース「TREM2、ミクログリア、神経炎症」をご参照ください。
アルツハイマー病(AD)におけるミクログリアのTMEM119の役割は現在研究中です。ADの発症機序の理解を深め、標的治療法を開発するためには、ミクログリアをDAM(疾患関連ミクログリア)やその他の骨髄系細胞と区別することが依然として重要です(Hashioka, 2022)。
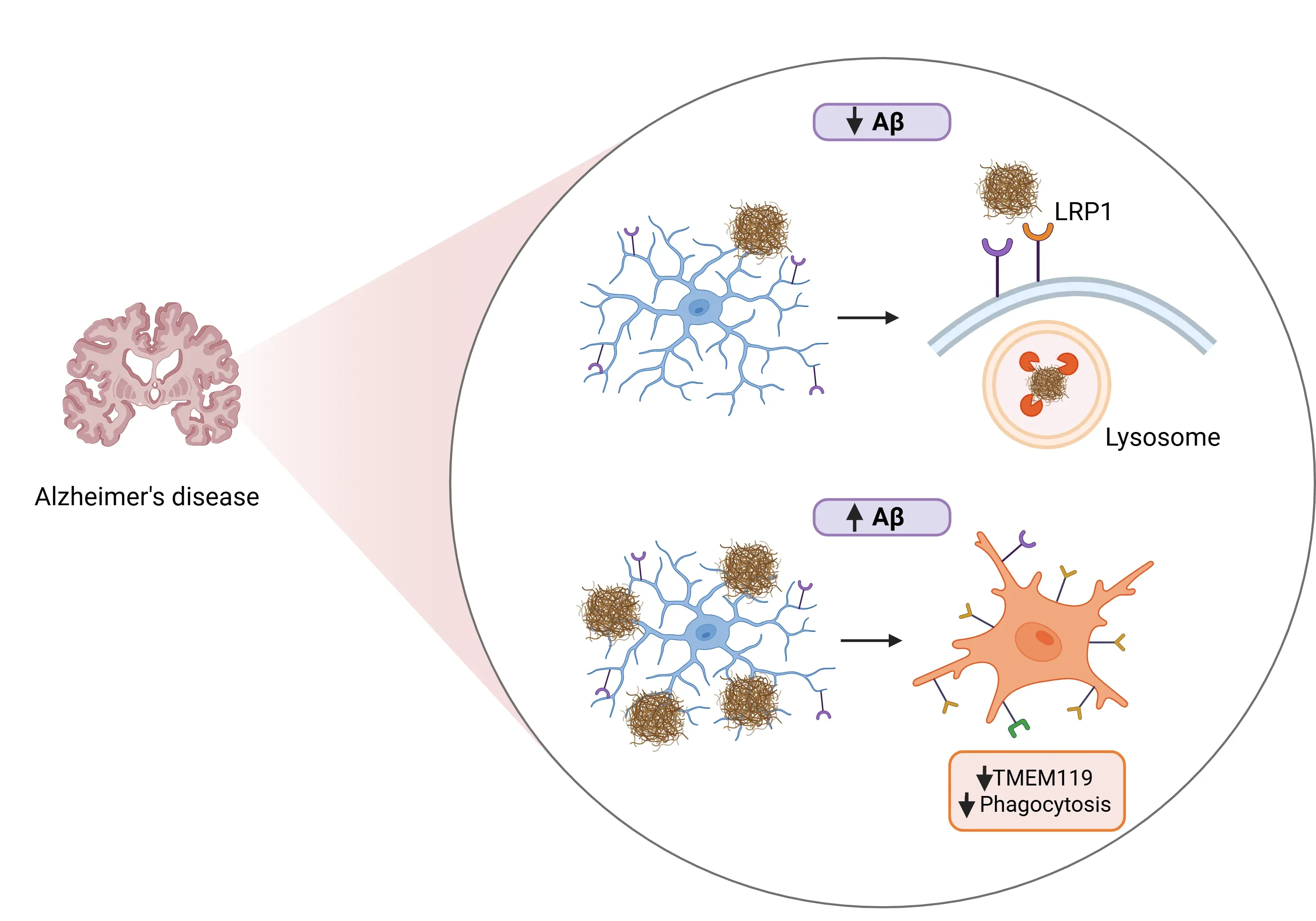
TMEM119がアルツハイマー病(AD)において、アミロイドβ(Aβ)レベルが低い状態と高い状態のそれぞれで果たす役割について
ミクログリアのTMEM119は、アルツハイマー病以外の病態においてどのような役割を果たしているのでしょうか?
アルツハイマー病以外の病態におけるミクログリアのTMEM119の役割は、主にミクログリアの特異的マーカーとしての機能です。血液脳関門(BBB)が損なわれる状態では、TMEM119はミクログリアによって確実に発現されますが、血液由来の浸潤マクロファージには存在しません(Kempuraj, 2024)。その具体的な機能は依然として不明ですが、TMEM119の発現は様々な病態下で亢進または減退することがあります:
- 神経変性疾患
- 多発性硬化症(MS):
- TMEM119の免疫反応性は、活動性白質病変(WML)の中心部では著しく低下または消失しますが、灰白質病変では変化しません。WMLにおける発現低下は、リンパ球やIFNγ、IL-4などの炎症性サイトカインの存在と相関しています(van Wageningen, 2019)。
- 活動性脱髄病変では、浸潤マクロファージはIba1を発現しますが、TMEM119は陰性です(Satoh, 2016)。
- 実験的自己免疫性脳脊髄炎(EAE)モデル:
- TMEM119の発現は、ミクログリアの活性化増加と並行して有意に減少します(Vankriekelsvenne, 2022)。
- 多発性硬化症(MS):
- 外傷性脳損傷(TBI)
- TMEM119陽性細胞数は急性期TBI症例で最も高く、遅発性症例では対照レベルに戻ります(Bohnert, 2020)。
- 相反する知見も報告されています(Mercurio, 2022):
- 損傷後の脳組織におけるTMEM119遺伝子の発現亢進。
- 分離した反応性ミクログリア細胞では、mRNAおよびタンパク質レベルが低下している。
- 脳卒中
- 虚血性中枢および半影を含む梗塞近傍の脳領域において、ミクログリアのTMEM119 免疫蛍光および免疫反応性が著しく低下しています(Young, 2021)。
- 著者らは、分枝型ミクログリアにおけるこの発現低下の結果、TMEM119は前臨床脳卒中モデルにおいて安定したマーカーとはならず、この状況下でミクログリアと浸潤マクロファージを区別する用途を制限すると報告しています(Young, 2021)。
- 脳転移
- 癌
- TMEM119は腫瘍形成促進機能を示す可能性があり、骨肉腫(Jiang, 2017)、卵巣癌(Sun, 2021)、乳癌(Yang, 2021)など、様々な癌においてその発現が増加しています。
- その発現亢進は、腫瘍の進行、転移、および患者の予後不良と一貫して関連しています。
結論として、TMEM119はミクログリアのマーカーとして使用可能ですが、考慮すべき重大な制限があります。第一に、全てのミクログリアがTMEM119によって標識されるわけではありません(例:DAM)。これは様々な神経疾患におけるミクログリアの研究を制限します。さらに、TMEM119はミクログリアのみを標識するものではありません。例えば、リンパ器官や褐色脂肪組織における濾胞樹状細胞も標識します。このような複雑性を考慮すると、健康時および疾患時におけるミクログリアの多様な表現型をより正確に特徴づけるためには、Iba1やP2RY12などの他のマーカーと組み合わせてTMEM119を使用することが有益です。
当チームは、治療効果研究に使用する神経変性疾患モデルに関するご質問や具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
TREM2とミクログリア
TREM2の概要、ミクログリアにおけるその役割、神経変性疾患との関連性、および潜在的な治療への示唆について。
APOE4、ミクログリア、およびアルツハイマー病
アポE4がアルツハイマー病におけるミクログリアの活動に及ぼす影響と、標的治療法の開発に関する概説。
神経変性疾患におけるミクログリア、アストロサイト、およびタウ
グリア細胞による神経炎症が、アルツハイマー病およびその他のタウオパチーにおいて、タウタンパク質の凝集、伝播、および神経細胞の喪失を促進するメカニズム。
パーキンソン病におけるミクログリア、アストロサイト、およびα-シヌクレイン
α-シヌクレインがパーキンソン病およびその他のシヌクレイン病においてミクログリアおよびアストロサイトに及ぼす影響。
ALS, アルツハイマー病, パーキンソン病におけるミクログリアの形態
ミクログリアの形態解析の概要と, 神経変性疾患の研究および創薬・薬剤開発への応用。
ミクログリアとニューロンの相互作用と神経変性疾患
ミクログリアとニューロンの直接的な相互作用、およびこれらの細胞間相互作用が神経変性疾患においてどのように影響を受けるかについて簡潔にレビューします。
神経変性疾患におけるミクログリアオートファジーの障害
ミクログリアのオートファジーの障害が神経変性疾患の進行にどのように関与しているか。
ミクログリアの老化と神経変性疾患
本リソースでは、アルツハイマー病(AD)やパーキンソン病(PD)などの神経変性疾患におけるミクログリアの老化とその役割について概説します。