α-シヌクレイン、ミクログリア、およびアストロサイトは、パーキンソン病の発症にどのように関与していますか?
パーキンソン病(PD)の臨床的および病理学的特徴
パーキンソン病(PD)は、最も一般的な運動障害を伴う神経変性疾患であり、全体として2番目に多い神経変性疾患で、65歳以上の個人の2~3%に影響を及ぼしています(Poewe, 2017)。世界的な平均寿命の延長に伴い、PDの負担は大幅に増加すると予想されています。
この疾患は、異常なα-シヌクレインの蓄積を特徴とする多様な疾患群であるα-シヌクレイン病(またはシヌクレイン病)に分類されます。α-シヌクレインは、N末端、非アミロイドβ成分(NAC)ドメイン、およびC末端の3つのドメインから構成されています。正常な状態では、α-シヌクレインは小胞輸送と神経伝達物質の放出に関与しており、特にSNARE複合体の組み立てに重要な役割を果たしています(Calabresi, 2023)。しかし、その合成やクリアランスが障害を受けると、α-シヌクレインは異常な構造をとり、オリゴマーやフィブリルに凝集します。これらの凝集したα-シヌクレインは、脳領域全体に典型的なパターンで伝播し(Braak, 2003)、レビー小体(LB)とレビー神経突起(LN)を形成します。興味深いことに、レビー病理の存在と分布は臨床的重症度と必ずしも相関しないため、α-シヌクレインの凝集はより広範な病理過程の一要素である可能性が示唆されています。α-シヌクレインの凝集の引き金となる要因は不明ですが、神経炎症、ミトコンドリア機能障害、酸化ストレスなどが関与していると考えられています(Borsche, 2021;Chen, 2023)。
PDは運動症状と非運動症状の両方を呈します。運動症状の代表的な特徴である徐動、安静時振戦、および固縮は、主に黒質緻密部(SNc)におけるドーパミン神経細胞の進行性喪失に起因すると考えられています。非運動症状には、抑うつ、認知機能障害、睡眠障害、および消化器機能障害が含まれます。PDの早期診断は、運動症状が通常、ドーパミン神経細胞の著しい喪失後に現れるため困難であり、さらに、多系統萎縮症(MSA)や進行性核上性麻痺(PSP)など他の疾患との臨床的特徴の重なりにより診断が複雑化します。これらの診断上の課題は、疾患の検出と治療の層別化を改善するため、検証された早期段階のバイオマーカーの必要性を強調しています。
PDにおける神経変性の根本的なメカニズムは依然として十分に理解されていませんが、遺伝的、環境的、加齢関連要因など、多様な要因が疾患の病因と関連していることが示されています。さらに、先天性免疫応答と適応免疫応答の調節異常がPDの病因に重要な役割を果たす可能性があり、そのため、PD治療における炎症経路の標的化が注目されています(Li, 2021;Chen, 2023)。
PDにおける神経炎症の役割
神経炎症は、PDの病因における主要な要因としてますます認識されています。中枢神経系(CNS)内の免疫応答の慢性的な活性化、特にミクログリアやアストロサイトなどのグリア細胞の関与は、疾患の進行に中心的な役割を果たしています。アストロサイトとミクログリアの主要な機能の一つは免疫応答ですが、これらは血液脳関門(BBB)機能、CNSの恒常性維持、貪食作用、シナプス機能、イオンバランス、代謝支援にも寄与しています。環境刺激(毒素、感染、損傷など)に対して、グリア細胞は反応性で炎症促進型の表現型を採用し、インターロイキン-1β(IL-1β)や腫瘍壊死因子アルファ(TNF-α)などの炎症促進性サイトカインを放出します。
グリア細胞による炎症の主要な仲介物質は、Nod様受容体タンパク質3(NLRP3)炎症小体です。これは、α-シヌクレインのような異常な折り畳みや凝集したタンパク質の蓄積を含む細胞ストレスシグナルに応答する多タンパク質複合体です。NLRP3炎症小体活性化後、IL-1βやインターロイキン-18(IL-18)などの炎症誘発性サイトカインの放出を促進し、神経炎症と神経細胞損傷を悪化させます。
PD患者のSNにおける神経炎症とミクログリア反応の早期関与を示す証拠は、治療介入の窓を示唆しています(Gerhard, 2006;Edison, 2013)。PDにおけるミクログリアの反応性は、神経炎症と貪食に関与するミクログリアに発現する受容体であるトリガー受容体発現マイエロイド細胞2(TREM2)の減少と関連しています(Huang, 2021)。研究では、TREM2のレベルを増加させると、オートファジーが促進され、ドーパミン神経細胞の死が減少するとともに、PDマウスモデルにおける運動機能が改善されることが示されています(Huang, 2021)。さらに、TREM2の欠損はNLRP3炎症小体(NLRP3 inflammasome)の活性化を引き起こし、その活性化はPD脳のSNcで検出されています(Gordon, 2018;Huang, 2024)。PDマウスモデルにおいて、NLRP3の阻害はドーパミン神経細胞の喪失を減少させ、プロ炎症性サイトカインの分泌を抑制し、運動機能を改善し、オートファジーの促進によりα-シヌクレイン病理を防止します(Gordon, 2018;Lee, 2019;Ou, 2021)。
TREM2がミクログリア機能に果たす役割に関する詳細なレビューについては、以下を参照のこと:TREM2とミクログリア
凝集したα-シヌクレインは、この炎症カスケードの中心的な役割を果たしています(Wang, 2016)。α-シヌクレインは、トール様受容体(TLR)を介してミクログニアを活性化し、特にTLR2とTLR4を介してNF-κBの活性化とIL-1βやTNF-αなどの炎症性サイトカインの転写を誘導します(Karpenko, 2018;Feng, 2019)。NF-κBはまた、ミクログリアにおけるNLRP3炎症小体(NLRP3 inflammasome)の発現を調節し、さらにサイトカインの放出を引き起こします(Wang, 2024)。これらのサイトカインは、神経細胞を直接損傷するだけでなく、アストロサイト(星状細胞)を反応性状態に誘導し、炎症促進状態を採用させます。さらに、α-シヌクレインはミトコンドリア成分と相互作用し、ミトコンドリアの機能、動態、および生物生成を障害し、反応性酸素種(ROS)を誘導し、細胞死に寄与します(Grünewald, 2019;Jeon, 2020)。このフィードフォワードループは、PDにおける神経炎症を強化し、SNcにおけるドーパミン神経細胞の進行性喪失に寄与します(Calabresi, 2023)。
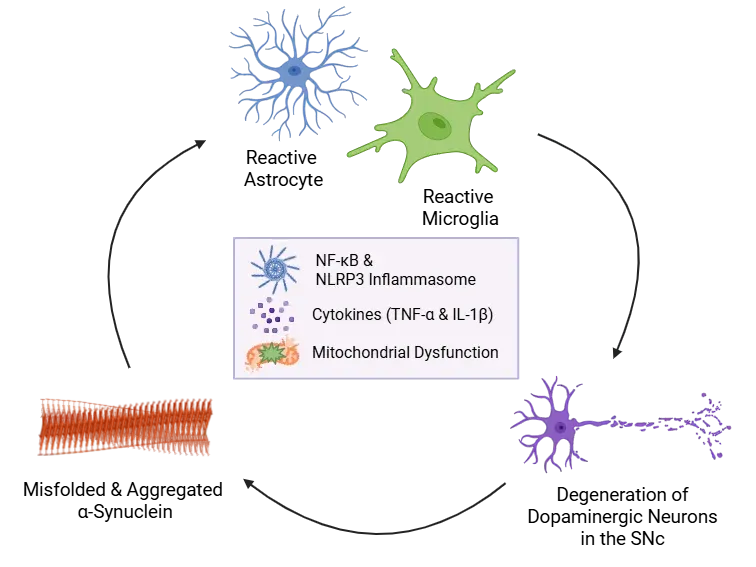
異常折り畳みと凝集したα-シヌクレインはアストロサイトとミクログリアを活性化し、NF-κB依存性炎症性サイトカイン(例:IL-1βおよびTNF-α)の転写を誘導し、ミクログリアにおけるNLRP3炎症小体(inflammasome)の活性化を促進します。その後の炎症小体活性化は、さらにサイトカインの放出を引き起こします。これらのストレス因子は、α-シヌクレインの凝集、ミトコンドリア機能障害、および神経細胞損傷を促進し、SNcにおける慢性神経炎症とドーパミン神経変性の自己増幅サイクルを継続させます。
先天性免疫系に加え、適応免疫応答もパーキンソン病(PD)に関与していることが示唆されています。PD患者の黒質(SN)において細胞傷害性T細胞が観察されており、末梢免疫細胞の中枢神経系(CNS)への浸潤が示唆されています。患者サンプルと動物モデルにおいて、影響を受けた脳領域でCD4+およびCD8+ T細胞が検出されています(Brochard, 2009)。興味深いことに、NLRP3の阻害はSNcへのCD4+およびCD8+ T細胞の浸潤を減少させ、NLRP3炎症小体(NLRP3 inflammasome)が適応性炎症における役割を支持しています(Grotemeyer, 2023)。特に、マウスモデルにおけるCD4+ T細胞の除去はドーパミン神経細胞の死を減少させ、適応免疫がPDの病原性における役割をさらに支持しています(Brochard, 2009)。
研究はまた、腸脳軸が神経炎症の調節に潜在的な役割を果たす可能性を強調しています(Houser, 2017)。腸内微生物叢の構成変化と腸管透過性の変化は、腸から循環する炎症性仲介物質を介して炎症を促進する可能性があります。これらの発見は、中枢神経系(CNS)外で発生する全身性炎症がPDの発症または進行に役割を果たす可能性を示唆し、PD病理の最も早期の表現型の一つを反映する可能性があります(Houser, 2017)。
さらに、PDの主要なリスク因子である加齢は、ミクログリアの老化と慢性神経炎症と関連しています。老化ミクログリアは、SNcを含む加齢脳に蓄積し、反応性で炎症促進型の表現型を採用します(Shaerzadeh, 2020)。老化ミクログリアは、活性酸素種(ROS)と炎症性サイトカイン(例:TNF-αとIL-β)の放出増加、鉄の蓄積、および貪食能の低下を示します(Hong, 2024)。重要なことに、高齢のマウスではα-シヌクレインのレベルが高く、α-シヌクレインのクリアランスが遅いことが、加齢に伴うオートファジー-リソソーム系の機能障害に起因する可能性が示されています(Hong, 2024)。この加齢に伴うα-シヌクレインのクリアランス能力の低下は、神経炎症とドーパミン神経細胞の脆弱性を維持し、PD病理に重大な影響を及ぼす可能性があります。
結論として、神経炎症はパーキンソン病の病理における中心的なメカニズムであり、先天性免疫と獲得免疫の両方の免疫成分が病気の進行に寄与しています。神経炎症バイオマーカーによる早期検出は、より正確な診断を可能にする可能性があります(Chen, 2023;Youssef, 2023)。これらのバイオマーカーは、病気の進行を停止または遅らせることを目的とした標的免疫調節療法の開発にも導く可能性があります。
α-シヌクレインとグリア細胞の相互作用に影響を与える遺伝的要因
パーキンソン病の遺伝的要因はよく認識されており、SNCA、DJ-1、PRKN、PINK1、GBA1、 LRRK2遺伝子における 複数の既知の変異が含まれます。α-シヌクレインをコードするSNCA遺伝子は、家族性パーキンソン病の主要な要因です。SNCA変異(例:A53T およびA30P)や重複・三重化は、常染色体優性型の疾患と関連しています。さらに、SNCAの 変異は、特発性パーキンソン病のゲノムワイド関連研究で同定された最も重要な遺伝的リスク要因の一つです (Edwards, 2010)。PDの遺伝的要因は、ミトコンドリア機能障害と神経炎症とも関連しています(Saijo, 2009;Yao, 2023)。例えば、LRRK2( レウシンリッチリピートキナーゼ2)の変異は、リソソーム経路の機能障害やミトファジーの障害を含むミトコンドリア機能障害と関連しています(Borsche, 2021)。げっ歯類モデルでは、LRRK2ノックアウトは ミクログリアの活性化と神経細胞の喪失を減少させ、薬理学的LRRK2阻害は 神経炎症と神経変性をともに低下させます(Daher, 2014, 2015)。したがって、バイオマーカープロファイリングによるPDの「ミトコンドリアサブタイプ」の同定は、遺伝子特異的療法の開発を促進し、より個人に合わせた治療戦略の可能性を開いています(Borsche, 2021)。
α-シヌクレイン病理と神経炎症の相互作用を研究するために、げっ歯類モデルはどのように使用されていますか?
パーキンソン病(PD)のげっ歯類モデルは、トランスジェニック、ノックイン、ノックアウト、神経毒素、α-シヌクレイン前形成フィブリル(PFFs)誘導、およびウイルスベクター誘導アプローチを含む複数の種類が開発されています。これらのモデルの一部は、PDに関連する主要な病理学的特徴と行動障害を再現しています。しかし、主要な病理学的特徴を超え、PDにおける神経炎症とミトコンドリア機能障害の役割を解明する動物モデルは、特に貴重な資源です(Dovonou, 2023)。
神経毒性モデルはPD研究で広く使用されており、特にMPTPは急性ドーパミン神経毒性と著しい運動障害を引き起こします。このモデルの利点の一つは、SN(黒質)で強力なミクログリア活性化、NLRP3炎症小体活性化、およびプロ炎症性サイトカインの放出を引き起こすことです(Lee, 2019)。同様に、脳内投与によりドーパミン系に損傷を与える6-ヒドロキシドパミン(6-OHDA)損傷は、運動障害と非運動症状の両方を引き起こします。しかし、神経毒性モデルの関連性は、α-シヌクレインの凝集やレビー小体様包涵体の形成が欠如している点で制限されています。これらの制限にもかかわらず、神経毒性モデルは酸化ストレスプロセスと神経炎症の研究に適しています(Dovonou, 2023)。
異なるプロモーター下でヒト野生型(WT)またはパーキンソン病関連変異を過剰発現するトランスジェニックマウスも広く利用されています。これらのモデルは、パーキンソン病関連遺伝子の機能を調査するために重要です。例えば、WT、A53T、A30P、またはE46KSNCA変異 を発現するトランスジェニックモデルは、in vivoでパーキンソン病の病理を再現するために使用されています。特に、G2019SLRRK2過剰発現 マウスモデルは、神経炎症とミトコンドリア機能障害を示しています(Dovonou, 2023)。しかし、これらのモデルの利点にもかかわらず、α-シヌクレインの変性やシードを直接誘導するモデルが、PDに関連する病理学的メカニズムをより忠実に再現する可能性が指摘されています(Calabresi, 2023)。
病理学的に関連性の高いアプローチには、特定の脳領域にα-シヌクレインPFFを注入する方法があります。これらのフィブリルは内在性α-シヌクレインを種として病理を伝播し、PD病理の空間的・時間的進行を模倣します。注目すべきは、PFFの注入が強力なミクログリア反応とプロ炎症性シグナル伝達を引き起こし、α-シヌクレインの異常折り畳みと免疫活性化を直接結びつける点です。また、TREM2を減少させ、TLR4を増強し、サイトカインの放出を促進することで、α-シヌクレイン病理と神経炎症の関係を支持しています(Thomsen, 2021;Niskanen, 2025)。
ウイルスベクターベースのモデル、特にアデノ随伴ウイルス(AAV)を利用するものは、SNcなどの特定の脳領域において、ヒトの野生型または変異型α-シヌクレインの局所発現を可能にします。このアプローチにより、α-シヌクレインの凝集、神経細胞機能障害、細胞死を伴う広範なパーキンソン病様病理が時間経過とともに進行的に発症することが可能です(Ulusoy, 2010;Lundblad, 2012;Bourdenx, 2015;Phan, 2017)。さらに、AAVによるヒトα-シヌクレインの過剰発現は、SNにおけるミクログリアの活性化、適応免疫系の動員、およびプロ炎症性サイトカインの産生を引き起こします(Theodore, 2008;Sanchez-Guajardo, 2010)。したがって、AAVモデルは、神経炎症を含むPD病理学に関する貴重な知見を提供しつつ、領域特異的な標的化を可能にします。
要約すると、げっ歯類モデルは、PDにおけるα-シヌクレイン病理と神経炎症の相互作用を研究する上で依然として不可欠です。各モデルには長所と短所がありますが、それらを総合的に活用することで、疾患メカニズムと治療標的に関する貴重な知見が得られます。特に、α-シヌクレインPFFとウイルスベクターモデルは、病理学的および免疫学的特徴を忠実に再現しており、疾患修飾療法の非臨床試験における活用が支持されています。
α-シヌクレインと神経炎症を標的とした治療戦略にはどのようなものが開発されていますか?
現在のパーキンソン病(PD)の治療は、主にドーパミン作動薬を用いた運動症状の管理が中心であり、レボドパ(L-DOPA)が標準治療として確立されています。治療レジメンは、レボドパとドーパミンアゴニスト、COMT阻害薬、またはMAO-B阻害薬を組み合わせることで、ドーパミン作動能を最適化するように設計されています。しかし、初期には有効であるものの、長期使用はジスキネジア、運動変動、および多様な非運動症状などの合併症と関連しています。
これらの対症療法とは対照的に、疾患修飾戦略は主要な研究テーマとなっています。その中でも、α-シヌクレインを標的とする免疫療法と抗凝集剤が特に注目されています(Chatterjee, 2019;Alfaidi, 2024)。これらのアプローチは、α-シヌクレインの蓄積と病理学的拡散、およびグリア細胞で誘発される炎症反応を阻害することを目的としています。
免疫に基づくアプローチ
受動的および能動的な免疫化戦略が早期の有望性を示しています。能動的免疫化剤は、α-シヌクレインに対する免疫応答を引き起こすように設計されています。ペプチドベースのワクチンであるAFFITOPE® PD01AとPD03Aは、α-シヌクレインのオリゴマー形態に対する免疫応答を誘導し、その凝集と拡散を減少させることを目的とした能動的ワクチンです。これらのワクチンは、安全性および標的結合性を示す一連のフェーズ1臨床試験を完了しており、PD03AはPD01Aよりも低い抗体価を示しました(Volc, 2020;Poewe, 2021)。PD01Aはその後再製剤化され、ACI-7104.056と改名され、現在フェーズ2試験(NCT06015841)で調査中です。UB-312は、病原性α-シヌクレインに対する能動免疫を誘導するように設計された別の合成ペプチドベースのワクチンで、第1相a試験で患者の一部で髄液中のα-シヌクレインの有意な減少を示した後、現在第1相b試験(NCT05634876)を実施中です(Eijsvogel, 2024)。
受動免疫の分野では、凝集したα-シヌクレインのC末端を標的とするヒト化IgG1モノクローナル抗体であるPRX002(prasinezumab)は、モノマーよりも病理学的形態に対して高い親和性を示しています。第1b相試験では、安全で忍容性が良好であり、血清中の遊離α-シヌクレインを減少させることが示されました(Jankovic, 2018)。第2相試験(NCT03100149)では主要有効性エンドポイントを達成できませんでしたが、探索的解析では特定の患者サブグループで運動症状の進行遅延が示唆されました(Pagano, 2022;2024)。他のモノクローナル抗体も結果がまちまちです。BIIB054(cinpanemab)は、凝集したα-シヌクレインを標的とするモノクローナル抗体ですが、第2相試験で臨床的または画像に基づく有効性を示しませんでした(Lang, 2022)。一方、凝集したα-シヌクレインに選択的に結合し除去するように設計されたモノクローナル抗体BAN0805(exidavnemab)は、第1相試験で血漿中α-シヌクレインの用量依存的な減少と良好な忍容性を示しました。現在、第2相a試験の評価中です(NCT06671938)(Boström, 2024)。
NLRP3神経炎症経路を標的とする戦略も有望です。脳透過性NLRP3炎症小体阻害剤であるVTX3232は、ミクログリアの活性化と下流のサイトカイン放出を抑制することを目的としています。現在、早期PDを対象とした第2相a試験(NCT06556173)が進行中です。同様に、脳透過性NLRP3阻害剤であるVENT-02は、第1相a試験で血液中のIL-1βの有意な抑制を示した後、現在第1相b試験が進行中です(NCT06822517)。
疾患修飾療法の開発における課題と進展
疾患修飾療法の開発における主要な課題の一つは、PDの早期かつ正確な診断の困難さです。前駆期において、PDの症状は他のパーキンソン症候群の症状と重なることが多く、臨床試験の層別化や治療タイミングの決定を複雑化しています。疾患進行を追跡する信頼性の高いバイオマーカーの欠如も、治療効果の評価をさらに制限しています。
これらの課題に対応するため、高度な神経画像診断や 神経フィラメント軽鎖などの体液バイオマーカーが、早期診断、神経変性の追跡、臨床試験設計の改善を支援する手段として探索されています。また、α-シヌクレインと神経炎症に関連するバイオマーカーの同定にも、多大な努力が注がれています。これらのバイオマーカーは、広範な神経細胞の喪失が発生する前の治療窓を提供する可能性があります。神経炎症マーカーに基づくバイオマーカーは、PDの早期検出に有望であり、炎症マーカーを含む複数のマーカーを組み合わせることで診断精度が向上する可能性があります(Chen, 2023;Youssef, 2023)。
今後のPD治療は、α-シヌクレインを標的とした治療法と、炎症やミトコンドリア機能を調節する薬剤を組み合わせたものとなるでしょう。遺伝子プロファイルやバイオマーカープロファイルに基づく個人に合わせたアプローチは有効性を向上させる可能性があり、薬物送達技術や早期介入の進展は治療成果を向上させる可能性があります。
当社のチームは、パーキンソン病におけるミクログリア、アストロサイト、α-シヌクレインに関するご質問、または治療効果研究に使用しているパーキンソン病モデルに関する具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて詳しく見る
関連コンテンツ
パーキンソン病におけるミクログリア、アストロサイト、α-シヌクレインに関する最新情報、および神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
TREM2とミクログリア
TREM2の概要、ミクログリアにおけるその役割、神経変性疾患との関連性、および潜在的な治療への示唆について。
神経変性疾患におけるミクログリア、アストロサイト、およびタウ
グリア細胞による神経炎症が、アルツハイマー病およびその他のタウオパチーにおいて、タウタンパク質の凝集、伝播、および神経細胞の喪失を促進するメカニズム。
パーキンソン病治療薬開発のためのAAV α-シヌクレインモデル
疾患修飾治療薬の前臨床研究に使用するマウスおよびラットモデルにおけるアデノ随伴ウイルス(AAV)によるα-シヌクレイン発現の概要。
オートファジー、パーキンソン病、ドーパミン作動性ニューロン
パーキンソン病における障害のあるオートファジーが、ドーパミン作動性ニューロンにおける病理学的変化と神経変性につながる仕組みの概要。
ミトコンドリア機能障害とミクログリアおよびアストロサイト
アルツハイマー病、パーキンソン病、ALSを含む神経変性疾患におけるミトコンドリア機能障害のミクログリアおよびアストロサイトにおける役割。
ミクログリアの老化と神経変性疾患
本リソースでは、アルツハイマー病(AD)やパーキンソン病(PD)などの神経変性疾患におけるミクログリアの老化とその役割について概説します。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。